植物生长调节剂对冷胁迫下甜瓜幼苗生理特性及相关基因表达的影响
2022-06-25罗忍忍王瑞丹曹磊李丽丽李翔袁烨晏家茹侯娟胡建斌
罗忍忍,王瑞丹,曹磊,李丽丽,李翔,袁烨,晏家茹,侯娟,胡建斌
(河南农业大学园艺学院/河南省果树瓜类生物学重点实验室,河南 郑州 450002)
甜瓜(CucumismeloL.)为葫芦科(Cucurbitaceae)甜瓜属(Cucumis)1 a生蔓性草本植物,在中国栽培区域十分广泛。中国已连续30余年成为世界上甜瓜种植面积最大、产量最高的国家[1]。据《2021中国农业统计年鉴》,2020年中国甜瓜种植面积39.5万hm2,产量1 380.8万t,同比2019年分别增加了0.36%和1.85%,生产规模趋向稳定。甜瓜喜温耐热,整个生育期生长适温为25 ~ 35 ℃,幼苗期生长适温为20~25 ℃,当温度降至13 ℃以下时幼苗发育迟缓,10 ℃就停止生长,低于7 ℃则发生冷害[2]。中国华北地区早春气温较低,倒春寒天气时常发生,甜瓜在育苗、定植初期常常遭受冷胁迫,严重影响植株正常生长,导致果实发育延缓,上市期推迟[3]。由于生产中缺乏耐冷的甜瓜品种,经济效益较高的早春茬生产能力不足。因此,低温冷害已经成为限制中国北方地区甜瓜栽培效益提升的一个重要问题。
已有研究表明,冷胁迫可启动植物的防御系统,过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)等保护性酶活性增强,减少植物体内活性氧(reactive oxygen species,ROS)积累,降低逆境对植物体的伤害[4]。内源激素[脱落酸(abscisic acid,ABA)和茉莉酸(jasmonic acid,JA)]作为植物应对逆境胁迫的重要调节因子,参与了这一防御过程。ABA参与了植物生长发育调控及应对不同环境胁迫,低温胁迫能诱导ABA积累[5],外源施用ABA可缓解南瓜[6]、甜瓜[7]等植物冷害程度。此外,施用适宜浓度的细胞分裂素、GAs和ABA可提高西瓜叶片POD、SOD和CAT活性,降低幼苗过氧化氢(hydrogen peroxide,H2O2)及膜脂过氧化产物丙二醛(malondialdehyde,MDA)的积累,缓解低温导致的氧化伤害,增强西瓜抗冷性[8]。
在拟南芥中以CBF(C-repeat-binding factors)为核心的低温信号感知—转导调控机制已较为明确,一些激素信号途径中的调节组分也已被证明直接或间接参与CBF的转录调控,进而调节植物的耐冷性[9]。JAZ(jasmonate ZIM-domain)蛋白是茉莉酸(jasmonic acid,JA)信号途径的关键组分,JAZ1/2可与ICE1/2(inducer of CBF Expression)互作,抑制ICE1/2活性及冷信号关键基因CBFs的表达,进而调控植株耐冷性[10]。MYC2是一类含有bHLH(basic helix-loop-helix transcription factor)结构域的转录因子,能够激活或抑制JA信号途径的相关基因表达[11]。PP2C3(protein phosphatase 2C3)蛋白磷酸酶是一类丝氨酸/苏氨酸残基蛋白磷酸酶,参与ABA信号转导,发挥负调控功能[12]。PYL1作为ABA信号途径的受体蛋白参与ABA信号转导[13]。SOD1参与植株体内活性氧清除,是冷信号途径中的关键基因[14]。
大量研究已经证实激素在植物应对冷胁迫中起着重要作用,植物生长调节剂可直接或间接影响植物内源激素的水平,调控相应信号途径中基因的表达[15]。然而,这些研究大多来自拟南芥等模式植物上,在甜瓜中的研究报道极少。因此,本研究通过叶面喷施不同植物生长调节剂,研究其对冷胁迫下甜瓜幼苗生理特性和激素信号途径相关基因的影响,以此探讨植物生长调节剂影响甜瓜应对冷胁迫的生理机制,为甜瓜抗冷减害栽培技术提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为冷敏感型甜瓜品种‘HH94’,转录组测序材料为耐冷甜瓜品种‘581’、冷敏感品种‘906’,均由河南农业大学西甜瓜课题组提供。供试ABA购于北京酷来搏科技有限公司,氟啶酮(ABA合成抑制剂)和JA均购于大连美仑生物技术有限公司。
1.2 试验方法
1.2.1 幼苗的培育 试验于2021年春季在河南农业大学园艺学院瓜类遗传改良实验室进行。选取饱满且均匀一致的甜瓜种子,于55 ~ 60 ℃温汤浸种15~20 min,然后在30 ℃恒温培养箱中催芽,露白后播种于50孔(35 cm×70 cm)穴盘中,置于人工气候箱(RLD-600D-4)中育苗,温度设置为昼22 ℃/16 h、夜18 ℃/8 h,光照度20 000 lx,相对湿度75%。待子叶完全展平后每3 d浇水1次。两叶一心时,挑选整齐一致的植株进行植物生长调节剂喷施处理。
1.2.2 植物生长调节剂处理 植物生长调节剂ABA、氟啶酮(ABA合成抑制剂)和JA分别设3个处理水平,即:5、10、15 μmol·L-1ABA,0.05、0.1、0.2 μmol·L-1氟啶酮,1、2、5 μmol·L-1JA,以H2O作为对照(CK)。每天上午10:00叶面喷施1次,连喷5 d,每株喷施50 mL,以叶片正反两面全部润湿且无滴液为准。于最后1次喷施后的次日进行冷处理(4 ℃处理48 h,昼夜光照时间16/8 h,光照度10 000 lx,相对湿度维持在75%),在常温下恢复3 d后,对植株形态、生理指标进行测定。每个处理20株,3次生物学重复,每次重复随机选取3株幼苗。
1.3 项目测定
1.3.1 生长指标测定 采用直尺(单位:mm)测量幼苗株高(植株根颈部到顶部心叶之间的距离);游标卡尺(精度:0.02 mm)测量茎粗(下胚轴中部横径)。将植株用去离子水洗净并吸干表面水分,使用电子天平测定鲜质量。
1.3.2 生理指标的测定 对幼苗的第1片真叶进行生理指标测定。参照王艳玲[16]的冷害分级标准对甜瓜叶片受损程度进行分级。采用电导率仪(雷磁DDB-303A)测定叶片的相对电导率[17]。叶绿素荧光强度测定采用叶绿素荧光仪(捷克PSI FluorPen FP110)测定,首先使测定材料在黑暗条件下适应30 min,然后调整参数,Super值为25%,Shutter值为1,Sensitivity值为26%。脯氨酸含量的测定参照王乾[18]的方法。POD、SOD和CAT的测定参照王学奎等[19]的方法。
1.3.3 荧光定量PCR分析 总RNA的提取采用植物RNA提取试剂盒(0416-100GK,北京华越洋生物),具体操作步骤参照说明书。利用Hiscript III 1st strand cDNA synthesis kit反转录试剂盒(Vazyme)将RNA反转录成cDNA。采用ChamQ Universal SYBR qPCR Master Mix试剂盒(Vazyme)进行qRT-PCR,具体反应程序参考说明书。qRT-PCR反应在CFX96实时荧光定量PCR仪(美国Bio-Rad)上进行。以甜瓜基因Actin(MELO3C008032)为内参基因,荧光定量引物见(表1)。采用 2-ΔCt法计算基因相对表达量[20]。

表1 用于荧光定量PCR分析的引物序列Table 1 Primer sequences for qRT-PCR analysis
1.3.4 冷信号通路差异表达基因筛选与表达分析 作者前期对4 ℃处理3 h的甜瓜幼苗(‘906’和‘581’)进行了转录组测序,测序数据已存贮于公共数据库(NCBI登录号:PRJNA808180)。以此为数据源,采用P-value≥0.05和 log2(Fold_Change)≥1.0标准,筛选参与ABA和JA信号通路冷响应相关的差异表达基因。采用TB tools软件绘制差异表达基因热图。
1.4 数据分析
采用SPSS 20.0对试验数据进行Duncan’s多重比较检验,分析各处理与对照的差异显著水平(P<0.05)。分别采用Microsoft Excel 2019和Graph Pad Prism软件进行绘制图表。
2 结果与分析
2.1 不同浓度植物生长调节剂处理对冷胁迫下甜瓜幼苗表型与叶绿素荧光的影响
对不同浓度植物生长调节剂喷施后冷处理的甜瓜幼苗表型、冷害级数、叶绿素荧光强度进行统计(图1)。结果表明,根据王艳玲[16]冷害分级标准,在不同浓度ABA处理中,10 μmol·L-1ABA处理后幼苗真叶均完好,无明显伤害症状(0级)(图1-A),甜瓜幼苗叶片叶绿素荧光较CK有所增强(图1-B),5和15 μmol·L-1ABA处理后叶片呈现轻微损伤(1级)。在不同浓度氟啶酮处理中,0.1 μmol·L-1氟啶酮处理叶片损伤明显(3级),叶绿素荧光较CK减弱,但0.05和0.2 μmol·L-1氟啶酮处理的叶片损伤较小。在不同浓度JA处理中,5 μmol·L-1JA处理后叶片无明显伤害症状(0级),叶绿素荧光较CK增强,而1和2 μmol·L-1JA处理后叶片轻微损伤(1级)。结果表明,与CK相比,在不同植物生长调节剂中ABA和JA处理对甜瓜叶片损伤的缓解作用最为明显,且以10和5 μmol·L-1的浓度效果最好。
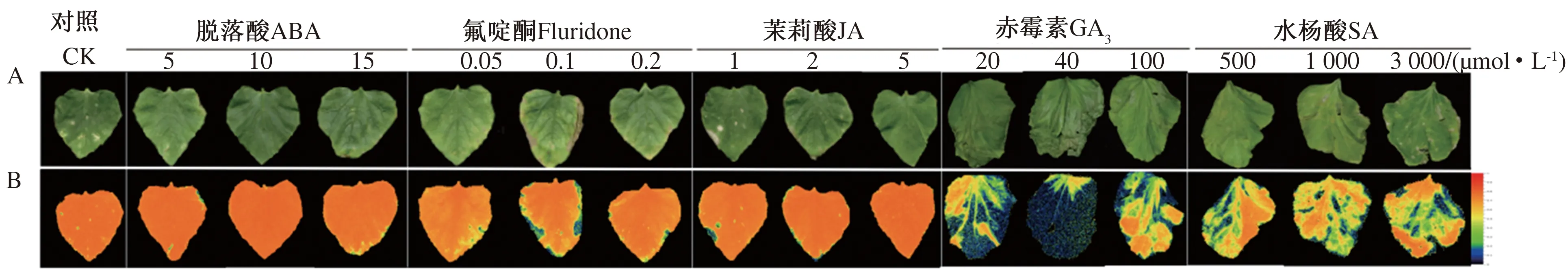
A.叶片表型;B.叶绿素荧光图。A.Leaf phenotype;B.Chlorophyll fluorescence diagram.图1 喷施不同浓度ABA、氟啶酮和JA对冷胁迫下甜瓜幼苗表型与叶绿素荧光的影响Fig.1 Effects of different concentrations of ABA,Fluridone and JA on phenotype and chlorophyll fluorescence of melon seedlings under chilling stress
2.2 不同浓度植物生长调节剂处理对冷胁迫下甜瓜幼苗生长指标的影响
为进一步研究ABA、氟啶酮(ABA合成抑制剂)及JA处理对植株生长指标的影响,对甜瓜幼苗的株高、茎粗和鲜质量进行测定,结果见表2。与CK相比,5 μmol·L-1ABA处理后甜瓜幼苗株高、茎粗和鲜质量分别增加47.83%、17.76%和21.11%,10 μmol·L-1ABA处理后分别增加了40.43%、13.16%和35.68%,15 μmol·L-1ABA处理后株高和鲜质量分别增加了50.87%和41.21%,茎粗增加24.34%;0.05 μmol·L-1氟啶酮处理后幼苗株高、茎粗和鲜质量分别增加30.43%、28.95%和41.21%,0.1 μmol·L-1氟啶酮处理后分别增加75.22%、24.01%和65.83%,0.2 μmol·L-1氟啶酮处理后甜瓜幼苗株高、茎粗和鲜质量显著增加,分别增加了49.13%、31.58%和74.37%;1 μmol·L-1JA处理后甜瓜幼苗株高、茎粗和鲜重分别增加47.83%、10.75%和41.14%,2 μmol·L-1JA处理后增加55.22%、21.71%、55.78%,5 μmol·L-1JA处理后分别显著增加83.91%、41.12%和91.96%。由此可知,冷胁迫下,施用不同浓度的植物生长调节剂对甜瓜幼苗的株高、茎粗和鲜质量均有促进作用,但以15 μmol·L-1ABA和0.2 μmol·L-1氟啶酮及5 μmol·L-1JA的处理效果最为明显。

表2 不同浓度ABA、氟啶酮和JA对冷胁迫下甜瓜幼苗生长的影响Table 2 Effects of different concentrations of ABA,Fluridone and JA on the growth of melon seedlings under chilling stress
2.3 不同浓度植物生长调节剂处理对冷胁迫下甜瓜幼苗生理指标的影响
对不同浓度ABA、氟啶酮和JA喷施后冷处理的甜瓜幼苗的相对电导率和脯氨酸含量进行测定,结果见图2。与CK相比,5 μmol·L-1ABA处理后甜瓜幼苗相对电导率降低20.00%(图2-A),脯氨酸含量增加50.21%(图2-B),10 μmol·L-1ABA处理效果最为明显,幼苗相对电导率降低32.03%,脯氨酸含量增加217.59%,两项指标均达显著水平,15 μmol·L-1ABA处理后幼苗相对电导率降低25.80%,脯氨酸含量增加72.27%;0.05 μmol·L-1氟啶酮处理后幼苗相对电导率和脯氨酸含量均有所降低,分别降低11.59%和1.21%,0.1 μmol·L-1氟啶酮处理后幼苗相对电导率降低幅度不大,但脯氨酸含量显著降低了22.80%,0.2 μmol·L-1氟啶酮处理后幼苗相对电导率显著降低了22.78%,脯氨酸含量也有所降低,但降低幅度较CK差异不显著;1 μmol·L-1JA处理后幼苗相对电导率变化不大,但脯氨酸含量降低了81.17%,2 μmol·L-1JA处理后幼苗相对电导率和脯氨酸含量分别降低了11.00%和19.46%,5 μmol·L-1JA处理后相对电导率降低26.30%,脯氨酸含量增加187.37%,与CK差异显著。因此,ABA和JA处理能显著降低甜瓜幼苗叶片的相对电导率、提高脯氨酸含量,其浓度分别以10和5 μmol·L-1的效果最佳。

图2 不同浓度ABA、氟啶酮和JA对冷胁迫下甜瓜幼苗相对电导率(A)和脯氨酸含量(B)的影响Fig.2 Effects of different concentrations of ABA,Fluridone and JA on relative conductivity (A) and proline content (B) of melon seedlings under chilling stress
2.4 不同浓度植物生长调节剂处理对冷胁迫下甜瓜幼苗保护性酶活性的影响
不同浓度ABA、氟啶酮和JA处理后甜瓜幼苗SOD、CAT和POD活性变化见图3。结果表明,与CK相比,5 μmol·L-1ABA处理后幼苗SOD(图3-A)、CAT(图3-B)和POD(图3-C)活性均略有下降,分别降低了7.11%、0.59%和11.54%,10 μmol·L-1ABA处理后幼苗SOD增加17.61%,CAT和POD活性分别增加61.20%和88.62%,且差异均达显著水平,而15 μmol·L-1ABA处理后幼苗SOD活性增加5.52%,CAT活性显著降低48.79%,POD活性降低7.53%;0.05 μmol·L-1氟啶酮处理后幼苗SOD活性显著降低26.95%,CAT和POD活性分别降低13.52%和6.94%,0.1 μmol·L-1氟啶酮处理后幼苗SOD和POD活性分别降低40.08%和53.47%,CAT活性降低了34.83%,0.2 μmol·L-1氟啶酮处理后幼苗SOD活性降低4.96%,POD活性显著降低45.14%,但CAT活性增加了12.05%;1 μmol·L-1JA处理后幼苗SOD和CAT活性分别增加2.51%和32.33%,POD活性降低15.92%,2 μmol·L-1JA处理后幼苗SOD活性增强了21.31%,CAT和POD活性分别降低33.14%和38.19%,5 μmol·L-1JA的处理效果最为明显,幼苗SOD活性降低18.18%,CAT和POD活性分别显著增强124.47%和171.47%。此结果说明,在冷胁迫下,10 μmol·L-1ABA和5 μmol·L-1JA处理对提高甜瓜幼苗CAT和POD活性作用效果最佳,0.1 μmol·L-1氟啶酮处理对幼苗SOD、CAT和POD活性的抑制作用最强。

图3 不同浓度ABA、氟啶酮和JA对冷胁迫下甜瓜幼苗SOD(A)、CAT(B)和POD(C)活性的影响Fig.3 Effects of different concentrations of ABA,Fluridone and JA on SOD (A) ,CAT (B) and POD (C) activities of melon seedlings under chilling stress
2.5 最适浓度植物生长调节剂处理对冷胁迫下甜瓜幼苗激素信号和活性氧清除酶相关基因的影响
基于幼苗形态、生理指标及酶活性的变化,综合分析发现10 μmol·L-1ABA、0.1 μmol·L-1氟啶酮和5 μmol·L-1JA处理效果最好。据此,进一步分析其处理后JA信号途径(CmJAZ1、CmMYC2)和ABA信号途径(CmPP2C3、CmPYL1)相关基因以及活性氧清除酶基因CmSOD1的表达变化。结果表明,与CK相比,ABA处理后CmJAZ1、CmMYC2和CmPP2C3的表达量显著下调,CmPYL1和CmSOD1的表达量显著上调。氟啶酮处理后CmJAZ1、CmMYC2、CmPP2C3、CmPYL1和CmSOD1的表达量均显著下调,其中CmPYL1和CmSOD1下调至CK的1/3。JA处理后CmJAZ1、CmMYC2和CmPP2C3的表达量显著下调,CmPYL1和CmSOD1的表达量变化不明显(图4)。这些结果说明,3种植物生长调节剂处理影响了JA和ABA信号途径中相关基因和活性氧清除酶基因的表达,但其表达方式和表达水平有一定差异,甜瓜幼苗的耐冷性可能存在复杂的调控机制。

图4 ABA、氟啶酮和JA对冷胁迫下甜瓜幼苗叶片内激素信号转导和活性氧清除酶相关基因的影响Fig.4 Effects of ABA,Fluridone and JA on hormone signal transduction and reactive oxygen scavenger enzyme related genes in leaves of melon seedlings under chilling stress
2.6 ABA与JA信号通路冷相关差异表达基因的筛选及表达分析
为了筛选ABA与JA信号通路中响应冷胁迫的差异表达基因,对甜瓜耐冷、冷敏材料在冷胁迫下的转录组数据进行分析。结果表明,ABA和JA信号通路中共有11个差异表达基因与冷胁迫相关(表3,图5)。耐冷材料冷处理后,5个ABA信号途径基因(MELO3C017358、MELO3C026019、MELO3C002133、MELO3C010850、MELO3C026062)和2个JA 信号通路基因(MELO3C013558、MELO3C006046)表达上调,2个ABA信号途径基因(MELO3C021422和MELO3C009468)表达下调;冷敏材料冷处理后,4个ABA(MELO3C026019、MELO3C023805、MELO3C021421和MELO3C021422)和1个JA信号途径基因(MELO3C013558)表达上调,1个ABA(MELO3C002133)和1个JA 信号途径基因(MELO3C006046)表达下调。共有2个基因(MELO3C013558、MELO3C026019)在耐冷和冷敏材料之间表达模式相同(均为上调),4个基因(MELO3C002133、MELO3C021422、MELO3C006046和MELO3C026062)表达模式相反,说明甜瓜耐冷性存在不同的调控机制。结合基因表达模式和功能注释(表3),选择脱落酸不敏感蛋白同源异构体基因MELO3C021422和脱落酸受体基因MELO3C026019进行ABA处理后表达量检测。结果表明,与CK相比,在喷施ABA并进行4 ℃冷处理后,MELO3C021422和MELO3C026019表达量显著上调(图6),分别上调20.36和2.14倍,推测这2个基因通过介导ABA信号途径参与甜瓜耐冷性的调控,具有潜在的应用价值。

906_0:冷敏感甜瓜906 4 ℃处理0 h;906_3:冷敏感甜瓜906 4 ℃处理3 h;581_0:耐冷甜瓜581 4 ℃处理0 h;581_3:耐冷甜瓜581 4 ℃处理3 h。906_0:Cold-sensitive melon 906 is treated at 4 ℃ for 0 h;906_3:Cold-sensitive melon 906 is treated at 4 ℃ for 3 h;581_0:Cold resistant melon 581 is treated at 4 ℃ for 0 h;581_3:Cold resistant melon is treated at 4 ℃ for 3 h.图5 转录组中ABA和JA信号通路相关差异表达基因的表达分析Fig.5 Expression analysis of differentially expressed genes related to ABA and JA signaling pathway in transcriptome

图6 ABA处理后冷胁迫下MELO3C021422(A)和MELO3C026019(B)基因的表达分析Fig.6 Expression analysis of MELO3C021422(A)and MELO3C026019(B) genes under cold stress after ABA treatment

表3 转录组中ABA与JA信号通路冷响应相关的差异表达基因Table 3 Differentially expressed genes associated with cold response of ABA and JA signaling pathway in transcriptome
3 结论与讨论
冷胁迫可明显抑制喜温植物的生长,影响植株对水分和养分的吸收,引起植株代谢失调,株高、茎粗、叶面积等均表现出生长缓慢甚至停滞的现象[15]。ABA和JA与植物胁迫响应密切相关,能够提高植株的抗逆能力,植株内源ABA的合成主要在叶片和根部[21]。本研究结果显示,喷施ABA和JA能显著促进甜瓜幼苗在冷胁迫下的生长。施用ABA合成抑制剂氟啶酮后,植株长势虽出现一定的提高,但变化趋势与ABA处理相反,并随着浓度的增加植株长势逐渐减弱。这可能是由于氟啶酮抑制了植株叶片内源ABA的合成,但根部合成的ABA部分抵消了氟啶酮的抑制作用,进一步暗示了ABA在甜瓜响应冷胁迫中的重要功能。
当植物受到冷胁迫时,细胞膜遭到破坏,质膜透性增加,而外源ABA与JA能提高脯氨酸含量,降低细胞膜受损程度,提高植物耐冷性。相对电导率和脯氨酸含量是反映植物细胞膜透性和受损伤程度的重要指标。适宜浓度的JA处理能够降低相对电导率和提高脯氨酸含量,进而提高水稻[4]和西瓜[8]的耐冷性。本研究发现,10 μmol·L-1ABA与5 μmol·L-1JA处理后,能够显著降低冷胁迫下甜瓜叶片的相对电导率,提高脯氨酸含量,而ABA的生物合成抑制剂(0.1 μmol·L-1氟啶酮)处理效果与ABA和JA处理相反。此结果说明,适宜浓度的ABA和JA处理可通过提高甜瓜脯氨酸含量来维持细胞膜的稳定性,从而减少细胞内电解质外渗以保护细胞,进而提高甜瓜的耐冷性。
在植物受到逆境胁迫时,体内的POD、CAT和SOD保护性酶活性会增强,减少体内活性氧(ROS)积累,降低逆境对植物的损害程度[4]。外施JA能够显著提高西瓜幼苗抗氧化酶活性,增强植株的抗冷性[22]。本试验中,在冷胁迫下,喷施10 μmol·L-1ABA后甜瓜叶片POD、CAT和SOD酶活性均显著提高,喷施5 μmol·L-1JA后甜瓜叶片CAT和POD酶活性显著增强,而0.1 μmol·L-1氟啶酮处理导致3种酶活性均显著下降。结果说明,外施ABA能通过提高POD、CAT和SOD活性来增强甜瓜耐冷性,而JA则主要通过提高CAT和POD活性来增强甜瓜耐冷性。这与杨楠等[23]在黄瓜中的研究结果一致。
植物耐冷性是受多基因控制的复杂性状。在拟南芥中,JAZ1是JA信号途径中ICE1的抑制因子,能够结合ICE1抑制其表达,进而降低植物的耐冷性[10]。MYC2是ABA、SA、赤霉素(GAs)和生长素(IAA)信号通路间的重要枢纽[11]。PYL作为ABA的直接受体参与ABA信号通路,蛋白磷酸酶PP2C3也参与ABA信号调节[12-13]。在本研究中,ABA处理后甜瓜幼苗叶片中CmPP2C3的表达量较CK显著下降,而CmMYC2的表达量较氟啶酮处理显著升高。CmPYL1与CmSOD1基因在ABA处理后表达量显著高于CK和氟啶酮处理。说明外施ABA能通过提高CmMYC2、CmPYL1与CmSOD1基因的表达以及降低CmPP2C3的表达提高甜瓜耐冷性。而JA处理后CmPP2C3、CmJAZ1和CmMYC2的表达量显著降低,说明外施JA可能通过降低CmPP2C3、CmJAZ1和CmMYC2的表达提高甜瓜耐冷性。因此,在甜瓜中,外施ABA和JA均能提高植株耐冷性,但其调控机制不同。
通过对冷胁迫下甜瓜转录组数据进行分析,筛选到11个与ABA和JA信号转导途径相关的差异表达基因,包含茉莉酸酰胺合成酶、钙依赖性脂质结合蛋白、ABA受体蛋白及ABA调控蛋白等基因。其中,2个基因(MELO3C026019和MELO3C021422)在冷胁迫下表达模式不同,且受外源ABA的诱导。MELO3C026019作为脱落酸受体与拟南芥AtPYL4基因高度同源,而AtPYL4作为脱落酸传感器参与ABA信号转导[24],进而调控植物的抗逆性。这与其同源基因的表达分析结果一致,说明二者可能具有相同或相似的功能。MELO3C021422是脱落酸不敏感蛋白同源异构体基因,是拟南芥AtbZIP67的同源基因,而AtbZIP67参与调控拟南芥种子休眠[25],其同源基因MELO3C021422参与甜瓜耐冷性调控,是该基因功能的进一步拓展,bZIP67基因可能具有多种生物学功能。因此,这2个基因参与甜瓜耐冷性调控的分子机制值得进一步研究。
