不同质量分数蔗糖溶液处理对牡丹切花瓶插保鲜的影响1)
2022-06-24孔鑫张丽丽凌怡闫丽关雯雨张浩然董丽
孔鑫 张丽丽 凌怡 闫丽 关雯雨 张浩然 董丽
(北京林业大学,北京,100083)
牡丹(Paeoniasuffruticosa)属芍药科芍药属牡丹组植物[1],为中国特有[2]。作为中国传统名花,牡丹因其花大色艳、花香芬芳和美好寓意而备受人们喜爱。牡丹作为切花市场重要的花材之一,切花在脱离母体后,由于环境胁迫和营养供应不足,衰老速度加快,观赏效果变差,瓶插品质明显不如在体花朵,严重制约了牡丹切花产业的发展[3-6]。因此,研究牡丹切花瓶插简便高效的保鲜措施具有重要的现实意义。
蔗糖作为最常见的鲜切花瓶插液的成份,对切花有多种效应,可以为鲜切花提供能源、呼吸基质,调节水分平衡等[7]。研究发现糖的持续处理比脉冲处理更能有效地延长切花瓶插寿命,改善切花品质[8-9],说明糖类物质对采后切花品质的改善具有重要作用。糖类物质对切花品质的改善作用与糖的浓度息息相关,糖类物质浓度过低,无法正常供应切花生长发育,浓度过高则会影响渗透压调节,抑制花枝吸水,缩短切花寿命。低浓度蔗糖处理能改善牡丹切花品质,高浓度蔗糖处理影响切花花枝吸水[10],因此,选择适宜的瓶插蔗糖浓度对提高切花的寿命具有重要作用。本研究以牡丹切花品种‘洛阳红’为试验材料,分析不同浓度蔗糖溶液瓶插处理,对牡丹切花衰老过程中的形态特征、瓶插寿命、生理特性等的影响,为牡丹切花采后保色保鲜技术提供理论依据。
1 材料与方法
1.1 试验材料
试验于2020年12月在北京林业大学国家花卉工程中心花卉生理与应用实验室进行。牡丹品种‘洛阳红’(Paeoniasuffruticosa‘Luoyanghong’)1级(S1)切花采自山东省菏泽市曹州温室牡丹园。清晨采切盆花S1级花枝150枝,花枝长约30 cm,枝干上保留2~3片复叶。切花采收后,于低温环境下12 h内运回实验室,经过水剪(花枝长约25 cm)、去除多余叶片后复水1 h备用。
1.2 试验处理
将S1级切花瓶插于不同浓度蔗糖溶液,蔗糖质量分数梯度设为0.5%(A1)、1%(A2)、2%(A3)、4%(A4)、6%(A5)的处理,以蒸馏水瓶插为对照(CK);溶液中均加入0.5 ml/L的NaClO溶液抑制细菌生长,瓶插液每天更换。瓶插条件为:温度(23±1)℃;相对湿度50%~60%;光照强度约40 μmol·m-2·s-1;光周期为12 h光照、12 h黑暗。
待各处理切花开放至2级(S2)、3级(S3)、4级(S4)和5级(S5)时进行随机取样,各级别取样重复3次,取切花中瓣(4~6层花瓣)测定花色表型后,用锡箔纸包好液氮速冻,置于冰箱内-80 ℃保存,用于后续生理指标测定。
1.3 牡丹切花形态指标测定
在切花开放过程中,在不同处理时间(0、4、8、12、24、48、72、96 h)记录开花指数、花径最大值、花枝鲜质量,并计算花径增大率与花枝鲜质量变化率;在切花达到6级(S6)时,记录瓶插寿命。瓶插期间各形态指标数据均取5支切花数据的平均值。
花径增大率=[(当前花径最大值-处理前花径)/处理前花径]×100%;
花枝鲜质量变化率=[(当前花枝鲜质量-前一测量时点花枝鲜质量)/前一测量时点花枝鲜质量]×100%。
瓶插寿命:从切花瓶插时起到花朵开始出现蓝变、萎蔫、脱落或外层花瓣明显卷缩的瓶插时间。
1.4 牡丹切花花色表型指标的测定
对不同处理的各个开放级别切花的花色进行测定。使用色差仪(NF333分光光度计,日本电色株式会社)在C/2°光源下对各处理切花中层花瓣中部进行花色测定,记录花色参数L*值(明度)、a*值(红度)和b*(黄度)值。每个处理测量5枝切花。通过测定的a*值、b*值,计算出C*值(彩度),C*=(a*2+b*2)1/2。
1.5 牡丹切花生理指标的测定
称取各处理各级别的切花中层花瓣冻样0.2 g,经液氮研磨成粉末后,分别加入1 mL预冷的磷酸缓冲液,后定容至5 mL,在10 000 r/min下离心15 min,上清液即为待测酶液,然后根据参考文献[11]的方法测定丙二醛(MDA)和可溶性蛋白质量分数。取各处理的各级别3支切花冷冻,各切花称取0.1 g中层花瓣冻样,经液氮研磨成粉末后,加入5 mL体积分数为1%的盐酸与甲醇的混合溶液,于4 ℃条件下在黑暗中提取24 h。提取液过滤后,使用紫外分光光度计测定花青素苷质量分数。
1.6 数据分析
数据采用Excel、SPSS分析。
2 结果与分析
2.1 不同处理对牡丹切花开放和衰老进程及瓶插寿命的影响
由表1可知,瓶插前8 h内各处理之间切花的开花指数没有显著差异;当处理至12 h,CK平均开花指数已达到3.4,A3与A4处理下的开花指数显著低于CK(P<0.05),且此后一直维持这种趋势直至瓶插寿命结束。除A3、A4处理外,其他处理切花均在瓶插至48 h左右开放至5级。与A3与A4处理相比,A5处理加速了切花的开放进程,但后期开花指数仍然显著低于CK。
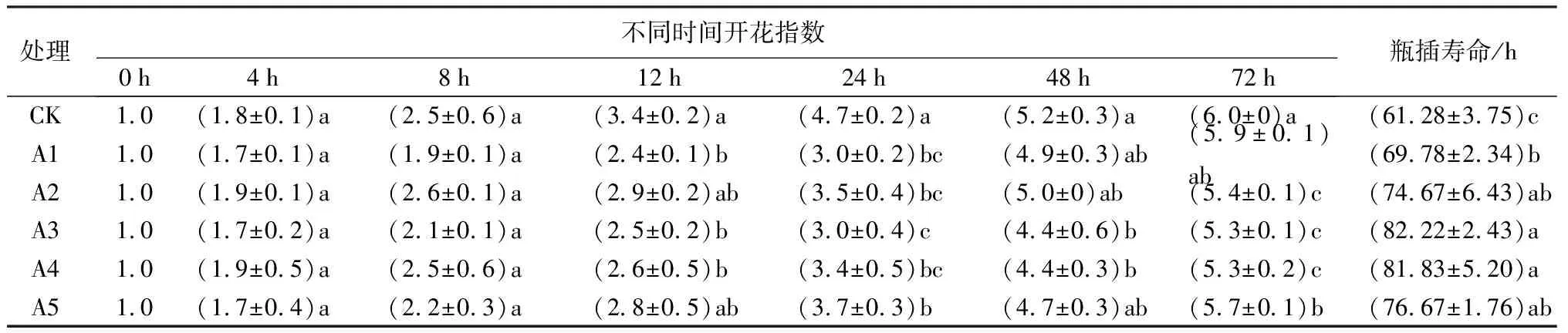
表1 不同蔗糖浓度对牡丹切花开花和衰老进程及瓶插寿命的影响
用不同浓度蔗糖对牡丹切花进行瓶插处理,发现A3、A4处理显著延缓了切花的衰老进程,两种处理下的牡丹切花约在瓶插60 h时才达到5级,比对照组滞后约24 h。对照组切花在整个瓶插过程中的蓝变现象最为明显;A5处理下的切花达到盛花期之后迅速蓝变,花瓣边缘皱缩干枯,瓶插后期表现不如其他处理。与对照组相比,本实验中,各处理均显著延长了牡丹切花的瓶插寿命,且A3、A4处理下瓶插寿命延长效果更为显著(P<0.05)。
2.2 不同处理对牡丹切花花径变化的影响
由表2可知,随着瓶插时间的增加,切花花径增大率均呈先增加后降低的趋势。大部分处理切花在瓶插48 h达到花径峰值,而A3与A4处理使切花花径峰值延迟到72 h,且之后花径减小速率明显变慢。在瓶插前48 h,对照组与各处理组间的切花花径增大率均有不同程度的增加;与各处理相比,对照组切花花径增大速率在瓶插前24 h最快,而各处理增大速率最快出现在24~36 h。A3处理切花在瓶插72 h达到花径最大值,且大于对照组切花。瓶插72~96 h各处理组的切花花径均有不同程度的减小,对照组切花花径减小速率最快。
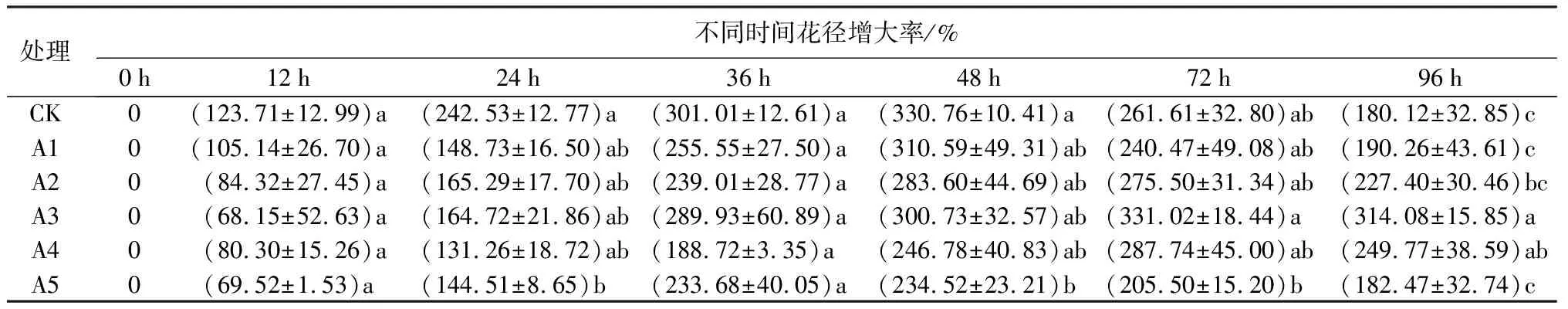
表2 不同蔗糖浓度对牡丹切花‘洛阳红’花径增大率的影响
2.3 不同蔗糖浓度对牡丹切花花色表型的影响
由图1可知,盛花期(S5)各处理下牡丹花色表型与对照相比,A3、A4、A5处理使切花花色明显加深,A5处理效果最为显著。

A1、A2、A3、A4、A5分别表示蔗糖质量分数梯度为0.5%、1%、2%、4%、6%的处理。
由表3可知,牡丹切花中层花瓣花色表型(非斑部),大部分处理明度(L*)随着瓶插时间的延长而升高,S2和S3时期,A1、A2处理与对照组切花的明度无显著差异,且A1处理在这两个时期均高于A3、A4、A5处理的L*值。盛花期的对照组明度显著高于其他各处理组,其中A3处理的明度值最低。
对照组切花红度(a*)随开放级别增加呈持续下降趋势,而各处理切花的红度均有不同程度的增加。各处理切花红度在S2时期未表现出明显规律,而S3~S5时期,各处理组的红度均大于对照组,尤其是S5时期,A3、A4、A5处理的切花,红度明显大于A1、A2处理。
随着开放级别增加,各处理切花的黄度(b*)值均呈现降低-升高的趋势,而对照组切花呈持续升高趋势,并在S5时期达到最大值。总体来看,A3处理切花的黄度值低于其他处理,盛花期A5处理b*值与对照组相比无显著差异。
花瓣的彩度(C*)最能体现花朵的整体色彩水平。S2~S5时期,对照组切花的彩度值基本呈下降趋势,而各处理组切花C*值变化先升高后降低。与对照组相比,不同处理的切花彩度值均有所增加,在开放后期更为明显,与肉眼观察一致。

表3 不同处理牡丹切花的花色表型

处理不同开花级别的a∗值(红度)S1S2S3S4S5CK24.68±4.08(26.03±0.88)ab(21.72±3.16)c (16.64±2.12)b(16.01±1.58)dA124.68±4.08(23.88±2.71)b(27.69±7.92)abc(22.47±3.16)ab(20.90±2.50)cdA224.68±4.08(29.55±6.66)ab(26.32±8.20)bc(26.15±5.26)a(23.06±2.00)bcA324.68±4.08(29.96±4.83)ab(30.59±4.86)ab(24.68±3.01)a(30.24±6.48)aA424.68±4.08(25.70±5.62)b(34.87±3.36)a(26.34±6.96)a(28.96±8.76)abA524.68±4.08(31.73±1.13)a(26.79±3.10)abc(29.44±4.66)a(33.48±3.71)a
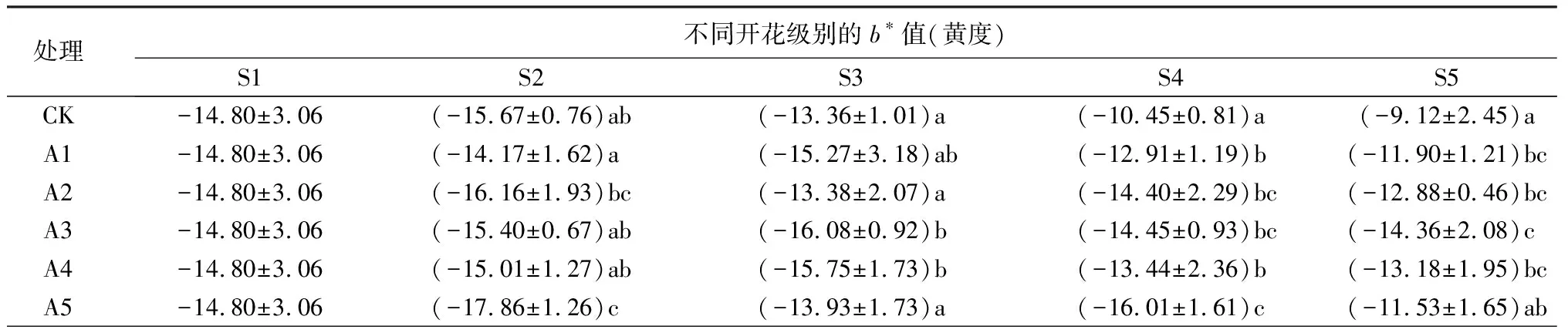
续(表3)
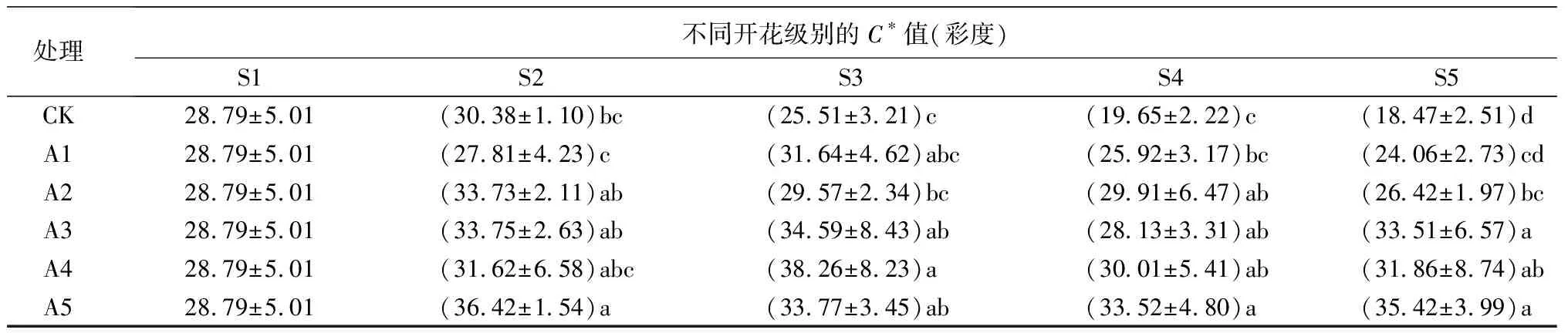
处理不同开花级别的C∗值(彩度)S1S2S3S4S5CK28.79±5.01(30.38±1.10)bc(25.51±3.21)c(19.65±2.22)c(18.47±2.51)dA128.79±5.01(27.81±4.23)c(31.64±4.62)abc(25.92±3.17)bc(24.06±2.73)cdA228.79±5.01(33.73±2.11)ab(29.57±2.34)bc(29.91±6.47)ab(26.42±1.97)bcA328.79±5.01(33.75±2.63)ab(34.59±8.43)ab(28.13±3.31)ab(33.51±6.57)aA428.79±5.01(31.62±6.58)abc(38.26±8.23)a(30.01±5.41)ab(31.86±8.74)abA528.79±5.01(36.42±1.54)a(33.77±3.45)ab(33.52±4.80)a(35.42±3.99)a
2.4 不同处理对牡丹切花鲜质量变化的影响
如表4所示,随着瓶插时间的增加,切花花径增大率呈先增加后降低的趋势。在整个瓶插过程中,对照组切花鲜质量变化程度最大,在瓶插前36 h迅速吸水后迅速失水,在72 h之后鲜质量变化率趋于平缓并维持在较低值。A2与A4处理,切花鲜质量变化率峰值出现在12 h,而A3、A5处理,切花鲜质量变化率的峰值出现在24 h;瓶插第36 h,A5处理与其他处理相比,切花鲜质量变化率最大,花枝持续吸水,而后迅速失水;A3、A4处理在瓶插后期,切花鲜质量变化率高于其他处理。
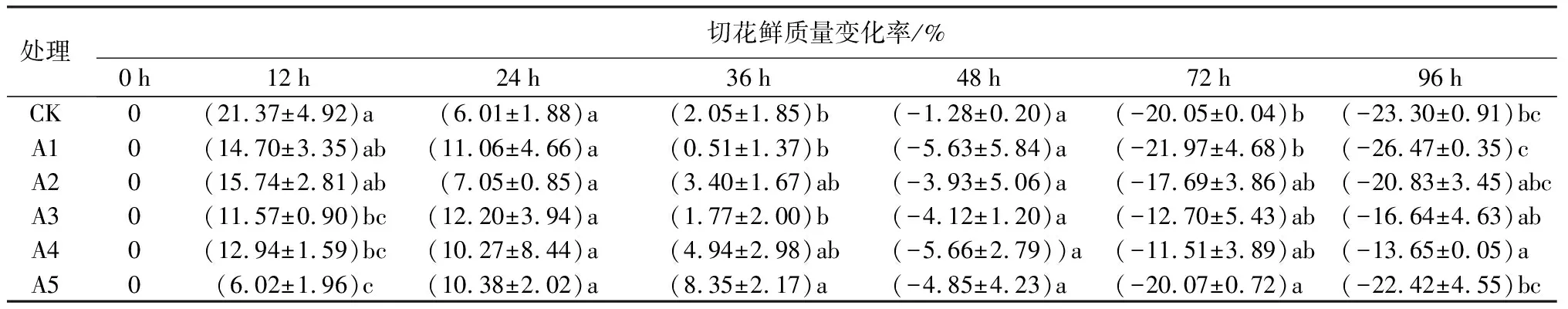
表4 不同蔗糖浓度对牡丹切花鲜质量变化率的影响
2.5 不同处理对牡丹切花丙二醛质量摩尔浓度和可溶性蛋白质量分数的影响
由表5可知,A3处理的丙二醛的质量分数先增后减再增,其他处理与对照组变化趋势大致相同,均随着开放级别不断增加。A3处理的丙二醛的质量摩尔浓度在S2时期达到峰值,其他处理与对照组丙二醛的质量摩尔浓度均在S5级达到最大值,且对照组在各个时期均高于其他处理组。
牡丹切花花瓣中可溶性蛋白质量分数,所有处理与对照组趋势大致相同,可溶性蛋白质量分数均先增加后减少。其中对照组与A5处理组在S2时期可溶性蛋白质量分数达到峰值,而其他处理的可溶性蛋白质量分数的峰值则出现在S3时期。总体来看,A3、A4处理在开放后期的可溶性蛋白质量分数显著大于对照组;在后期,A1、A5处理与对照组相比可溶性蛋白质量分数没有显著差异(P>0.05)。

表5 不同处理对牡丹切花丙二醛质量摩尔浓度的影响
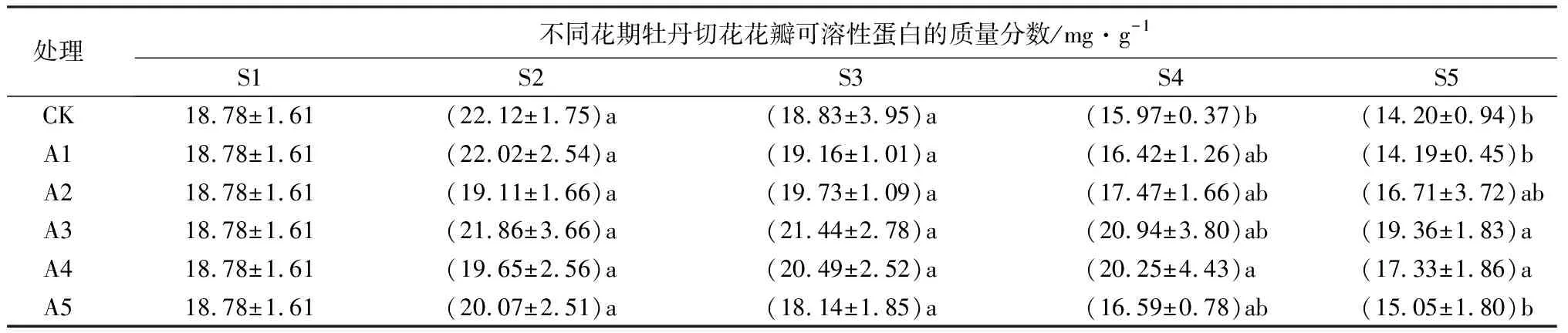
续(表5)
2.6 不同处理对牡丹切花总花青素苷质量分数的影响
由表6可知,对照组和A5处理组的切花在S2~S5时期花青素苷总的质量分数呈持续下降趋势,其他处理组切花均呈先增加后减少的趋势,且大多数处理的花青素苷总量在S3时期达到峰值。与对照组相比,A5处理组的花青素苷分解速率明显放缓,后者含量在各时期都处于较高水平。总体来看,对照组与A1处理之间、其他各处理之间切花的花青素苷总的质量分数差异不显著,在瓶插后两个时期高浓度蔗糖处理组显著高于对照组(P<0.05)。

表6 不同处理下牡丹切花总花青素苷的质量分数
3 结论与讨论
鲜切花瓶插的品质是制约鲜切花产业的关键因素[12]。糖类是重要的鲜切花瓶插液成分之一,目前鲜切花瓶插液中最常见的糖类物质是蔗糖。作为提供植物呼吸作用和其他各种代谢活动的能量物质,蔗糖对切花品质的改善作用随浓度变化而变化,大多数切花瓶插液中蔗糖的质量分数均在1%~5%[13-15]。本实验通过对牡丹切花进行不同浓度的蔗糖溶液瓶插处理,发现蔗糖质量分数为1%、2%、4%的处理均能有效地减缓花径增大和鲜质量的减小速度,从而延长瓶插寿命。蔗糖浓度过高反而缩短切花寿命,低浓度蔗糖溶液可促进花枝吸水,延长小花的瓶插寿命,而浓度过高导致瓶插液水势过大,花枝吸水困难,缩减切花瓶插寿命[16]。本实验蔗糖质量分数为6%的处理与对照组相比,虽然延长了牡丹切花的瓶插寿命,但由于瓶插液水势过高,导致切花吸水困难,花朵进入盛花期迅速蓝变萎蔫;瓶插寿命明显低于蔗糖质量分数为2%、4%的处理;后期花径增大率急剧减小,鲜质量变化率显著低于蔗糖质量分数为2%、4%的处理。
植物在衰老过程中,通常发生膜脂过氧化作用,丙二醛是膜脂过氧化的产物,丙二醛的质量分数越高表示膜脂过氧化作用越强[17]。本研究发现牡丹切花在衰老过程中丙二醛的质量分数持续增加,表明膜系统受到的损伤不断累积,从宏观上表现为切花衰老,与百合、金鱼草等花卉中的研究结果一致[18-19]。蔗糖质量分数为2%、4%的处理切花在进入盛花期时,丙二醛的质量分数显著低于对照组与其他处理,表明两种处理延缓了切花衰老,这是切花瓶插品质较好且盛花期持续时间较长的原因之一。可溶性蛋白的质量分数与细胞衰老关系密切,可溶性蛋白的质量分数下降是植物进入衰老状态的重要指标[5,18]。本实验结果表明,切花花瓣内可溶性蛋白的质量分数与切花衰老程度呈明显的负相关关系,尤其在发育后期,蔗糖质量分数为2%的处理,可溶性蛋白的质量分数显著高于对照组,表明对照组切花随着衰老过程,细胞内含物被大量消耗,蔗糖质量分数为2%的处理使消耗速度减慢,延缓了细胞衰老,显著延长切花瓶插寿命。
糖类物质是花青素苷合成的底物,在拟南芥和萝卜下胚轴培养基中加入糖类物质,明显观察到花青素苷的积累,且蔗糖比葡萄糖的促进作用更明显[20-21]。瓶插液中加入糖类物质可以改善月季、芍药等多种切花的花色[22]。不同浓度的蔗糖和葡萄糖均能促进牡丹切花花青素苷合成通路上相关基因的表达来促进花青素苷的积累,提高花瓣彩度[23-24]。本实验发现与对照组相比,不同浓度蔗糖处理的切花花瓣花青素苷的质量分数和彩度值均有所增加,其中以蔗糖质量分数为6%处理最为明显。
糖在促进呈色的作用中不仅作为反应底物,花青素苷的积累主要与糖信号转导调控有关[25-26]。近来研究表明蔗糖可能通过促分裂原活化蛋白酶(MAPK)级联途径调控花青素苷合成[27],糖信号在调控植物生长发育的过程中并不是单独发挥作用,而是与多个信号系统共同操纵[28-31]。表明植物体内糖信号可能与其他激素信号之间形成复杂的互作网络,共同调控花青素苷的合成,这为研究糖信号调控花色的途径与方式提供了新的思路。
