固定化短乳杆菌催化合成γ-氨基丁酸的研究
2022-06-23孙丽慧贺雷雨陈业文宫宇晴
孙丽慧,贺雷雨,陈业文,宫宇晴
(1.大连理工大学 海洋科学与技术学院,辽宁 盘锦 124221;2.大连理工大学 生命科学与药学学院,辽宁 盘锦 124221)
γ-氨基丁酸(γ-aminobutyric acid,GABA),又称4-氨基丁酸、氨酪酸、哌啶酸[1],是一种广泛分布于动物、植物、微生物体内的非蛋白质氨基酸[2]。它作为重要的抑制神经信息传递的物质[3],能够参与人体内多种代谢过程,具有较高的生理活性[4],如降血压[5]、抗氧化[6]、调节免疫力[7]等。
GABA的合成方法主要包括化学合成法、植物富集法和微生物合成法[8]。近年来微生物法生产GABA已成为国内外的研究热点。其原理是利用某些微生物细胞中天然含有的谷氨酸脱羧酶为催化剂,将底物L-谷氨酸或L-谷氨酸钠催化为GABA[9]。目前为止已在多种常见微生物体内发现谷氨酸脱羧酶的存在[10],相对于化学合成法和植物富集法,微生物合成法具有污染小、成本低、转化率高、反应条件温和等优点[11-12],具有良好的工业化应用前景。特别是利用细胞催化将L-谷氨酸或L-谷氨酸钠转化生成GABA,具有反应体系成分较简单、反应时间短、分离纯化操作简单以及对环境污染小等优势[13-14]。本课题组前期从榨菜中筛选出一株具有较强催化合成GABA能力的短乳杆菌DLF-19076,但游离细胞催化通常只能使用一次,存在转化液容易乳化、下游分离较困难等问题[15],而固定化细胞具有易回收、可重复使用等优点[16]。因此本文以实验室前期筛选保藏的短乳杆菌DLF-19076细胞为研究对象,利用海藻酸钠为载体对固定化条件、固定化细胞的酶学性质及操作稳定性进行研究,以期为生物合成GABA奠定一定的理论基础。
1 材料与方法
1.1 材料与试剂
短乳杆菌DLF-19076:由大连理工大学海洋科学与技术学院食品生物技术实验室筛选并保藏[17];γ-氨基丁酸、5-磷酸吡哆醛(pyridoxal-5'-phosphate,PLP)(均为分析纯):生工生物工程(上海)股份有限公司;海藻酸钠、L-谷氨酸钠(均为分析纯):中国医药集团化学试剂有限公司;甲醇(色谱纯):默克股份有限公司;磷酸盐缓冲液(pH 7.2):上海博升生物科技有限公司;其他试剂均为国产分析纯。
MRS培养基:葡萄糖20 g/L、蛋白胨10 g/L、牛肉膏10 g/L、酵母提取物5 g/L、无水乙酸钠5 g/L、柠檬酸二铵 2 g/L、K2HPO42.0 g/L、MnSO4·4H2O 0.25 g/L、MgSO4·7H2O 0.58 g/L、吐温-80 1mL/L,使用 1 mol/L HCl调节pH值至6.2~6.4,121℃高压灭菌15 min。
1.2 仪器与设备
TGL-20M台式高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;1260 InfinityⅡ高效液相色谱仪:美国安捷伦科技公司;ZWY-1102C恒温培养振荡器:上海智城分析仪器制造有限公司。
1.3 试验方法
1.3.1 细胞培养
将实验室保存的菌体活化后接入MRS培养基(100 mL/250 mL)中,35℃培养24 h,培养液离心10 min后(4℃、10 000 r/min),将收集的菌体用0.2 mol/L磷酸盐缓冲液(pH7.2)洗涤3次,4℃冷藏备用。
1.3.2 海藻酸钠包埋法固定化短乳杆菌细胞
1.3.2.1 海藻酸钠浓度对固定化效果的影响
将5.0 mL细胞悬液分别与15.0 mL浓度为1.0%、2.0%、3.0%、4.0%和5.0%的海藻酸钠溶液混合,用12号针头注射器将混合液以60滴/min的速度滴入150 mL浓度为3.0%的氯化钙溶液中,4℃条件下硬化4 h,考察海藻酸钠浓度对固定化效果的影响。
1.3.2.2 CaCl2浓度对固定化效果的影响
将5.0 mL细胞悬液与15.0 mL浓度为3.0%的海藻酸钠溶液混合,用12号针头注射器将混合液以60滴/min的速度分别滴入150 mL浓度为1.0%、2.0%、3.0%、4.0%和5.0%的氯化钙溶液中,4℃条件下硬化4 h,考察CaCl2浓度对固定化效果的影响。
1.3.2.3 固定化细胞平均粒径对固定化效果的影响
将5.0 mL细胞悬液与15.0 mL浓度为3.0%的海藻酸钠溶液混合,分别采用3、5、12、16号针头将混合液滴入到150 mL浓度为3.0%的氯化钙溶液中,4℃条件下硬化4 h,制备出平均粒径为1.3、2.2、3.2、4.8 mm的固定化小球,考察小球粒径对固定化效果的影响。
1.3.2.4 硬化时间对固定化效果的影响
将5.0 mL细胞悬液与15.0 mL浓度为3.0%的海藻酸钠溶液混合,采用12号针头将混合液滴入到150 mL浓度为3.0%的氯化钙溶液中,4℃条件下分别硬化2、4、6 h和8 h,考察硬化时间对固定化效果的影响。
1.3.2.5 固定化细胞条件的优化
在单因素试验基础上进行正交试验,进一步优化细胞固定化条件。正交试验因素水平设计如表1所示。
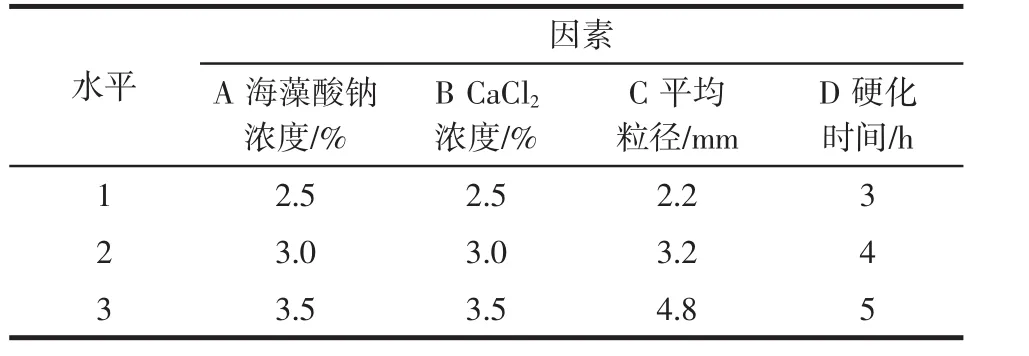
表1 正交试验因素水平Table 1 Factors and levels in orthogonal experiment
1.3.3 谷氨酸脱酸酶活力的测定
酶活力单位:在35℃、pH4.5条件下,1 min内催化L-谷氨酸钠产生1 μmol GABA所需要的谷氨酸脱酸酶量为1个酶活力单位(U)。
酶活力测定:反应体系为0.2 mol/L的柠檬酸-Na2HPO4缓冲溶液(pH4.5),含有 0.15 mmol/L PLP 和30 g/L L-谷氨酸钠,加入适量菌体细胞或固定化小球,35℃水浴中反应5 min,10 000 r/min离心2 min分离细胞,采用高效液相色谱法测定GABA的含量[18]。
相对酶活力(%):以同组最高酶活力为参照,定义其相对酶活力为100%,酶活力与同组最高酶活力的比值即为相对酶活力,以百分数形式表示。
比酶活力(U/g):35℃、pH4.5条件下1.0 g湿菌体所具有的酶活力单位数。
1.3.4 固定化细胞机械稳定性的测定
随机选取100粒固定化小球,放入100mL含20mL柠檬酸-Na2HPO4缓冲液(0.2 mol/L、pH4.5)锥形瓶中,加入50粒直径6 mm的玻璃珠,35℃、200 r/min下振荡6 h。完好的小球的数量占原小球总数的比率即为机械稳定度。
1.4 数据处理
所有试验至少重复3次,试验结果以平均值±标准方差的形式表示,并运用方差分析进行差异性分析。
2 结果与讨论
2.1 细胞固定化条件的优化
2.1.1 海藻酸钠浓度对固定化效果的影响
海藻酸钠浓度对固定化效果的影响见图1。

图1 海藻酸钠浓度对固定化效果的影响Fig.1 Effect of sodium alginate concentration on the immobilization
海藻酸钠浓度对固定化细胞的相对酶活力和机械稳定度均有较大的影响。海藻酸钠浓度过低,制备出的固定化小球质地绵软,机械稳定度差。同时,由于球壁网状结构的稀疏,搅拌硬化过程易导致菌体泄露,菌体利用率下降。海藻酸钠浓度过高,制备出的小球结构致密,传质效果不佳,造成底物缺乏和产物抑制[19]。由图1可知,随着海藻酸钠浓度的升高,固定化细胞的相对酶活力先升高后降低,机械稳定度则逐渐升高。当海藻酸钠浓度为2.0%时,相对酶活力最高,但此时机械稳定度为0.83。当海藻酸钠浓度升高至3.0%,相对酶活力略有降低,为98.34%,但机械稳定度可提高至0.92。综合考虑,选择海藻酸钠的最适浓度为3.0%。
2.1.2 CaCl2浓度对固定化效果的影响
CaCl2浓度对固定化效果的影响见图2。
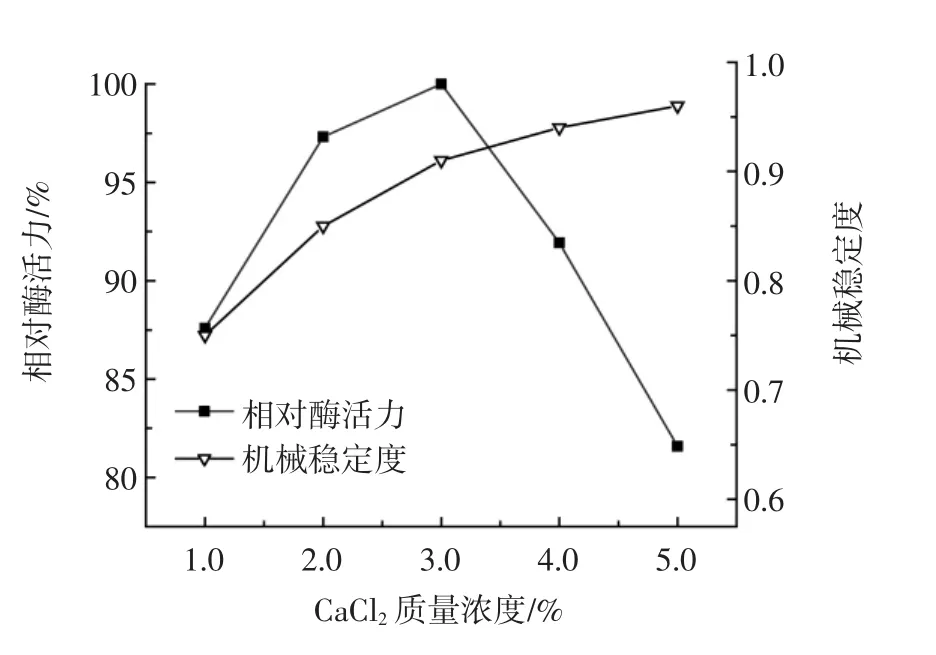
图2 CaCl2浓度对固定化效果的影响Fig.2 Effect of calcium chloride concentration on the immobilization
CaCl2是固定化过程中的一个重要因素。Ca2+通过和海藻酸根离子反应生成不溶于水的海藻酸钙网状结构[20],从而将细菌包埋其中。当CaCl2浓度过低时,两离子的反应程度低,凝胶交联度差,制备过程中菌体流失严重;当CaCl2浓度过高时,固定化细胞致密性高、通透性差,不利于物质交换,不利于酶活力的发挥。由图2可知,当CaCl2浓度为3.0%时,相对酶活力最高。综合考虑,选择CaCl2的最适浓度为3.0%。
2.1.3 固定化细胞平均粒径对固定化效果的影响
平均粒径对固定化效果的影响见图3。
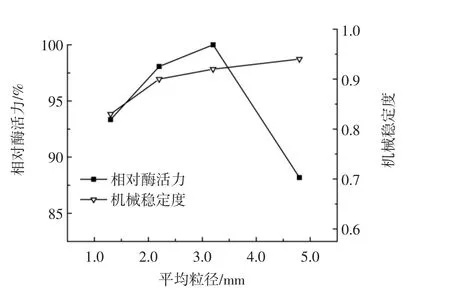
图3 平均粒径对固定化效果的影响Fig.3 Effect of average particle size on the immobilization
由图3可知,平均粒径小于3.2 mm时,相对酶活力随着平均粒径的增大而提高,可能是由于固定化细胞的平均粒径越小,机械稳定度越低,制备过程造成的菌体流失越严重,因此适当增加粒径大小可提高相对酶活力;当平均粒径大于3.2 mm时,随着粒径的增大,相对酶活力反而降低,这可能是由于颗粒越大,球状体的比表面积越小,固定化细胞与外界进行物质交换的总面积越小,且粒径越大的固定化细胞在催化体系内的流动性越低,因而催化效率越差。因此,选择3.2 mm为固定化细胞制备的最适粒径。
2.1.4 硬化时间对固定化效果的影响
硬化时间对固定化效果的影响见图4。
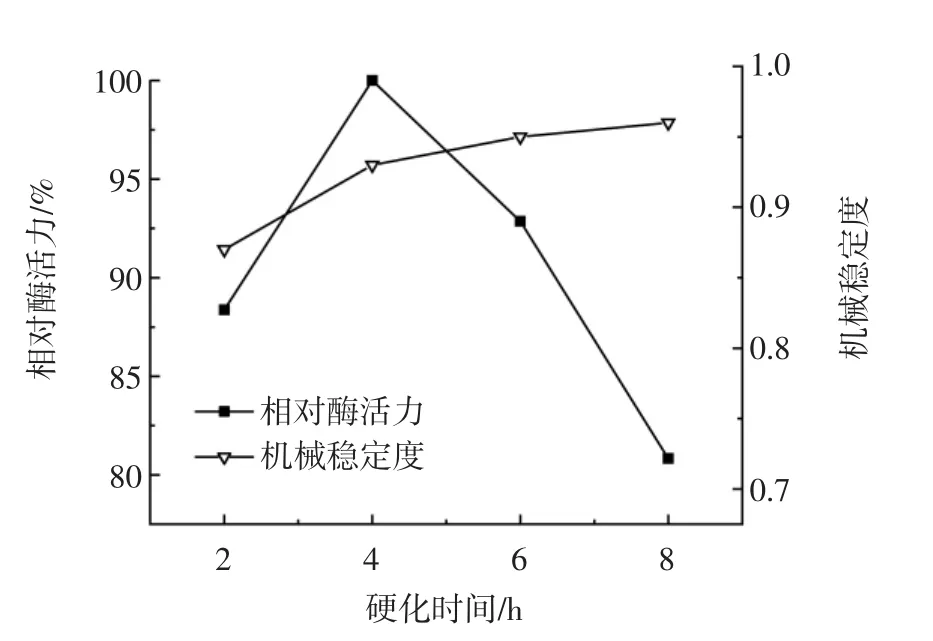
图4 硬化时间对固定化效果的影响Fig.4 Effect of solidifying time on immobilization
由图4可知,当硬化时间为4 h时,相对酶活力最高。这可能是由于较短的硬化时间导致海藻酸钠与CaCl2交联程度不够,导致机械稳定度不高,固定化细胞在收集冲洗过程中造成了菌体的流失;而较长的硬化时间导致海藻酸钠与CaCl2的交联程度过高,形成了致密的空间网状结构,增加了底物扩散的阻力。因此,选择硬化的最佳时间为4 h。
2.1.5 固定化细胞条件的优化
以比酶活力为考察指标,通过正交试验进一步优化细胞固定化条件,正交试验结果分析见表2。

表2 正交试验结果Table 2 Results of orthogonal experiment
由表2可知,对固定化细胞比酶活力影响最大的因素是海藻酸钠浓度,其次是硬化时间、平均粒径、CaCl2浓度,最佳固定化条件为海藻酸钠浓度2.5%、CaCl2浓度3.0%、平均粒径3.2 mm、硬化时间4 h。与正交试验结果一致。
2.2 固定化细胞的酶学性质和操作稳定性
2.2.1 固定化细胞的最适反应pH值
在pH值为3.0~7.0的柠檬酸-Na2HPO4缓冲体系中测定固定化细胞和游离细胞的酶活力,结果见图5。
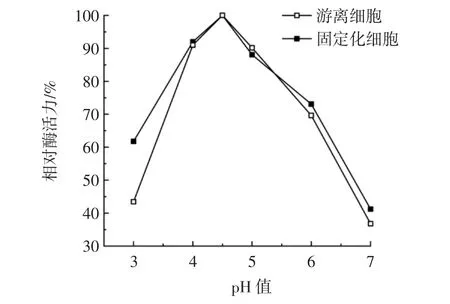
图5 pH值对固定化细胞和游离细胞酶活力的影响Fig.5 Effect of pH on enzyme activity of immobilized cells and free cells
如图5所示,细胞固定化后最适反应pH值没有变化,依然为4.5。
2.2.2 固定化细胞的最适反应温度
在25℃~40℃测定固定化细胞和游离细胞的酶活力,结果见图6。
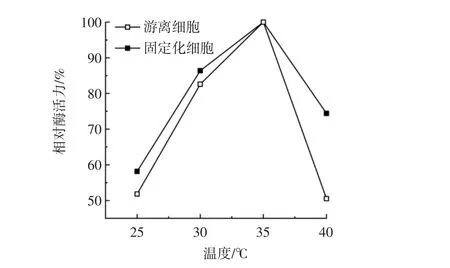
图6 温度对固定化细胞和游离细胞酶活力的影响Fig.6 Effect of temperature on enzyme activity of immobilized cells and free cells
如图6所示,细胞固定化后最适反应温度没有变化,依然为35℃。
2.2.3 固定化细胞的操作稳定性
固定化细胞循环利用结果如图7所示。

图7 固定化细胞的操作稳定性Fig.7 The operation stability of immobilized cells
从图7可以看出,固定化细胞的相对酶活力下降趋势较为缓慢。固定化细胞在重复利用第2次时,相对酶活力为初始值的91.4%,继续重复利用至第7次后仍保持53.2%的相对酶活力,显示出良好的操作稳定性。
3 结论
本研究以海藻酸钠为载体,采用包埋法对短乳杆菌细胞进行了固定化,确定最优固定化条件为海藻酸钠浓度2.5%、CaCl2浓度3.0%、小球平均粒径3.2 mm、硬化时间4 h。该固定化细胞最适pH值为4.5,最适温度为35℃,与游离细胞相比均未改变,且表现出较好的操作稳定性,重复利用至第7次后仍保持53.2%的相对酶活力。
