沙格列汀激活AMPK-PPARα途径促进巨噬细胞向M2型极化减轻动脉粥样硬化的作用研究
2022-06-23刘继军于林君王连友刘会丽
刘继军,于林君,王 博,王连友*,刘会丽
0 引言
动脉粥样硬化(Atherosclerosis,AS)是一种复杂的进行性慢性炎症疾病,是多种急性心脑血管疾病的主要诱因[1]。AS斑块的形成使得血管管腔狭窄,此外,斑块自身的易损性和易破性是导致缺血性脑卒中发生的关键原因[2],但是目前其潜在的致病机制尚不明确。巨噬细胞极化在AS进展中具有至关重要的作用,其不同于单核细胞的免疫细胞,在AS的所有阶段均有发现,并与炎性介质的产生有关[3]。为了响应环境刺激,巨噬细胞可被激活为涉及不同功能特征的几种亚型,包括具有促炎性M1型和抗炎性M2型的2种表型细胞。例如,M1型巨噬细胞能够产生诱导型一氧化氮合酶(iNOS),促进炎症反应,导致斑块发生易感性;而M2型巨噬细胞能够分泌精氨酸酶1(Arg-1)来增强粥样硬化斑块稳定性。M1型和M2型巨噬细胞之间的相对比率是AS中的关键事件[4-5]。因此,调控巨噬细胞的极化是防治AS的潜在策略。沙格列汀是一种二肽基肽酶4抑制剂,由于其具有升高肠降血糖素激素-胰高血糖素样肽1(GLP-1)而降低血糖的能力,被临床用于2型糖尿病的治疗。此外,沙格列汀还具有抗炎、抗氧化和免疫调节的作用[6]。本研究以巨噬细胞极化作为切入点,进一步探讨沙格列汀对AS的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 将8周龄的健康、清洁级ApoE-/-小鼠和野生型C57BL/6小鼠饲养在温度为(23±2)℃、12 h/12 h的光照/黑暗周期的无菌饲养箱中,自由饮水、摄食。
1.1.2 主要材料与试剂 小鼠巨噬细胞RAW264.7(中国科学院上海生命科学研究所),沙格列汀(英国AstrZeneca公司),AMPK抑制剂Compound C(美国 MCE 公司),DMEM 培养基、青霉素-链霉素、胰蛋白酶、胎牛血清(美国 GIBCO公司),TC、TG、LDL-C和HDL-C试剂盒(四川迈克生物公司),HE染色试剂、免疫组织化学染色试剂、油红O染色液、ECL发光液以及BCA蛋白检测试剂盒(上海碧云天生物研究所),TRIzol试剂(美国 Invitrogen公司),SYBR®Premix Ex TaqTMII试剂盒(日本Takara),免疫荧光染色试剂盒(南京建成生物工程研究所),抗体iNOS、Arg-1、AMPK、p-AMPK、PPARα、CD206(英国Abcam公司),抗体GAPDH和辣根过氧化物酶标记的羊抗兔(美国CST公司),其他试剂均为国产分析纯。
1.2 动脉粥样硬化动物模型建立与给药处理 将30只 ApoE-/-小鼠按照数字表法随机分为2组,包括模型组和沙格列汀组,每组15只,均给予高脂饲料喂养;以15只野生型C57BL/6小鼠作为对照组,给予普通饲料喂养。喂养8周后,沙格列汀组予以15 mg/(kg·d)的沙格列汀灌胃,模型组和对照组小鼠同时给予等量生理盐水灌胃。12 周后,各组小鼠通过腹腔注射50 mg/kg戊巴比妥钠麻醉后,心脏穿刺收集血液,分离小鼠腹主动脉至主动脉,一部分固定于4%多聚甲醛,另一部分置于液氮迅速冷冻后保存于-80 ℃超低温冰箱中。
1.3 血脂水平检测 治疗12周后,小鼠禁食12 h,采用腹腔注射50 mg/kg 戊巴比妥钠麻醉,通过心脏穿刺取血,离心后收集血清,利用全自动生化分析仪分析TC、TG、LDL-C和HDL-C的水平,操作步骤严格按照试剂盒说明进行。
1.4 组织处理染色
1.4.1 HE染色 将小鼠主动脉组织在4%多聚甲醛中固定后,取出进行修剪、包埋,利用梯度乙醇脱水和二甲苯透明后,切成厚度为 5 μm的石蜡切片,经过脱蜡、复水后,进行HE染色,并使用中性树胶进行封片,于光学显微镜下观察主动脉组织形态学变化并采集图像。
1.4.2 油红O染色 通过4%甲醛溶液固定好主动脉组织后,使用PBS缓冲液冲洗组织,将整个主动脉血管内壁切开,放入新鲜配置的0.05%油红O工作溶液中,室温下避光染色1 h后,弃去染液,PBS缓冲液冲洗主动脉,使用75%乙醇浸泡,直至斑块呈现红色,PBS缓冲液再次冲洗,然后将主动脉固定于黑色蜡皿上,采用立式显微镜观察并采集图像,通过Image J 软件测量动脉斑块面积。
1.4.3 免疫组织化学染色 取制备好的主动脉石蜡切片,通过免疫组织化学方法评估iNOS和Arg-1蛋白的表达。将切片分别用梯度乙醇和二甲苯进行脱蜡水化,置于柠檬酸盐缓冲液中煮沸15 min(温度保持在95 ℃左右)以进行抗原修复。用3%H2O2去除组织内源性过氧化物酶,接着用5%山羊血清进行封闭。将切片分别与兔抗iNOS(1∶500)和抗Arg-1(1∶100)在4 ℃下孵育过夜。次日,PBS缓冲液冲洗,与辣根过氧化物酶标记的山羊抗兔(1∶1 000)在室温下孵育1 h,PBS 缓冲液冲洗后,加入DAB显色液,苏木精复染,使用中性树胶进行封片,于光学显微镜下观察组织中的阳性表达情况,胞质染成黄色至棕色即为阳性细胞,随机选择5个高倍视野(400×)计数,计算阳性细胞数所占总细胞数的百分比,即阳性表达率。
1.5 Western blot 在各组小鼠主动脉组织中加入RIPA裂解液进行裂解,离心并收集上清液,根据BCA蛋白检测试剂盒检测各组样品蛋白的浓度。通过10%SDS-PAGE电泳分离各组蛋白,并转移到PVDF膜上。TBST缓冲液洗膜后,采用5%脱脂牛奶在室温下封闭1 h,然后加入抗iNOS(1∶1 000)、Arg-1(1∶1 000)、AMPK(1∶1 000)、p-AMPK(1∶1 000)、PPARα(1∶1 000)为第一抗体,放置在4 ℃下孵育过夜。次日,TBST缓冲液清洗,然后加入对应二抗,在室温下孵育2 h。TBST缓冲液再次洗膜,采用ECL发光液曝光,通过Image J 软件分析各条带灰度值,以GAPDH为内参,计算各蛋白表达水平。
1.6 巨噬细胞培养、分组与处理 取小鼠巨噬细胞RAW264.7,采用DMEM培养基(含10%胎牛血清与1%青霉素-链霉素)培养,置于37 ℃、5%CO2培养箱中,根据细胞生长状态传代,采用对数生长期的细胞进行实验。调整RAW264.7细胞密度为1×106个/ml,取100 μl接种于6孔板,培养至细胞贴壁后,用LPS(1 μg/ml)和IFN-γ(20 ng/ml)分别诱导24 h。实验分组:①对照组:细胞常规培养;②诱导组:细胞按照上述方法进行诱导处理;③沙格列汀组:细胞诱导后,使用含1 μmol/L沙格列汀的培养液培养24 h;④AMPK抑制剂组:10 μmol/L AMPK抑制剂Compound C预处理细胞2 h,再进行诱导和沙格列汀处理。
1.7 实时荧光定量PCR 使用TRIzol试剂提取各处理组RAW264.7细胞总RNA,采用紫外分光光度计检测提取的RNA浓度与纯度。按照反转录试剂盒说明书进行反转录操作,以获得cDNA。以cDNA为模板进行实时荧光定量PCR 实验,检测各基因表达水平,步骤严格按照SYBR®Premix Ex TaqTMII试剂盒说明进行,以GAPDH 作为内参基因。扩增条件为:95 ℃ 3 min,1个循环;95 ℃ 30 s、60 ℃ 30 s、58 ℃ 30 s,40个循环。通过2-ΔΔCt法分析计算各基因mRNA相对表达量。使用的引物由上海生工生物有限公司合成,具体序列见表1。

表1 各基因引物序列
1.8 免疫荧光染色 将各处理RAW264.7细胞以1×104个/孔的密度接种于24孔板内的无菌玻片上,用4%多聚甲醛固定后,PBS缓冲液洗涤,使用0.3% TritonX-100试剂进行透膜处理,室温下孵育15 min,并用10%山羊血清室温封闭2 h。加入特异性一抗兔抗iNOS(巨噬细胞的M1标记)和小鼠抗CD206(巨噬细胞M2标记)进行标记,置于4 ℃下孵育过夜。第2天,PBS缓冲液洗涤后,加入对应的荧光二抗,暗室室温下孵育1 h,PBS缓冲液再次洗涤,加入DAPI染色10 min,使用中性树胶封片,在荧光显微镜下观察阳性表达并采集图像。

2 结果
2.1 各组小鼠血脂水平比较 与对照组比较,模型组小鼠血清中TG、TC、 LDL-C水平升高(P<0.05),血清中HDL-C水平降低(P<0.05);与模型组比较,沙格列汀组小鼠血清中TG、TC、LDL-C水平降低(P<0.05),而HDL-C水平升高(P<0.05),见图1。
2.2 各组小鼠主动脉组织形态学变化 HE染色结果显示,对照组小鼠的主动脉内膜完好无损,没有出现明显增生或管腔狭窄的现象。模型组小鼠主动脉内膜明显增厚,形成斑块,且面积较大;沙格列汀组小鼠主动脉内膜增生较模型组明显改善,斑块面积减少,管腔狭窄程度降低,见图2。
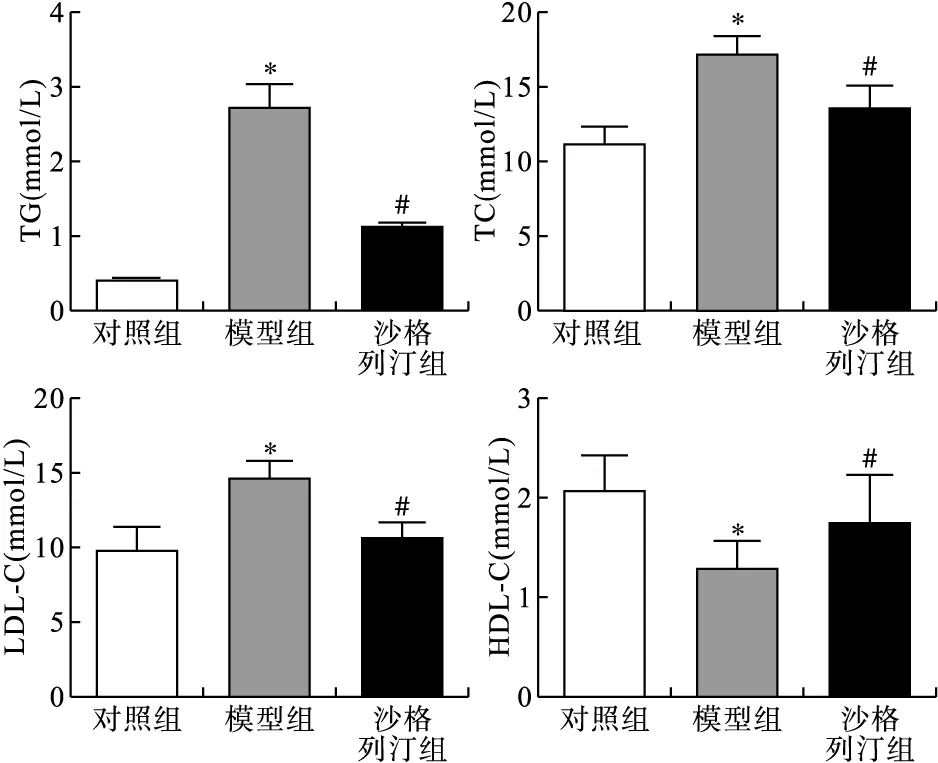
图1 各组小鼠血脂水平变化
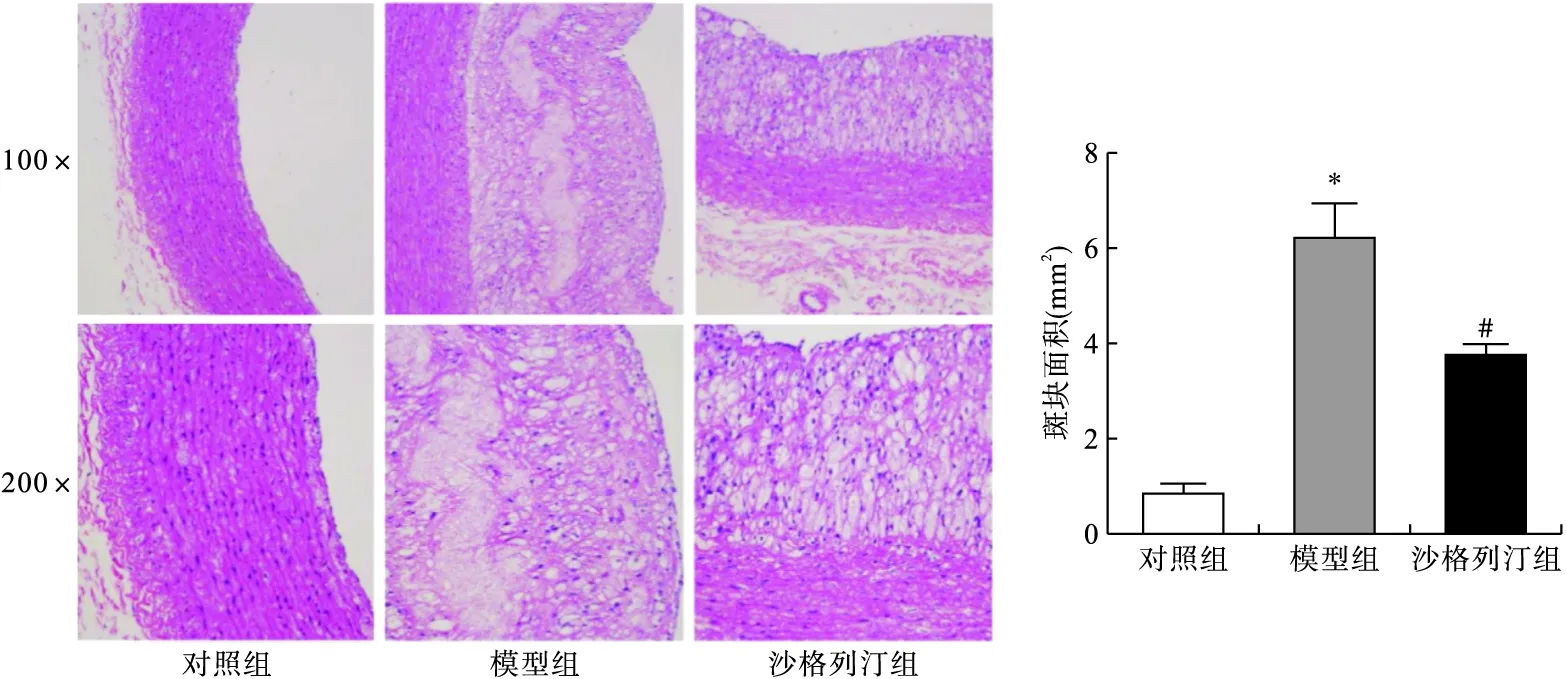
图2 HE染色检测各组小鼠主动脉组织形态学变化
2.3 各组小鼠主动脉斑块面积变化 油红O染色结果显示,对照组小鼠脂质积聚少,相对斑块面积较小;模型组小鼠脂质积聚较多,相对斑块面积较对照组显著增加(P<0.05);沙格列汀组小鼠脂质蓄积较模型组明显减少,相对斑块面积也显著减小(P<0.05),见图3。
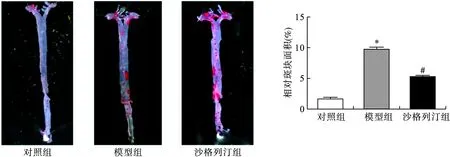
图3 油红O染色观察各组小鼠主动脉面积变化
2.4 各组小鼠主动脉iNOS和Arg-1表达比较 免疫组织化学染色结果显示,与对照组比较,模型组小鼠主动脉中iNOS阳性表达率增加(P<0.05),Arg-1阳性表达率减少(P<0.05);与模型组比较,沙格列汀组小鼠主动脉中iNOS阳性表达率减少(P<0.05),而Arg-1阳性表达增加(P<0.05),见图4。

图4 免疫组织化学染色检测各组小鼠主动脉iNOS和Arg-1表达
2.5 各组小鼠主动脉iNOS、Arg-1、AMPK-PPARα途径蛋白表达比较 Western blot实验结果显示,与对照组比较,模型组小鼠主动脉中iNOS蛋白水平上调(P<0.05),Arg-1、p-AMPK及PPARα蛋白水平下调(P<0.05);与模型组比较,沙格列汀组中iNOS蛋白水平下调(P<0.05),Arg-1、p-AMPK及PPARα蛋白水平下调(P<0.05),见图5。
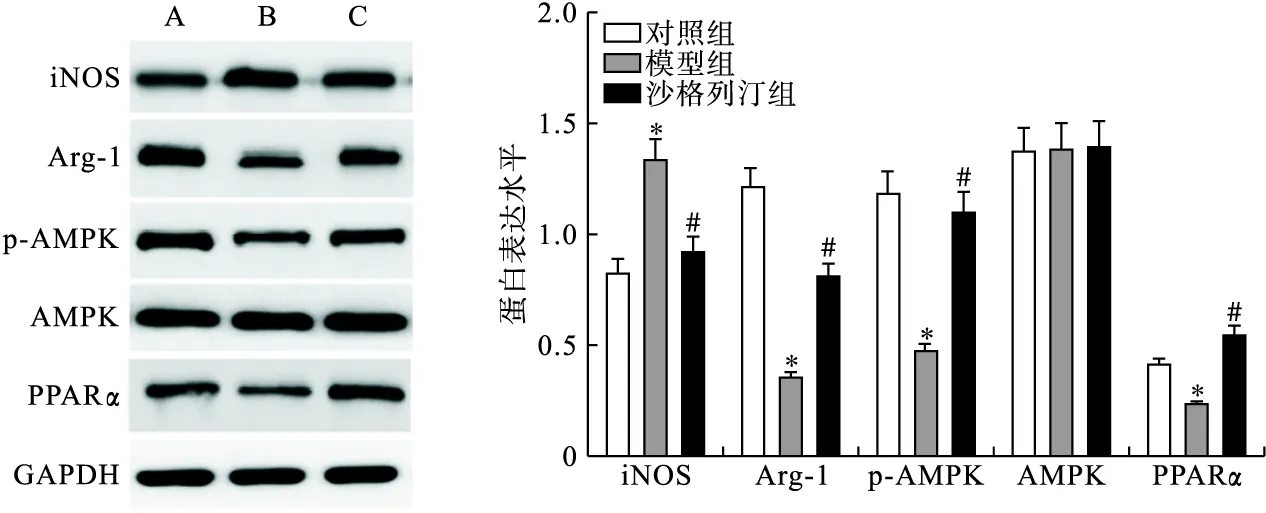
图5 Western blot检测各组小鼠主动脉iNOS、Arg-1及AMPK-PPARα途径相关蛋白表达
2.6 各组RAW264.7巨噬细胞PPAR-α、TNF-α、IL-6、TGF-β、Arg-1 mRNA表达水平比较 实时荧光定量PCR检测结果显示,与对照组比较,诱导组RAW264.7细胞中PPAR-α、TGF-β、Arg-1 mRNA表达水平下调(P<0.05),TNF-α、IL-6 mRNA表达水平显著上调(P<0.05);与诱导组比较,沙格列汀组中PPAR-α、TGF-β、Arg-1 mRNA表达水平上调(P<0.05),TNF-α、IL-6 mRNA表达水平下调(P<0.05);而AMPK抑制剂组中PPAR-α、TGF-β、Arg-1 mRNA表达水平较沙格列汀组下调,TNF-α、IL-6 mRNA表达水平上调(P<0.05),见表2。
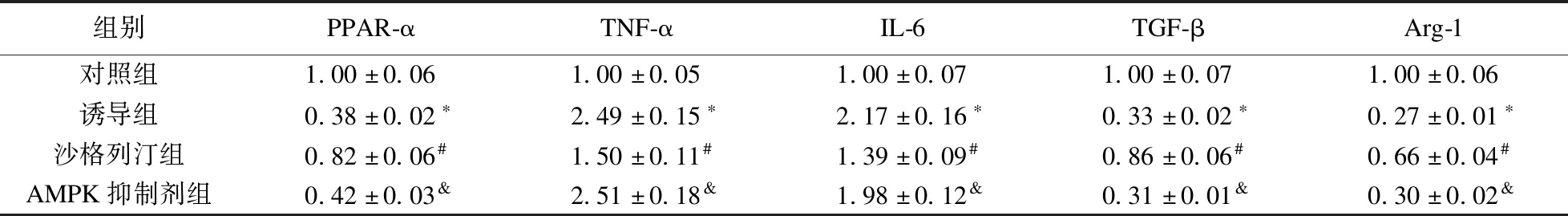
表2 各组巨噬细胞PPAR-α、TNF-α、IL-6、TGF-β、Arg-1 mRNA表达水平比较
2.7 各组巨噬细胞M1型标志物iNOS与M2型标志物CD206荧光染色比较 免疫荧光染色结果显示,与对照组比较,诱导组RAW264.7细胞中M1型标志物iNOS阳性比例升高(P<0.05),M2型标志物CD206阳性比例下降(P<0.05);与诱导组比较,沙格列汀组细胞中iNOS阳性比例下降,CD206阳性比例升高(P<0.05)。经过AMPK抑制剂预处理后,与沙格列汀组比较,细胞中iNOS阳性比例升高(P<0.05),CD206阳性比例下降(P<0.05),见图6。
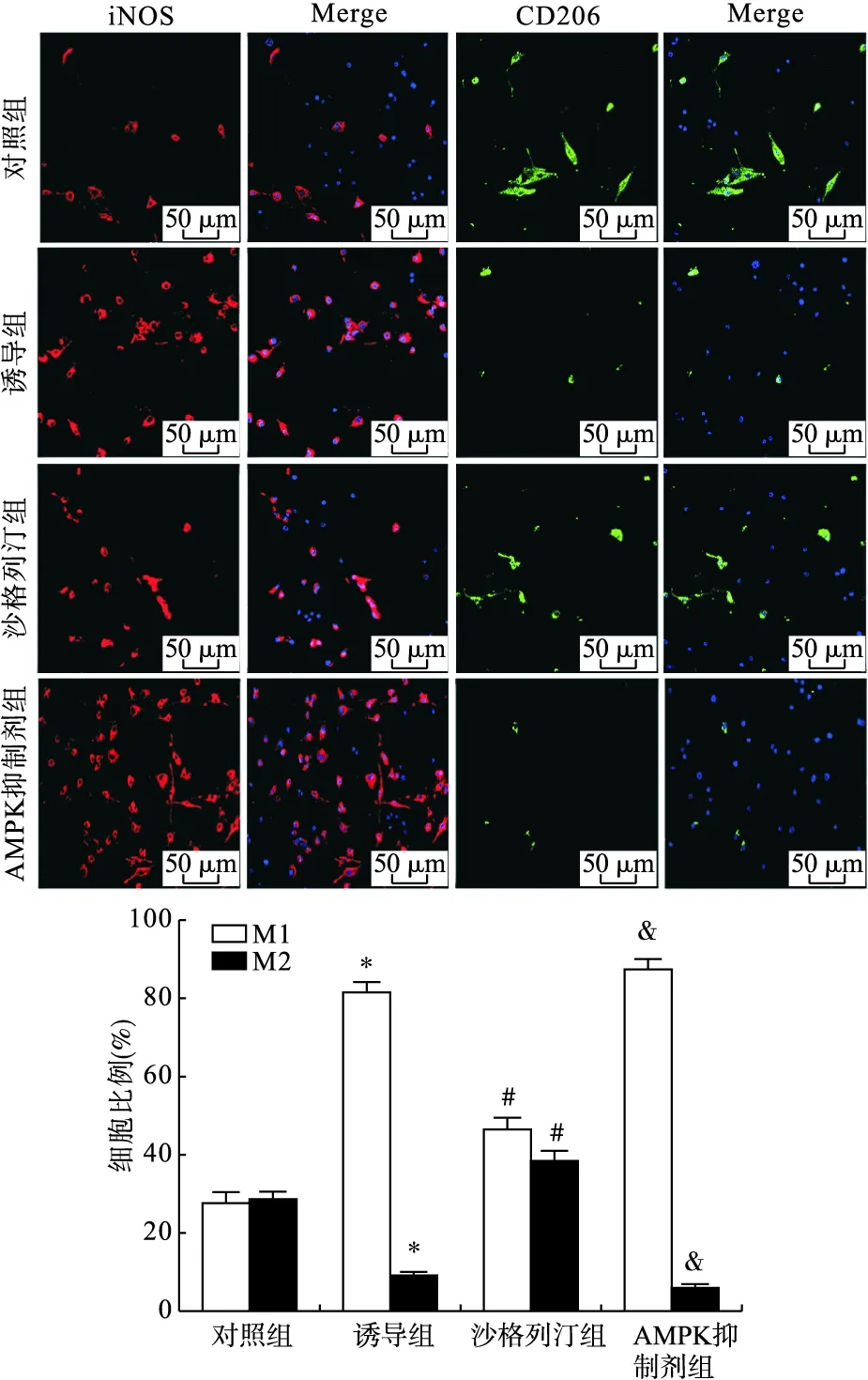
图6 免疫荧光染色检测各组巨噬细胞iNOS与CD206表达(100×)
3 讨论
AS是导致心血管疾病发展的重要病理过程,可引起缺血性心脏病、中风以及周围血管疾病等。AS作为大中型动脉的慢性炎症性病变,也是全世界常见的死亡原因之一,给社会造成了巨大的经济负担。AS特征是免疫细胞浸润形成,该免疫细胞浸润由载脂的巨噬细胞泡沫细胞和T细胞主导,并引起脂质滞留和动脉壁中低密度脂蛋白的氧化修饰[3]。此外,高血压、糖尿病、高脂血症和吸烟等多种因素会促进AS发展[7]。AS是一个长期综合性过程,病理机制尚未完全明确,探究新的有效药物及相关分子蛋白机制,为AS的治疗提供新的细胞与分子靶点。
作为一种高效、可逆的选择性DPP-4抑制剂,沙格列汀能够通过升高胰高血糖素样肽1来降低血糖,目前已应用于2型糖尿病的治疗中[6]。除降低血糖水平外,沙格列汀还可以通过改善胰岛素抵抗代谢紊乱来有效改善脂质代谢和肝功能。此外,多项研究表明,沙格列汀在多种疾病中具有重要的抗炎能力。Birnbaum等[8]研究表明,沙格列汀可通过抑制NLRP3炎性体的形成和促炎细胞因子TNF-α、IL-1β、IL-6和IL-18的产生来预防糖尿病性肾病。Brown等[9]研究显示,沙格列汀能够诱导表达CD11c的白细胞和CD8+淋巴细胞的独特转变,从而减轻了AngⅡ诱导的心脏舒张功能障碍、纤维化以及炎症反应。Connelly等[10]通过心肌梗死动物模型研究发现,沙格列汀可显著降低手术后的死亡率并恢复心脏功能。上述研究表明,沙格列汀可能在心血管疾病中发挥有益作用。本研究显示,给予AS小鼠沙格列汀治疗后,小鼠血脂水平改善,主动脉斑块减少,管腔狭窄程度减小,表明沙格列汀对AS具有一定的改善作用。
巨噬细胞在AS的发生以及动脉斑块的生长和破裂中起着核心作用,能够通过分泌促炎性细胞因子和趋化因子以及产生活性氧来帮助维持局部炎症反应。此外,巨噬细胞与主动脉血管平滑肌细胞之间的串扰,通过产生其他促炎性细胞因子和细胞外基质成分扩大炎性循环,从而进一步促进脂蛋白保留[11]。巨噬细胞在斑块中迁移能力降低,防止炎症消退并促进一系列复杂反应,导致斑块的破裂。在持续的炎症反应驱动下,巨噬细胞发生凋亡,并导致在没有有效胞吐作用的情况下,细胞碎片和凋亡细胞不断积累,从而促进AS斑块中坏死核心的形成[12]。巨噬细胞分为经典激活(M1)和交替激活(M2)表型。M1型巨噬细胞响应干扰素、toll样受体配体、病原体相关分子复合物和脂蛋白而极化,可分泌促炎因子,例如IL-1β、IL-6和TNF-α。M2型巨噬细胞由细胞因子IL-4和IL-13诱导所激活,并分泌抗炎因子,如:IL-1受体激动剂、IL-10和TGF-β[4-5]。研究表明,在AS病变中,M1型巨噬细胞位于容易破裂和不稳定的区域,促进AS和不稳定斑块的发展,而M2型巨噬细胞位于更稳定的区域,促进组织修复、斑块稳定性和斑块消退[13]。本研究结果显示,经过沙格列汀治疗的AS小鼠主动脉中,M1型巨噬细胞标志物iNOS表达减少,M2型巨噬细胞标志物Arg-1表达增加,由此推测,沙格列汀可能诱导了AS中巨噬细胞向M2型极化,从而发挥减轻AS的作用。
本研究显示,AS小鼠主动脉中p-AMPK、PPARα蛋白水平均下调,而经过沙格列汀治疗后两者表达均上调。活化后的AMPK可通过影响脂质代谢相关基因和蛋白质(如PPARα)的表达,抑制脂肪酸、胆固醇、三酰甘油的合成,并促进脂肪酸摄取和β-氧化[14]。PPARα激活后,调控多个参与脂肪酸的摄取、氧化以及脂质代谢过程中的基因表达。已有研究表明,激活PPARα信号通路在心血管系统中发挥关键的抗AS作用[15-16]。本研究通过体外实验抑制AMPK信号通路的激活,观察巨噬细胞极化情况,结果显示,在AMPK抑制剂Compound C预处理的巨噬细胞中,PPAR-α、TGF-β、Arg-1表达下调,TNF-α、IL-6表达上调,同时,M1型巨噬细胞标志物iNOS表达增加,而M2型巨噬细胞标志物CD206表达减少。表明沙格列汀给药后可能激活了AMPK-PPARα途径,从而调控巨噬细胞向M2型极化,以发挥改善AS的作用。
综上所述,沙格列汀能够激活AMPK-PPARα途径,促进巨噬细胞向M2型极化,以减轻AS斑块的进展。本研究为进一步探究沙格列汀调节巨噬细胞极化在AS中的作用奠定了实验基础,为AS的治疗提供了新思路。
