结肠癌细胞裂解物纳米疫苗的抗肿瘤作用研究
2022-06-23石思伟贾润清邓雄威梁朝远张晓菲杨立群赵维坚申玉蓉
石思伟,贾润清,韩 卢,邓雄威,梁朝远,张晓菲,杨立群,赵维坚,申玉蓉,琚 琪,盛 望*
0 引言
肿瘤疫苗在癌症治疗中具有巨大的应用前景。固有免疫系统的细胞,拥有一种称为模式识别受体(Pattern recognition receptors,PRRs)的特殊受体。这些模式识别受体的配体称为病原体相关分子模式(Pathogen associated molecular pattern,PAMPs)[1]。位于细胞膜内侧的Toll样受体9(Toll like recepter,TLR9)对核酸的反应在单核细胞和巨噬细胞中得到了广泛的研究[2],可以诱导促炎反应,从而增强免疫反应[3]。胞嘧啶鸟嘌呤二核苷酸的寡脱氧核苷酸(CpG oligonucleotide,CPG-ODNs)能够促进机体的TH1反应,通过与TLR9相互作用发出信号,从而触发保护性免疫反应,提高宿主消除病原体的能力[4-5]。β-葡聚糖(β-glucans)通过刺激粒细胞、单核细胞、巨噬细胞和自然杀伤细胞发挥免疫作用[6]。抗原呈递细胞(Antigen presenting cells,APCs)表达各种受体,包括Dectin-1,这些受体可与β-(1-3)-葡聚糖[β-(1-3)-glucans]特异结合,调控下游信号通路,进而激活体内的免疫反应[7-10]。将β-(1-3)-葡聚糖进行羧甲基化修饰形成羧甲基化β-(1-3)-葡聚糖(Carboxymethyl β-glucan,CMG),可提高其水溶性,便于纳米颗粒的组装[11]。肿瘤裂解物中富含肿瘤相关抗原(Tumor-associated antigen,TAA)和肿瘤特异性抗原(Tumor specific antigen,TSA),但APCs对抗原的提呈效率较低,所以需要开发新型的递送系统来产生持久的免疫反应[12]。MC38是鼠源的结肠癌细胞,因其易于培养、成瘤性强,被广泛用于构建结肠癌动物模型。
本研究利用CMG、鱼精蛋白硫酸盐(Protamine sulfate,PS)与CPG-ODNs共组装形成的负载CPG的纳米颗粒(Nanoparticles-encapsulated CPG,CNP)进行体外水平的小鼠骨髓来源的树突状细胞(Dendritic cells derived from mouse bone marrow,BMDC)免疫激活实验,MC38肿瘤裂解物与CNP纳米颗粒共同组成纳米疫苗进行体内抗肿瘤实验,探究肿瘤裂解物纳米疫苗抗肿瘤作用,为肿瘤治疗探索新的技术手段。
1 材料与方法
1.1 材料 SPF级C57BL/6雌性小鼠60只(13~15 g,6~8周龄)购买于斯贝福(北京)生物技术有限公司[SCXK(京)2019-0010],饲养于谱尼测试集团股份有限公司动物房[SYXK(京)2018-0022],严格按照其要求进行动物实验(动物伦理批号PONY-2020-FL-71)。
MC38细胞储存于北京工业大学生命科学与生物工程学院;CMG、PS均购于美国Sigma公司;恒温磁力搅拌器购于上海司乐仪器有限公司;CPG-ODN 1826由生工生物工程(上海)股份有限公司合成,其基因序列为:TCCATGACGTTCCTGACGTT;粒细胞-巨噬细胞集落刺激因子(Granulocyte macrophage colony stimulating factor,GM-CSF);白细胞介素4(Interleukin 4,IL-4)购于Peprotech公司;CD3抗体、CD4抗体、CD8抗体、CD80抗体和CD86抗体购于BioLegend公司;胎牛血清(Fetal bovine serum,FBS)、PBS(Phosphate buffered saline)缓冲液、RPMI-1640购于Gibco公司;青链霉素混合液购自Hyclone公司;DNA酶(DNAase)、红细胞裂解液购于索莱宝公司;胶原酶V购于Sigma Aldrich公司;70 μm细胞筛网、淋巴细胞分离液、鼠白细胞介素6(Interleukin 6,IL-6)、鼠白细胞介素12p40(Interleukin 12p40,IL-12p40)、鼠肿瘤坏死因子-α(Tumor necrosis factor,TNF-α)、鼠γ干扰素(Interferon-γ,IFN-γ)ELISA试剂盒均购于达科为生物技术股份有限公司;EDTA抗凝管购于BD Biosciences公司;动态光散射激光粒度仪购于马尔文仪器有限公司;FACS流式细胞仪购于BD公司。
1.2 CNP纳米佐剂的制备及表征 用去离子水配制CMG(1 mg/ml)、PS(1 mg/ml),0.22 μm微孔滤膜过滤后,将PS溶液缓慢逐滴加入CMG溶液中,磁力搅拌30 min后静置5 min,12 000 g离心15 min,弃上清溶解于超纯水中,完成空纳米颗粒(Nanoparticles,NP)的制备。将CPG-ODN(1 μg/μl)溶于CMG(1 mg/ml)溶液中形成混合液,重复滴加PS等后续操作即可完成CNP制备,所含CPG浓度为20 μg/ml。用动态光散射激光粒度仪对CNP进行表征。
1.3 MC38细胞裂解物制备 将培养至对数期的MC38用胰酶消化,终止消化后PBS重悬离心,用PBS调整细胞密度至107个/ml,将细胞悬液置于冻存管中,将冻存管置于液氮5 min后放于37 ℃水浴锅5 min,重复5次。2 000 g离心15 min,弃去沉淀,采用BCA法测定蛋白含量后备用。
1.4 体外刺激BMDC成熟实验 将6周左右的C57BL/6小鼠处死,剥离其胫骨与股骨,浸于70%乙醇中,用RPMI-1640多次冲洗骨髓,收集骨髓细胞,在培养箱中放置30 min后,收集非贴壁细胞,得到BMDC。用树突状细胞(Dendritic cells,DC)培养基(RPMI-1640+20 ng/ml GM-CSF+1 ng/ml IL-4)调整细胞密度为106个/ml,于6孔板中每孔铺4 ml细胞悬液,每间隔2 d更换DC培养基,培养7 d。第7天将细胞以106个/ml的密度铺于24孔板中,并分为4组进行加药刺激,分别为PBS组、NP组(β-葡聚糖200 μg/ml)、CPG(4 μg/ml)组和CNP组(CPG 4 μg/ml),每组分别给药10 μl。培养24 h后收集上清与BMDC进行后续测定。
1.5 体内抗肿瘤实验 将C57BL/6雌性小鼠适应性生长1周。培养MC38细胞至对数期,胰酶消化后计数,调整细胞密度为3×106个/ml,每只小鼠的右后肢皮下接种100 μl的MC38细胞。用CNP溶液将MC38细胞裂解物浓度调整至500 μg/ml,混合物即为裂解物纳米疫苗(vaccine)。用PBS将MC38细胞裂解物浓度调整至500 μg/ml,即为lysate。筛选出肿瘤体积为50 mm3、大小相近的24只小鼠,并随机分为4组(PBS组、lysate组、CNP组和vaccine组)。每组颈部皮下注射药物100 μl,此时记为第0天。每过7 d免疫1次,免疫期间每2 d测量肿瘤最大直径(d)和最小直径(r),根据公式d×r2/2计算肿瘤体积。
1.6 取材处理 在最后1次免疫3 d后,对小鼠进行麻醉,用眼眶取血法收集外周血于EDTA抗凝管中,4 000 r/min离心10 min,分别收集上清和红细胞。离心后收集的外周血用淋巴细胞分离液分离,收集淋巴细胞,PBS润洗1次后进行流式抗体染色。用脱颈法处死小鼠,解剖出小鼠腹股沟淋巴结和脾脏,将淋巴结剪碎后在37 ℃条件下用RPMI -1640、胶原酶Ⅴ(41.75 μg/ml)和DNA酶(2 μg/ml)消化30 min。将消化完全的淋巴结组织分别置于70 μm筛网中研磨,RPMI-1640冲洗后离心,淋巴细胞分离液分离收集淋巴细胞,PBS润洗1次后进行流式抗体染色。将脾脏置于70 μm筛网中加入PBS研磨,冲洗后离心,红细胞裂解液处理后收集剩余白细胞,PBS润洗1次后进行流式抗体染色。
1.7 ELISA测定BMDC上清与血清细胞因子含量 按照ELISA试剂盒说明书操作,测定BMDC上清中IL-6、IL-12p40含量,测定小鼠血清中IFN-γ、TNF-α含量。
1.8 流式细胞术 对BMDC进行CD80、CD86的流式抗体染色,对血白细胞、脾脏淋巴细胞、腹股沟淋巴结淋巴细胞进行CD3、CD4及CD8的流式抗体染色,利用BD-FACS流式细胞仪检测。

2 结果
2.1 CNP纳米颗粒表征 如图1所示,CNP纳米颗粒zeta电位为(-23.1±0.4) mV,纳米颗粒粒径约为(213.2±0.8) nm,尺寸适用于进行体内及体外实验。
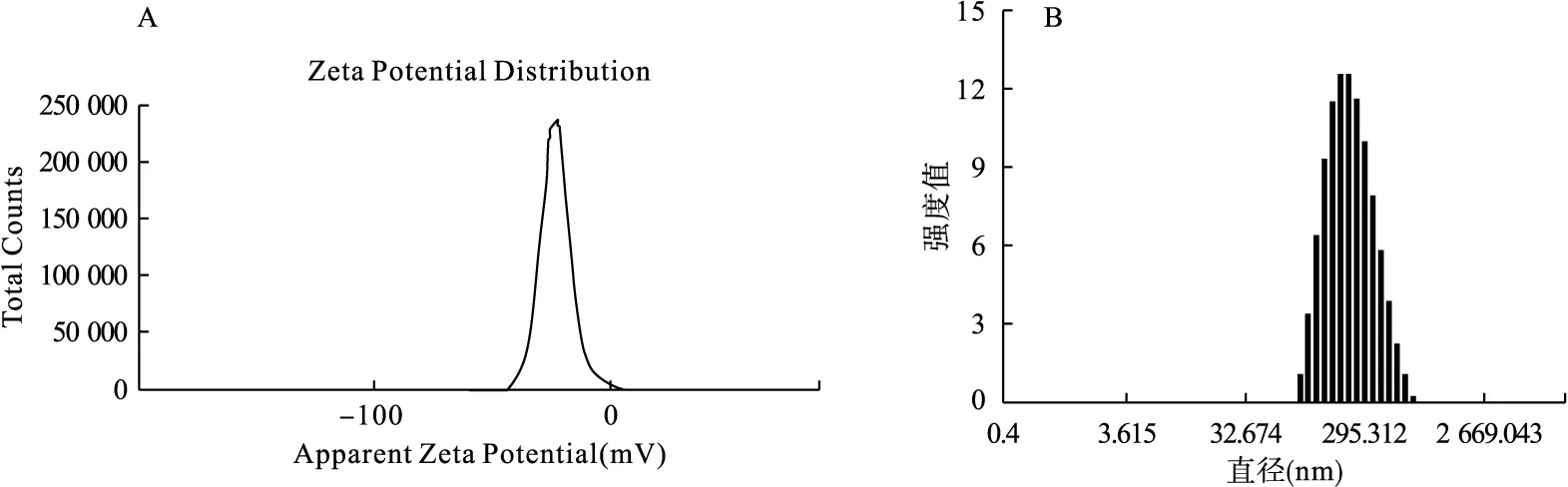
图1 CNP纳米颗粒表征
2.2 CNP纳米颗粒激活DC成熟 DC作为机体内主要的抗原提呈细胞,在其未成熟时缺乏对抗原的提呈能力,只具有一定的抗原捕获能力,而成熟的DC具有很强的抗原提呈能力,促进T细胞分化为细胞毒性T淋巴细胞。体外激活BMDC实验如图2所示,CD80、CD86是DC表面成熟标志物分子,CNP组(18.9%±0.7%)与CPG组(12.2%±0.2%)相比,对DC的促成熟作用有显著性差异(P=0.011 6),CNP组与PBS组(8.1%±0.9%)相比,能显著促进DC成熟(P=0.005 1)。单独的空纳米颗粒刺激DC成熟作用不显著。图3所示,CPG可以刺激DC产生大量IL-12p40(10 100.7±378.2)pg/ml和IL-6(84 746.8±2 657.7)pg/ml,与CPG组比较,CNP显著增强了BMDC对IL-12p40[(15 111.2±1 844.3)pg/ml]和IL-6[(190 402.1±11 524.8)pg/ml]的分泌(P=0.019 7,P<0.000 1)。
2.3 荷瘤小鼠肿瘤体积变化 4种给药方式处理后的肿瘤体积变化如图4所示。与PBS组比较,lysate单独作用下肿瘤体积减少,但差异无统计学意义(F=0.38,P=0.94);CNP单独作用下,肿瘤体积具有一定程度的减小,差异具有统计学意义(F=2.94,P<0.01);Vaccine组肿瘤体积明显减小,差异具有统计学意义(F=7.76,P<0.01)。
2.4 小鼠血清IFN-γ及TNF-α含量 4种给药方式处理后的小鼠血清IFN-γ及TNF-α含量结果见图5,MC38裂解物纳米疫苗免疫后,小鼠的IFN-γ和TNF-α分别为PBS组的3倍和1.5倍(P=0.040 6,P=0.019 7);lysate组小鼠IFN-γ与TNF-α的含量无显著变化(P=0.615 2,P=0.066 1);CNP组小鼠IFN-γ与TNF-α的含量无显著变化(P=0.359 6,P=0.059 0)。
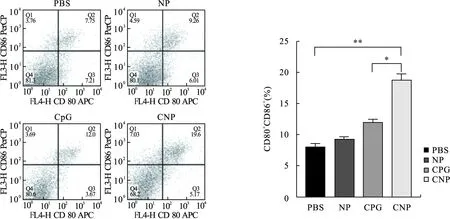
图2 DC细胞在不同药物刺激下成熟情况
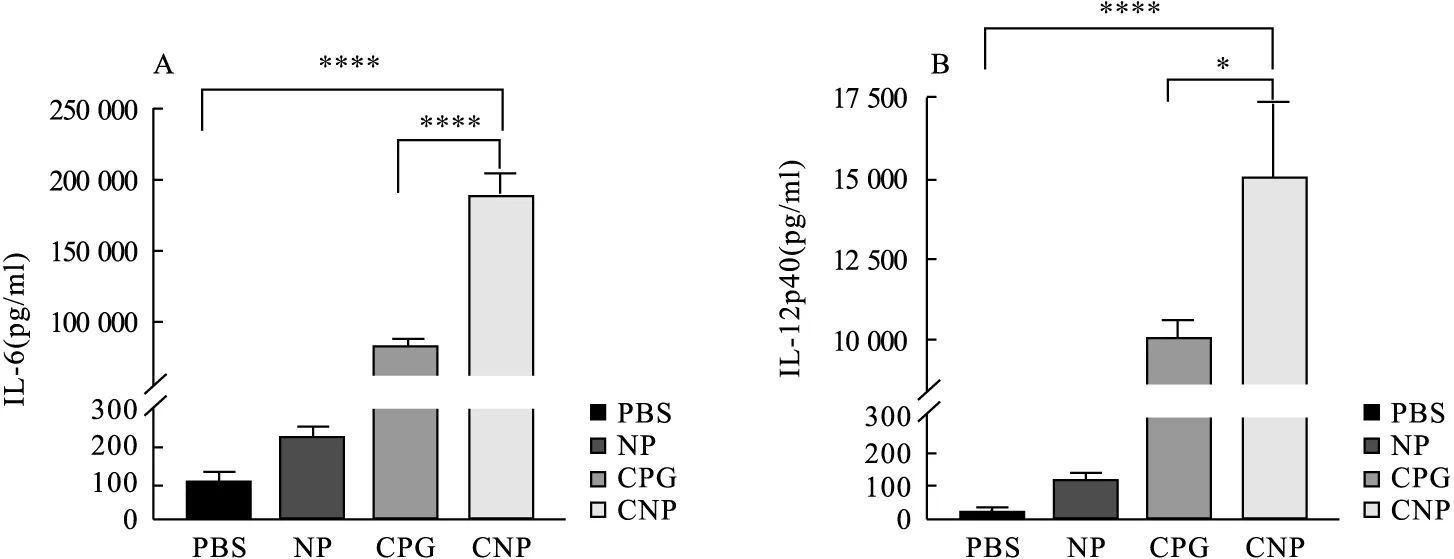
图3 DC上清IL-6(A)、IL-12p40(B)的含量
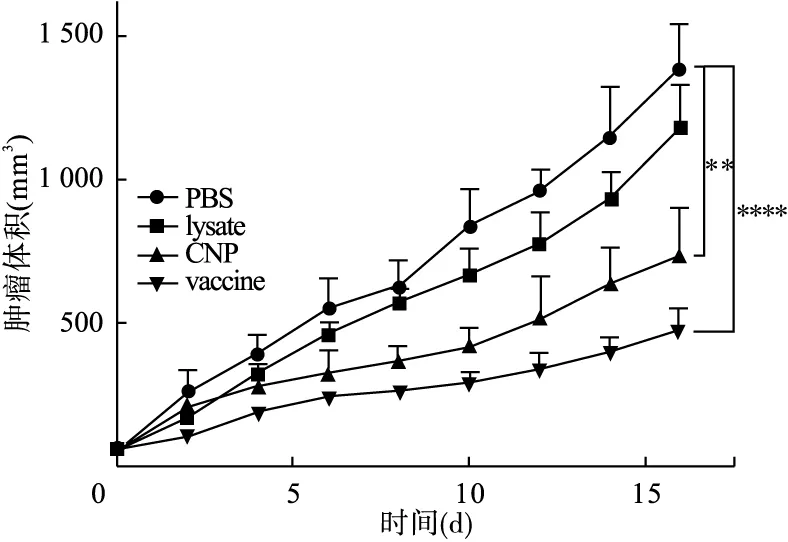
图4 各组肿瘤体积增长曲线
2.5 小鼠外周血T淋巴细胞百分比 使用流式细胞仪检测结果如图6,MC38肿瘤裂解物纳米疫苗和PBS组相比,辅助性T淋巴细胞变化差异无统计学意义(P=0.191 3),但产生了更多的杀伤性T淋巴细胞,vaccine组的CD3+CD8+T淋巴细胞约为PBS组的2.5倍,差异具有统计学意义(P=0.007 9)。CNP组的CD3+CD8+T淋巴细胞约为对照组的2倍,差异无统计学意义(P=0.095 6)。lysate组与PBS组相比,外周血CD3+CD4+T淋巴细胞百分比、CD3+CD8+T淋巴细胞百分比差异无统计学意义(P=0.771 5、P=0.184 9)。
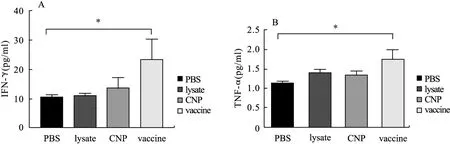
图5 小鼠血清中的IFN-γ(A)和TNF-α(B)含量
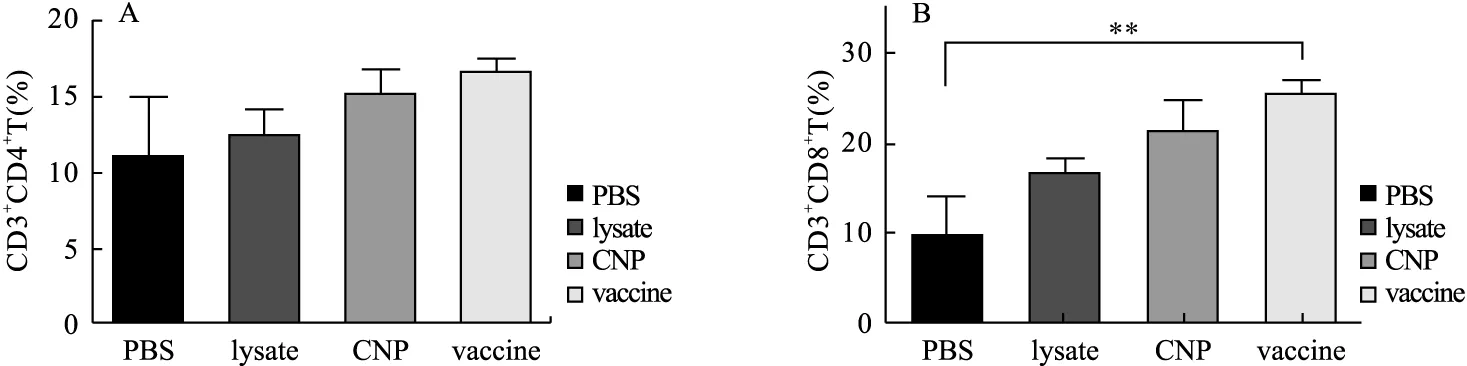
图6 小鼠外周血T淋巴细胞比例
2.6 小鼠脾脏T淋巴细胞百分比 小鼠脾脏T淋巴细胞流式结果如图7所示。与PBS组比较,vaccine组CD3+CD8+T淋巴细胞比例显著上升(P=0.046 5);lysate组脾脏CD3+CD4+、CD3+CD8+T淋巴细胞变化差异无统计学意义(P=0.702 7,P=0.293 8);CNP组脾脏CD3+CD4+、CD3+CD8+T淋巴细胞变化差异无统计学意义(P=0.737 1,P=0.322 2)。
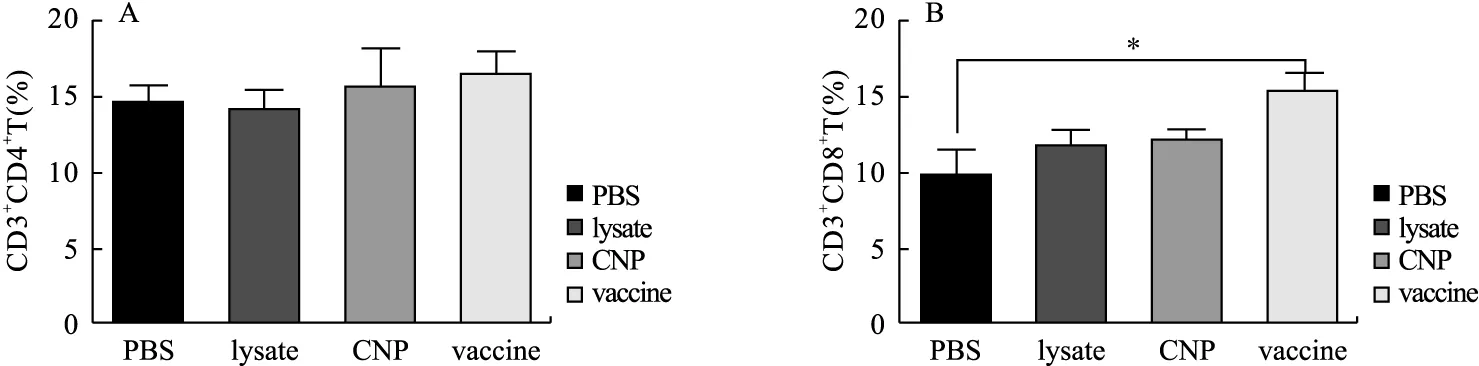
图7 小鼠脾脏T淋巴细胞比例
2.7 小鼠腹股沟淋巴结T淋巴细胞百分比 各组腹股沟淋巴结T淋巴细胞流式结果如图8。与PBS组比较,vaccine组CD3+CD4+T淋巴细胞比例升高,差异具有统计学意义(P=0.026 9)。单独使用lysate或CNP免疫条件下,与PBS组相比,CD3+CD4+T淋巴细胞差异无统计学意义(P=0.907 4,P=0.184 2)。与PBS组相比,lysate组、CNP组、vaccine组的CD3+CD8+T淋巴细胞差异无统计学意义(P=0.233 1,P=0.338 3,P=0.965 1)。
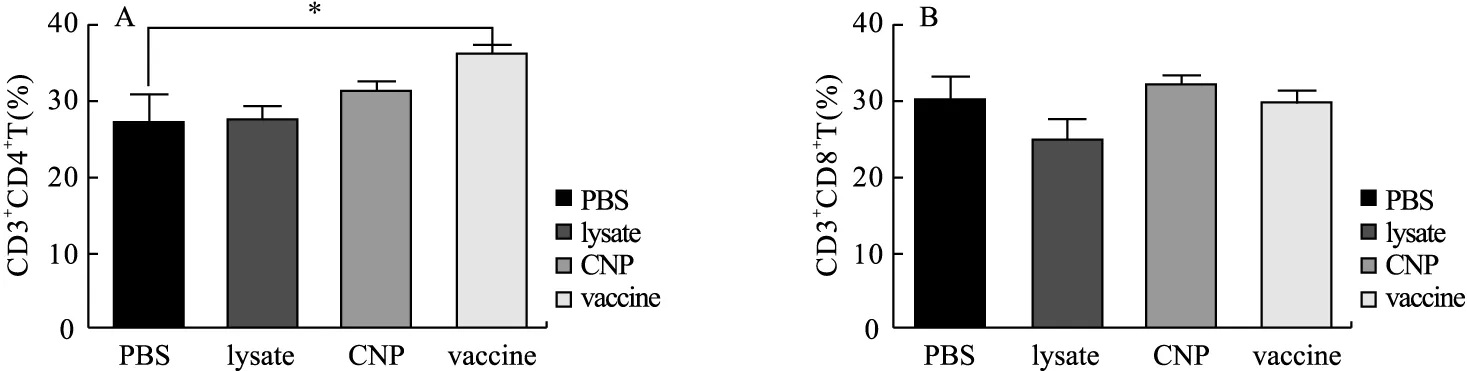
图8 小鼠腹股沟淋巴结T淋巴细胞比例
3 讨论
CPG具有直接激活B细胞和单核细胞(巨噬细胞和树突状细胞)的能力,同时可以间接激活NK细胞和T细胞等多种免疫效应细胞[4,13]。CPG-ONDs这一特性决定了其作为免疫佐剂的巨大潜力。传统免疫检查点抑制剂治疗效果不理想正是源于CD8+T淋巴细胞缺失[14]。完整肿瘤细胞裂解产物是TAA的广泛来源,这将会促进形成CD4+辅助性T淋巴细胞和CD8+细胞毒性T淋巴细胞。BMDC成熟实验表明,CNP纳米佐剂有效地促进了DC的成熟,提高DC的抗原提呈能力。因此,肿瘤裂解物辅以适当的佐剂可以诱导更加完整高效的免疫反应,用于癌症的治疗。
单独使用CNP纳米颗粒和MC38细胞裂解物虽具有一定的抗肿瘤效果,但二者组成的纳米疫苗抗肿瘤效果最优,肿瘤体积增加幅度最小,同时纳米疫苗还提高外周血及脾脏中CD8+T淋巴细胞比例,提高腹股沟淋巴结CD4+T淋巴细胞比例,表明有效免疫反应的产生,需要同时具备CNP激活DC与裂解物提供抗原2种条件。IL-6在健康免疫和多种疾病调理的过程中具有重要的作用[15],可以刺激B细胞、T细胞的增殖,从而产生抗体和CTL分化,增强机体的抗肿瘤免疫活性。IL-12同样具有免疫治疗及抗肿瘤的潜力[16]。IFN-γ具有细胞抑制、促凋亡和抗增殖功能,其在细胞免疫的激活以及随后的抗肿瘤免疫反应的过程中起着关键作用[17]。TNF-α是一种多效细胞因子,参与控制炎症、抗肿瘤反应和免疫系统稳态控制等一系列生理过程[18]。本研究设计的MC38肿瘤裂解物纳米疫苗体外及体内实验结果显示,小鼠体内多种细胞因子含量得到了显著的提升,改善了肿瘤微环境,促进了机体的抗肿瘤免疫水平。
本研究利用纳米技术构建CNP纳米佐剂,并与MC38肿瘤裂解物共同组成抗肿瘤纳米疫苗,本纳米疫苗在体内及体外水平均具有良好的免疫激活能力,以及明显的结肠癌抑制能力,可以有效抑制肿瘤的生长,提高多种细胞因子含量,提升脾脏及外周血CD8+T淋巴细胞比例,提升腹股沟淋巴结CD4+T淋巴细胞比例,大幅增强小鼠肿瘤免疫水平。本研究为结肠癌的免疫治疗提供了新的技术思路。
