陈米中蛋白质对淀粉颗粒间解聚集的影响
2022-06-23郭玉宝朱世民宁俊帆
董 鹏, 郭玉宝, 朱世民, 宋 睿, 宁俊帆
(安徽工程大学生物与食品工程学院,芜湖 241000)
大米作为主要口粮,养活了全球65%以上的人口[1],是人体所需碳水化合物和多种营养素的主要来源。为了口粮的周年供应和粮食安全,稻米储藏是十分必要的。然而,稻谷不耐储藏。不管是稻谷还是大米,储藏中均会发生陈化,引起品质劣变,但陈化劣变的机理仍不清楚。
大米陈化劣变与非淀粉组分的变化密切相关[2,3],如胚乳细胞壁和蛋白质的变化、蛋白质之间的相互作用、脂质氧化的分解产物及淀粉与蛋白质之间的相互作用,但是非淀粉组分影响淀粉糊化的途径尚不清楚。直链淀粉与脂类形成包合物可降低淀粉的酶解敏感性和溶胀能力,但是脱脂并未阻止陈化[4]。大米储藏中蛋白质总量基本不变,巯基减少,二硫键增多,这使得米饭的硬度增大,黏性减小[5]。刘桃英等[6]发现,添加一定量的大米蛋白后,米粉的溶胀性、峰值黏度、谷值黏度、崩解值和最终黏度降低,糊化温度、回生值、峰值时间和热焓值增加,表明大米蛋白对淀粉的糊化有抑制作用。去除米粉中的醇溶蛋白后,衰减值显著减小[7],峰值黏度、崩解值和最终黏度都显著增大[8]。
蛋白质和脂质对陈化的影响研究,有考察淀粉糊化宏观指标——黏度的变化,或考察蛋白质结构和状态的变化,而对陈化中蛋白质影响淀粉糊化的微观途径很少涉及,蛋白质影响淀粉糊化的过程机制仍不清楚。米粒中蛋白质含量分布不均,米粒外层富含蛋白;而且大米储藏中米粒外层暴露于空气中,陈化变化更明显。因此,本文以富含蛋白的米粒外层为研究对象,通过逐一脱除各蛋白研究其对淀粉糊化粒度分布和显微形态的影响,以新米为对照,比较新米与陈米之间在各蛋白脱除后的差异,从而揭示陈化中蛋白质对淀粉糊化微观变化的影响,有助于阐明稻米陈化的机制。
1 材料与方法
1.1 实验材料
大米:粳型新谷新米,初始含水量为(14.08±0.07)%。
1.2 实验试剂
正己烷、氯化钠、氢氧化钠、无水乙醇(均为分析纯)。
1.3 仪器与设备
JGMJ8090稻谷精米检测机,MS2000激光粒度分析仪,S-4800冷场发射扫描电子显微镜,LW200CA光学显微镜,LGJ-12真空冷冻干燥机。
1.4 实验方法
1.4.1 大米储藏及米粉的制备
将大米分成两份,分别装入250 mL广口瓶中,将瓶口涂上凡士林,并用保鲜膜包覆密封,一份在4 ℃下贮存保鲜,作为对照[5];另一份置于37 ℃恒温培养箱中储藏12个月,获得陈米[9]。利用精米机对大米进行剥蚀碾磨,通过控制碾米时间,获得米粒外层米粉(碾削质量占米粒质量的15%),过40目筛,筛下物[新米和陈米蛋白质量分数分别为(8.12±0.24)%和(8.08±0.43)%]装自封口袋在4 ℃下贮存备用。
1.4.2 脂肪和各蛋白的脱除
脱脂、脱蛋白流程如图1所示。为减少脂肪对脱蛋白的影响,预先用正己烷脱脂[4]。根据大米中清蛋白、球蛋白、谷蛋白和醇溶蛋白在不同溶剂中的溶解性不同,参考Osborne经典方法逐一提取各蛋白[10]。具体如下:称取40 g新米米粉(F0),用4倍正己烷在25 ℃脱脂1 h,抽滤,沉淀在室温挥发24 h,得脱脂米粉(F1)。取40 g脱脂米粉,用4倍蒸馏水脱除清蛋白,离心后沉淀冻干,得脱清蛋白残基(F2);用蒸馏水脱除清蛋白所得沉淀,再用5% NaCl脱球蛋白,经水洗、离心后沉淀冻干,得脱球蛋白残基(F3);脱球蛋白所得沉淀,再用0.1 mol/L的NaOH脱谷蛋白,经盐酸中和及水洗后沉淀冻干,得脱谷蛋白残基(F4);脱谷蛋白所得沉淀,再用70%乙醇脱除醇溶蛋白,经水洗、离心后沉淀冻干,得脱醇溶蛋白残基,即粗淀粉[11][F5,蛋白质量分数(0.21±0.03)%]。每个脱除步骤重复2次。类似地,以陈米米粉(A0)为原料,经相同处理,分别得到陈米脱脂米粉(A1)、陈米脱清蛋白残基(A2)、陈米脱球蛋白残基(A3)、陈米脱谷蛋白残基(A4)和陈米脱醇溶蛋白残基[A5,即陈米粗淀粉,蛋白质量分数(0.26±0.04)%]。各个蛋白脱除后,所得残基置于自封口袋于4 ℃保存备用。

图1 脱脂脱蛋白流程图
1.4.3 粒度分布测定
称取0.2 g样品于试管中,加入10 mL蒸馏水,涡旋使其分散均匀后静置10 min,然后放入75 ℃恒温水浴锅中加热5 min(过高温度会黏连成胶凝化态),取出后放置在50 ℃的恒温水浴锅中保温,防止其老化。采用激光粒度分析仪测定粒度,分析条件:分散剂为水,仪器转速为1 800 r/min,超声分散,加样使遮光度为10%~20%,每个样品平行测定5次,取平均值[12]。
1.4.4 组分陈化效应及陈化贡献率的计算
某组分被脱除前后粒度分布体积分数的变化,代表该组分对粒度分布的影响。对于新米粉及其残基来说,因为没有发生陈化,某组分被脱除前后的变化量是由于组分自身存在与否引起的,代表基质效应(ME)[4];对于陈米粉及其残基来说,因为发生了陈化,某组分被脱除前后的变化量是总效应(TE),既包括组分自身的基质效应,也包括组分在陈化中发生的变化引起的陈化效应(AE)。因此,各组分对粒度分布的陈化效应可以从新、陈米各残基粒度分布体积分数的变化量(AE=TE-ME)来获得,而陈化贡献率是某组分的陈化效应占实际陈化效应(从新米到陈米陈化变化量)的比例[4]。
1.4.5 光镜形态观察
样品处理方法与粒度分布测定时相同。观察时,先将试管中样品涡旋震荡1 min混匀,用吸管取样滴在载玻片上,盖上盖玻片,观察并拍照记录。
1.4.6 扫描电镜观察
前期制样方法与粒度分布中制样相同,但糊化后将样品冻干,研成粉末,用导电胶粘在样品台上喷金10 nm。加速电压15 kV,放大3 000倍。
1.5 数据处理
使用SAS 8.01进行ANOVA单因素方差分析及邓肯多重比较(Duncan’s Multiple Range Test,P<0.05),结果以“平均值±标准差”表示。
2 结果与讨论
2.1 脂肪和各蛋白对糊化粒度分布的影响
通过比较脂肪和各蛋白对新米和陈米影响的差异,说明各组分的陈化变化对粒度分布的影响,从而阐明脂肪和各蛋白对陈化后淀粉颗粒间解聚集的影响。从图2可以看出,新米和陈米的粒度分布有明显差异(图2a),陈米小粒径峰更低,大粒径峰更高。小粒径峰出现在9 μm附近,属于淀粉颗粒的范围[13];大粒径峰在50 μm附近,属于胚乳细胞的范围[14],表明陈化使淀粉颗粒间难于解聚。脱去脂肪及4种蛋白以后,所得新米和陈米的粗淀粉粒度分布曲线基本重合(图2b),表明脂肪和蛋白质在陈化中的变化是陈米粒度分布改变的主要原因。
脂肪和4种蛋白各自对粒度分布的影响结果如图2c~图2l所示。图2c和图2d表明,新米中脂肪对粒度分布几乎没有影响,而陈米中脂肪的存在明显促进了淀粉颗粒的解聚,因为陈米脱脂前小粒峰明显比脱脂后更高。脱清蛋白后,新米的小粒径峰明显增大,大粒径峰消失(图2e);陈米的小粒径峰也明显增大,但低于新米,大粒径峰明显减小但仍存在(图2f),表明清蛋白的存在对新米和陈米中淀粉颗粒间的解聚具有明显抑制作用,且陈化后的抑制作用更强,可能是陈化后清蛋白水溶性降低所致。新米脱除球蛋白前后,均只有一个小粒径峰,但脱球蛋白后小粒径峰升高且峰形变窄(图2g);陈米脱球蛋白后,小粒径峰明显升高,大粒径峰趋于消失(图2h),显示出球蛋白对淀粉颗粒的解聚也具有显著的抑制作用,且陈化后球蛋白的抑制作用明显更大。
谷蛋白和醇溶蛋白是疏水性蛋白。脱除谷蛋白后,新米的小粒径峰在一定程度上降低,而峰位粒径有所增大,说明新米中的谷蛋白对淀粉颗粒的解聚有一定的促进作用,而略微抑制了淀粉颗粒的溶胀(图2i);陈米脱谷蛋白后,小粒径峰明显增大,峰形变窄,大粒径峰完全消失(图2j),表明陈米中的谷蛋白对淀粉颗粒的解聚具有明显抑制作用。脱除醇溶蛋白后,新米小粒径峰有所增大(图2k);陈米小粒径峰峰高不变,峰位粒径略有增加(图2l),显示陈化后醇溶蛋白对淀粉颗粒的解聚影响很小。
对于新米,清蛋白和球蛋白对淀粉颗粒间的解聚具有明显的抑制作用,谷蛋白有较小的促进作用,醇溶蛋白的抑制作用较小,脂肪几乎没有影响;对于陈米,清蛋白、球蛋白和谷蛋白对淀粉颗粒间的解聚具有明显的抑制作用,醇溶蛋白几乎没有影响,而脂肪却有明显的促进解聚作用。这在一定程度上说明,大米陈化中清蛋白、球蛋白和谷蛋白的变化使得淀粉颗粒在糊化中难于解聚。这些分析只是定性的,陈化后各蛋白对淀粉颗粒解聚抑制作用的净效应以及对陈化变化的贡献程度,有待进一步分析。
脂肪和各蛋白对糊化粒度分布的影响见表1。由表1可知,陈米米粉比其脱脂后的小粒径峰体积百分数明显更大,表明脂肪的存在明显促进了陈米中淀粉颗粒的解聚,而脱脂对新米的影响在数值上相对较小。脱清蛋白后,陈米中淀粉颗粒解聚更多,而新米已完全解聚成小颗粒(淀粉颗粒)。

表1 脂肪和各蛋白对淀粉糊化粒度体积分数的影响
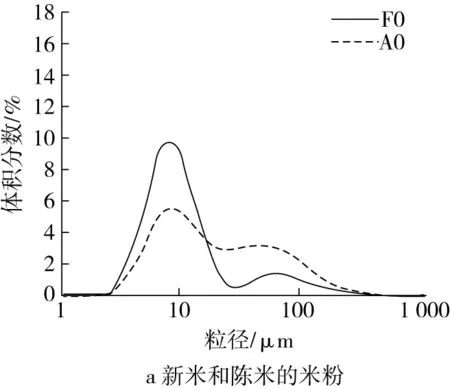
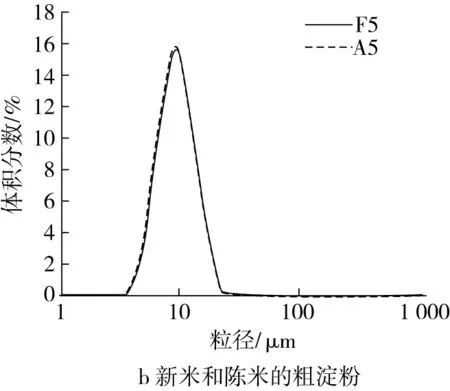

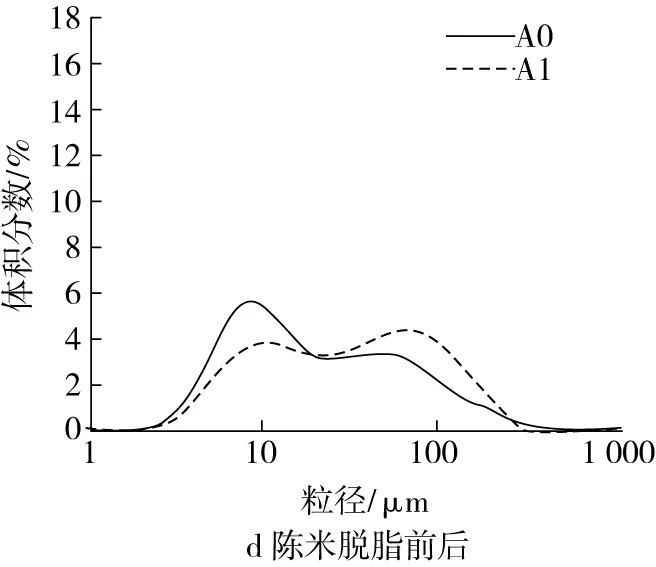
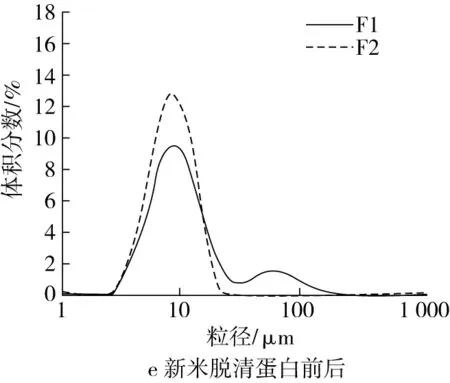
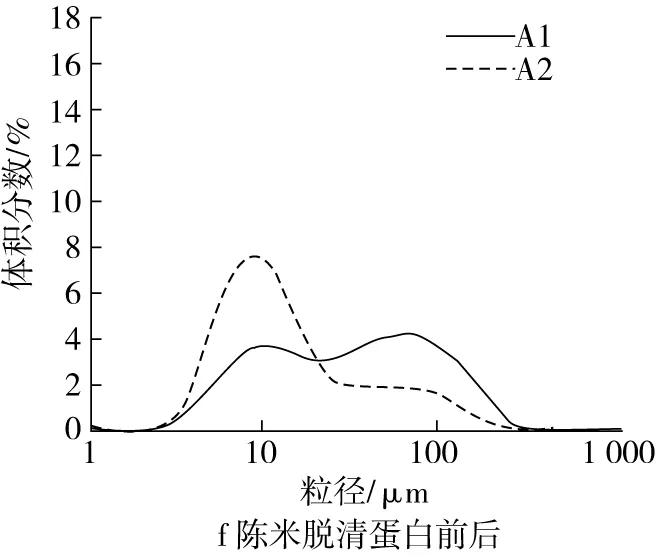
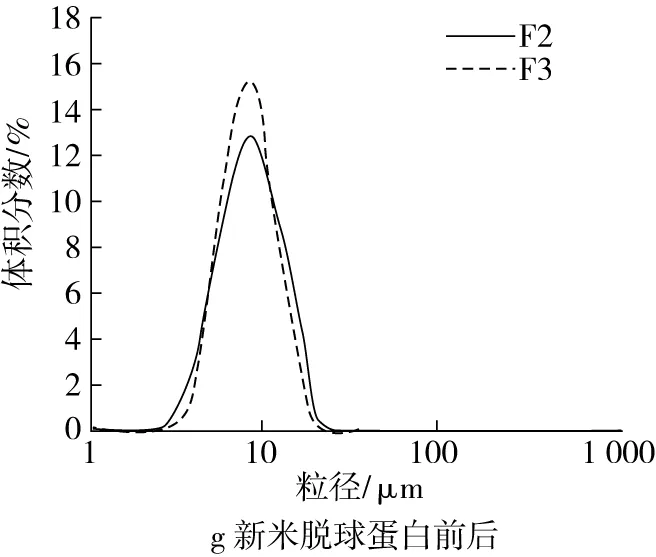
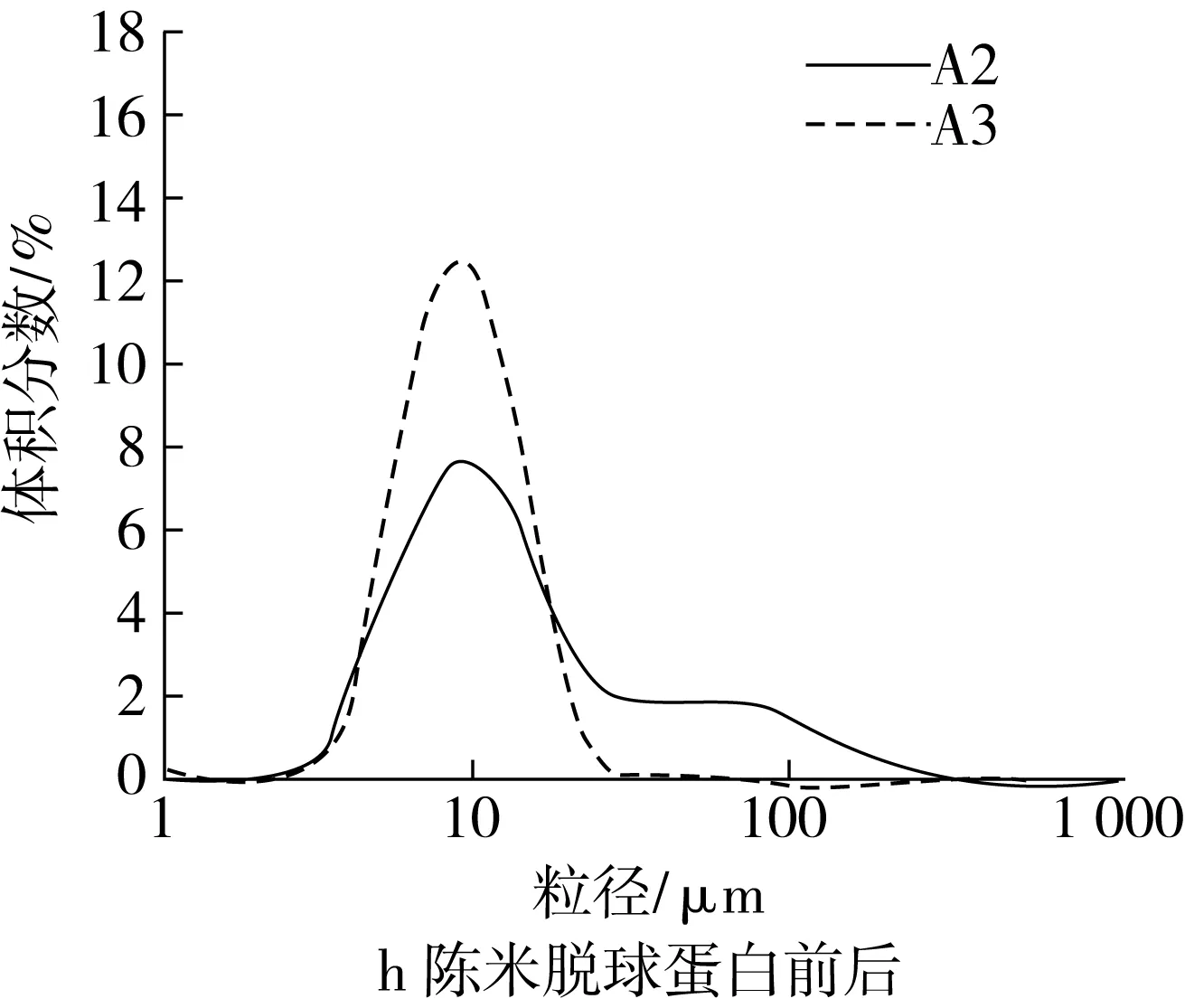
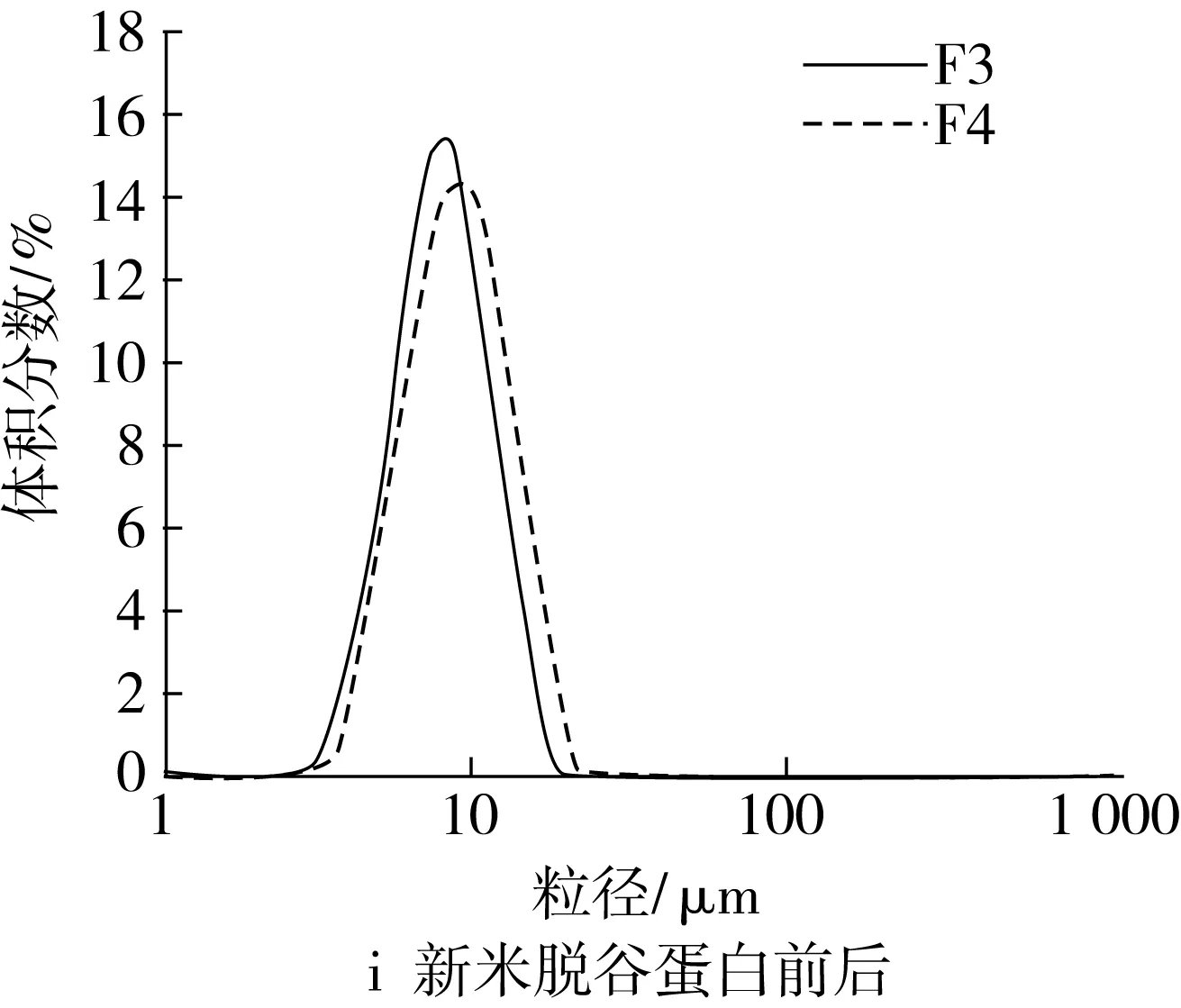
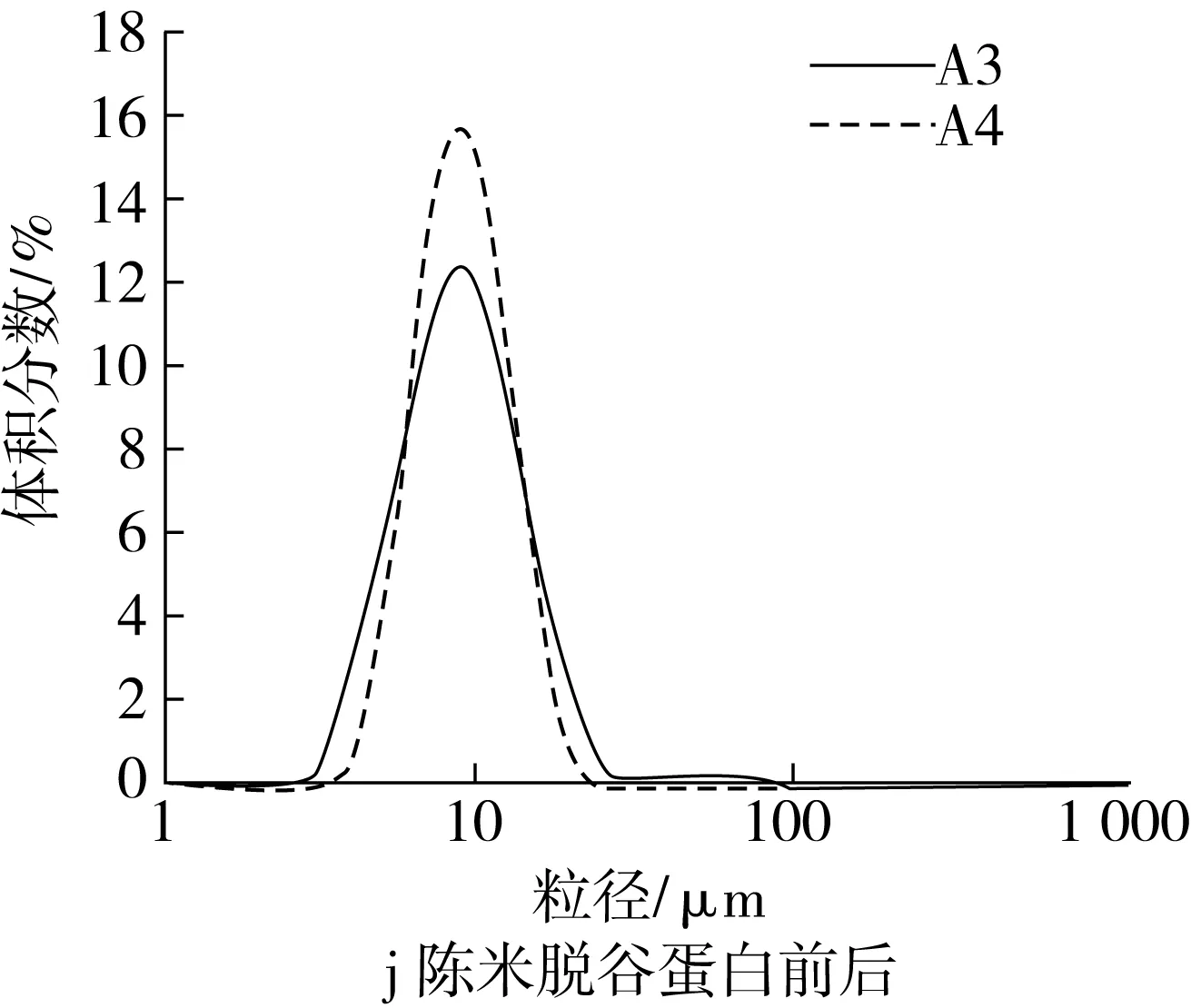
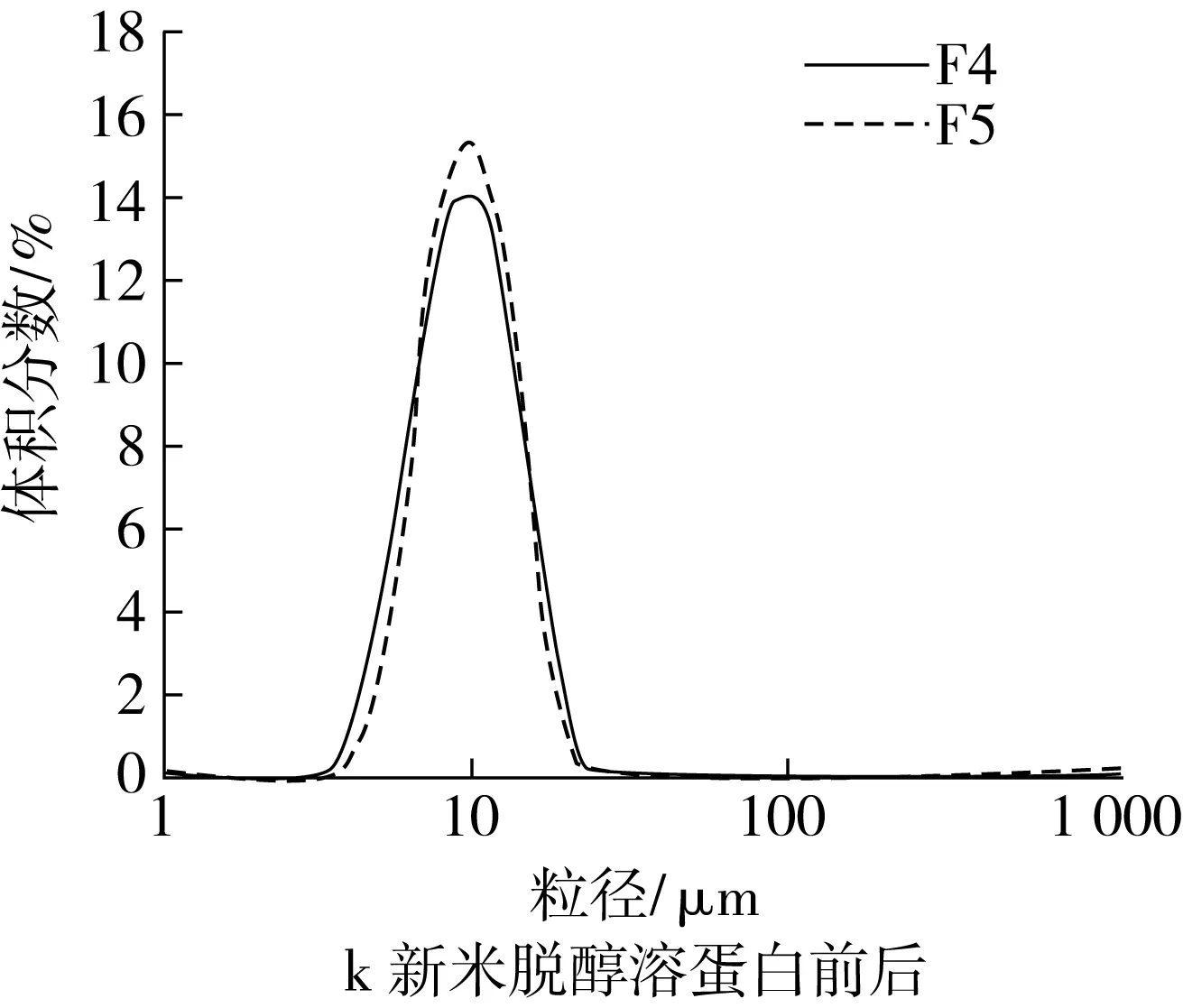
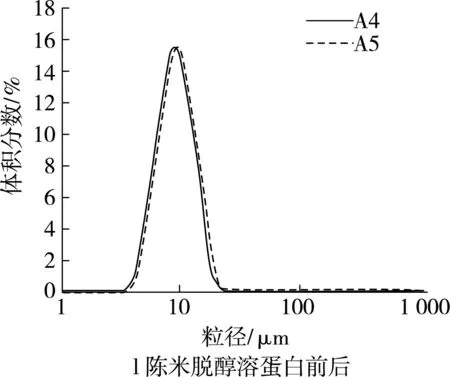
图2 脂肪和各蛋白对淀粉糊化粒度分布的影响
陈米脱球蛋白后,小粒径峰体积分数显著增大,脱除谷蛋白后才完全解聚成小颗粒。结果说明,蛋白质对陈米中淀粉颗粒间解聚的抑制作用远大于新米,导致陈米比新米中的淀粉颗粒更难解聚,陈米须在谷蛋白脱除后才完全解聚,而新米只需在清蛋白脱除后即可完全解聚。
为了更清楚地说明大米中各蛋白在陈化中的变化对淀粉颗粒间解聚的贡献,需要在排除各组分自身基质效应的基础上,分离出各蛋白对淀粉颗粒间解聚的陈化效应,进而比较各组分对陈化变化贡献的大小[4,15]。由表2可知,脂肪、清蛋白和球蛋白的陈化贡献率绝对值较大,是影响陈米中淀粉颗粒间解聚的主要组分,其中清蛋白和球蛋白明显抑制了淀粉颗粒的解聚,陈化贡献率分别为89%和82%;脂肪则对淀粉颗粒的解聚具有明显的促进作用,陈化贡献率为-75%。谷蛋白对淀粉颗粒解聚的抑制作用很小,醇溶蛋白对淀粉颗粒解聚没有影响,可能是因为谷蛋白和醇溶蛋白是疏水性蛋白,吸水溶胀程度低。

表2 大米陈化过程中各组分的陈化效应及陈化贡献率
2.2 脂肪和各蛋白对光学显微形态的影响
从光学显微形态可以看出,从新米中分散出来的小颗粒比陈米中的更多,新米保留下来的大颗粒比陈米更少(图3a、图3b)。新米脱脂后(图3c),大颗粒比脱脂前(图3a)变得更小;而陈米脱脂后(图3d)的颗粒分散程度低于脱脂前(图3b),体现为脱脂后的大颗粒比脱脂前更大,这与陈米中脂肪促进淀粉颗粒间解聚的结果相一致。新米脱清蛋白后大颗粒明显变小(图3e);陈米脱清蛋白后这一变化更加明显,即大颗粒明显变小且数量更少(图3f),这与粒度分析的结果一致,即大米陈化后清蛋白对淀粉颗粒解聚的抑制作用明显增强。
新米脱球蛋白后小颗粒变得更小(图3g),尽管仍可见少量颗粒聚集,但其可能会在粒度测定中的高度稀释和搅拌作用下分散成小颗粒;陈米脱球蛋白后,可见的小颗粒更多(图3h),这支持陈米中的球蛋白对淀粉颗粒分散具有明显的抑制作用。在高倍镜下观察,脱除谷蛋白后,新米中均为淀粉单粒(图3i),而陈米中仍可见少量淀粉复粒(图3j)。醇溶蛋白被脱除后,新米和陈米间的淀粉颗粒形态差异不大,只是新米淀粉颗粒溶胀得更大(图3k、图3l),与粒度分析结果一致。因此,光学显微结果较好地支持了粒度分析结果,即清蛋白和球蛋白的存在明显抑制了淀粉颗粒的解聚,而脂肪则明显促进了陈米淀粉颗粒的解聚。

图3 脂肪和各蛋白对糊化光学显微形态的影响
2.3 脂肪和各蛋白对扫描电镜形态的影响
新米和陈米脱除脂肪和各蛋白后的扫描电镜如图4所示,新米中的淀粉颗粒溶胀得较充分,质地平滑,蛋白体[16]凸出且溶胀得比陈米中的更大(图4a);陈米中的淀粉颗粒溶胀程度相对较低,形态干瘪,蛋白体较小,且镶嵌在淀粉之中(图4b)。脱脂后,新米中可见大而深的淀粉颗粒脱落坑(图4c);而陈米中的淀粉颗粒脱落坑小而浅(图4d)。脱除清蛋白后,新米中可见小而深的脱落坑,淀粉颗粒分离坑明显(图4e);而陈米中的淀粉颗粒依然与基质黏连在一起(图4f)。

图4 脂肪和各蛋白对扫描电镜形态的影响
脱球蛋白后,新米中淀粉颗粒脱落坑较多,且更大(图4g);而陈米中淀粉颗粒脱落坑比脱球蛋白前明显增加,但存在较小的脱落坑(图4h)。脱谷蛋白后,新米中的淀粉颗粒脱落坑更大更深,表明淀粉颗粒溶胀充分(图4i);陈米中的淀粉颗粒脱落坑也变深,但较小,说明陈米中的淀粉颗粒获得分离,但溶胀程度较低(图4j)。脱醇溶蛋白后,新米和陈米均糊化均较完全,呈凝胶化状态,可能是淀粉颗粒解聚完全的结果(图4k、图4l)。
结果表明,陈米需在脱除球蛋白后可见明显的淀粉颗粒分离,而新米只需在脱除清蛋白后即可见明显的淀粉颗粒分离,因此陈米中的淀粉颗粒间更难解聚。此外,陈米中的淀粉颗粒溶胀程度低,蛋白体溶胀得更小,且被淀粉更多包埋,可能是淀粉颗粒难于解聚的原因。
3 结论
陈米中的脂肪和各蛋白被逐一脱除后,淀粉颗粒间可以充分解聚,与新米间的粒度分布差异消失,光学显微结果支持粒度分布结果,表明脂肪和蛋白质对陈米中淀粉颗粒间的解聚具有重要影响。通过分离大米中各组分的陈化效应并计算陈化贡献率,发现清蛋白和球蛋白明显抑制了陈米中淀粉颗粒间的解聚,其陈化贡献率分别为89%和82%;而脂肪则对陈米中淀粉颗粒间的解聚具有促进作用,陈化贡献率为-75%;谷蛋白的抑制解聚作用较小,醇溶蛋白几乎无影响。扫描电镜显示,陈米需在脱除球蛋白后方能充分解聚,新米只需在脱除清蛋白后即可;陈米比新米中的淀粉颗粒脱落坑和蛋白体更小,被淀粉包埋更多。因此,清蛋白和球蛋白在陈化中的变化抑制了淀粉颗粒间的解聚,是蛋白质影响淀粉糊化的重要途径。本研究结果为控制稻米的陈化劣变和产后减损提供了有益思路。
