红枣多糖的抗氧化活性及体外模拟消化和酵解研究
2022-06-23白冰瑶付超黄茂汐吴格格张春兰
白冰瑶 ,付超,黄茂汐,吴格格,张春兰*
(1塔里木大学食品科学与工程学院,新疆 阿拉尔 843300)
(2南疆特色农产品深加工兵团重点实验室,新疆 阿拉尔 843300)
红枣(Ziziphus jujuba Mill.),又称中华大枣,属李科枣属植物,为枣树的成熟果实[1]。我国新疆、河北、山东、山西等地广泛种植红枣。由于新疆独特的地理气候条件,其不同区域内枣类各有特色而被称赞,新疆红枣产量接近我国红枣产量的1/2,灰枣和骏枣栽培面积占95%以上[2],且主要产区分布于新疆南疆阿克苏、喀什、和田、巴州等地区。红枣中含有人体所必需的18种氨基酸,富含蛋白质、糖类、胡萝卜素、钙、磷、铁和环磷酸腺苷等营养成分[3],它的维生素含量是苹果、桃子的100倍,有“天然维生素丸”的美称[4-5]。
多糖是一种复合型杂多糖,现代药理学研究表明多糖是红枣中主要的功能活性成分之一[6],具有抗氧化、降血脂、降血糖、提高免疫力、抗肿瘤、调节肠道菌群等功效[7-9],也有研究表明肠道菌群与多糖调控机体免疫功能机制、降血糖机制、抗炎机制密切相关[10-12]。红枣营养丰富,深受大众喜爱,但不同产区的红枣受气候、降水、湿度、土壤等条件的影响,导致红枣存在品质上的差异。目前,新疆红枣的研究主要集中在营养成分比较、不同部位或同一地区不同品种等方面,刘丹[13]研究了南疆不同品种红枣环磷酸腺苷的差异性,王成等[14]、马莎等[15]分别比较了新疆主要生产产地红枣的氨基酸组成,杨璐等[16]分析了新疆红枣不同部位的总酚含量,王萍等[17]对南疆4个红枣品种的常规物理特性和化学特性进行比较研究,刘杰超等[18]对新疆不同产地的红枣营养成分进行比较分析,李蕊蕊等[19]对阿拉尔产区不同红枣品种的黄酮、多酚含量差异性进行了比较,段景峰等[20]研究了阿拉尔地区五个红枣品种多糖抗氧化活性,而关于新疆主要红枣产区的红枣多糖的抗氧化性比较目前未见报道。此外,关于红枣多糖的体外消化吸收、酵解情况的研究较少,但有研究发现肠道微生物可影响机体的健康,对清除自由基、免疫调控、抗抑郁等有一定的影响,因此有必要探究红枣多糖在模拟肠道中的变化情况。
体外模拟消化,即在体外模拟与体内唾液、胃液和肠液相似的消化环境,来观察食物内多糖等大分子的消化与吸收。近些年来,利用体外模拟消化模型来研究糖类等大分子的吸收消化途径成为了热点。食物进入体内,经过复杂的胃肠道消化,营养物质被人体消化吸收,但想要对人体进行体内营养研究,对技术手段有很高的要求,研究过程有一定的局限性,利用动物的胃肠道这一过程的研究实验不但周期长,实验成本高,更不能实时监测动物肠道内的变化,所以体外模拟消化应运而生,体外研究方法具有更快速方便,准确性高,重现性好且容易控制等优势[21]。在体外酵解培养中,酵解液的pH会发生变化,由此可以充分地了解肠道内的微生物生长情况,在多糖的酵解过程中,多糖会分解为葡萄糖、半乳糖等单糖,肠道菌群代谢多糖并产生短链脂肪酸,这些短链脂肪酸对肠道健康发挥重要作用[22]。
本研究中使用碱液浸提红枣多糖,研究了新疆6个不同区域红枣多糖的理化性质、体外抗氧化活性、抗酶活性,并作出综合评价,筛选出一种红枣进行后续的体外模拟消化、酵解实验,通过模拟肠道消化系统,探讨红枣多糖在该体系中的消化、酵解情况。本试验有利于提高对红枣营养价值的认识,为红枣精深加工工业进一步发展提供方向及思路,提升了红枣的附加价值。
1 材料与方法
1.1 试验材料与仪器设备
于2020年11月,前往新疆南疆克州、喀什、和田、若羌、阿克苏以及东疆哈密地区收集红枣,选择果形饱满、个头均匀、无霉烂、无病果,规格质量较好的红枣,每种红枣收集3 kg,鉴定品种为克州酸枣、喀什骏枣、和田骏枣、若羌灰枣、阿克苏骏枣、哈密大枣。
氢氧化钠、无水乙醇、三氯甲烷、正丁醇、苯酚、浓硫酸、氯化钠等试剂购于天津市致远化学试剂有限公司;胃蛋白酶、胰酶、脂肪酶、猪胆盐、葡萄糖等购于上海源叶生物科技有限公司;考马斯亮蓝G-250、总抗氧化能力(T-AOC)试剂盒、透析袋等购于北京索莱宝科技有限公司。
UV-5500PC紫外分光光度计(上海元析仪器有限公司);SYNERGY H1酶标仪(美国博腾仪器有限公司);LC-20A型液相色谱、RID20A型检测器和PDA检测器(日本岛津产品);LDZX-75KBS立式压力蒸汽灭菌器(上海申安医疗器械厂);HPX-9162MBE电热恒温培养箱(上海博迅实业有限公司医疗设备厂);XS-04多功能粉碎机(上海兆申科技有限公司);TGL-20B高速台式离心机(上海安亭科学仪器厂)。
1.2 试验方法
1.2.1 红枣多糖提取
新疆6个产区的红枣,手工去核,切成薄片,于烘箱内60℃烘干至恒重,多功能粉碎机处理,过80目筛,盛于棕色试剂瓶中备用。
取10.00 g样品粉末,以1:10的比例加入0.1 mmol/L的NaOH溶液,混匀,室温震荡1 h后,4 000 r/min离心10 min,取上清液,沉淀进行二次提取,上清液合并,中和至pH为7后进行浓缩,得到多糖提取液,sevage试剂脱蛋白,4倍体积95%的乙醇醇沉过夜,4 000 r/min离心10 min,沉淀依次加入少量无水乙醇、丙酮、石油醚洗涤,并将最后的沉淀用少量去离子水复溶,使用透析袋(3 500 D)进行透析,真空冻干48 h后,得红枣多糖[23]。
1.2.2 多糖的得率计算

式(1)中,M0为冻干后红枣多糖质量,g;M1为称取的红枣预处理粉质量,g。
1.2.3 多糖理化指标测定
采用苯酚-硫酸法测定红枣多糖的含量[24],拟合得到线性回归方程为y=0.916x-0.030 3(r2=0.997 8),用于总糖含量计算。采用考马斯亮蓝法测定蛋白质含量,拟合得到线性回归方程为y=0.007 5x+0.018 4(r2=0.998 5)。参照张群[24]的方法测定糖醛酸含量、硫酸根含量,拟合得到线性回归方程分别为y=0.005x+0.18(r2=0.991 8)、y=0.017 8x+0.218 3(r2=0.991 0)。
1.2.4 抗氧化活性测定
1.2.4.1 总抗氧化能力T-AOC测定
使用索莱宝公司总抗氧化能力测定试剂盒进行测定。经过拟合得到线性回归方程为y=5.200 9x+0.045 6,相关系数r2=0.999 3。
1.2.4.2 DPPH自由基清除率测定
称取适量DPPH用无水乙醇溶解,配制成浓度为2×10-4mol/L的溶液,在试管中分别加入2 mL DPPH溶液和 2 mL 不同浓度(1.000 0 μg/mL、0.500 0 μg/mL、0.250 0 μg/mL、0.125 0 μg/mL、0.062 5 μg/mL)多糖去离子水溶液,涡旋混匀,避光静置30 min,于517 nm下测定吸光度值,去离子水为空白对照组[24]。清除率按下式计算:

式(2)中,A0为空白组吸光度值;A1为试样组吸光度值
1.2.4.3 羟基自由基(·OH)清除率测定
取3.0 mL不同浓度(1.000 0 mg/mL、0.500 0 mg/mL、0.250 0 mg/mL、0.125 0 mg/mL、0.062 5 mg/mL)的多糖去离子水溶液,分别添加3.0 mL抗坏血酸溶液,0.5 mL FeSO4溶液(25 mmol/L),1.0 mL水杨酸钠-乙醇溶液(2 mmol/L)及同体积H2O2(6 mmol/L),涡旋混匀,37℃放置1 h,于510 nm测定吸光度值,空白组为去离子水,干扰组将H2O2用同体积的去离子水替代[25]。多糖清除率计算公式如下:

式(3)中,A0为空白组吸光度值;A1为试样组吸光度值;A2为干扰组吸光度值
1.2.4.4 超氧阴离子清除率的测定
取不同浓度(1.000 0 mg/mL、0.500 0 mg/mL、0.250 0 mg/mL、0.125 0 mg/mL、0.062 5 mg/mL)的多糖去离子水溶液各0.1 mL,添加Tris缓冲溶液后涡旋仪上混匀,水浴保温后立即吸取0.2 mL邻苯三酚溶液进行反应,摇晃5 min,随后吸取3.0%抗坏血酸0.2 mL并摇匀,此时反应停止,于420 nm测定吸光度值。去离子水作空白组,干扰组将邻苯三酚用去离子水替代[25],按下式计算:

式(4)中,A0为空白组吸光度值;A1为试样组吸光度值;A2:干扰组吸光度值
1.2.5 多糖抑制α-淀粉酶活性能力的测定
配制0.02 mol/L的磷酸盐缓冲液,用0.006 mol/L NaCI将pH 调至 6.9。将 500 μL 不同浓度(1.000 0 mg/mL、0.5000mg/mL、0.2500mg/mL、0.1250mg/mL、0.062 5 mg/mL)的多糖去离子水溶液吸取到不同试管中,继而添加等体积α-淀粉酶溶液(0.5 mg/mL),10 min后,加入500 μL可溶性淀粉溶液(1%)开始反应,10 min后立即加入1 mL DNS溶液终止反应,在100℃中加热5 min后,冷却,各管添加蒸馏水至15 mL,于540 nm测定吸光度值,干扰组用等体积的去离子水代替a-淀粉酶溶液,按上述操作测得A2,空白组用去离子水代替样品,阿卡波糖作为阳性对照[26],抑制率按下式计算:
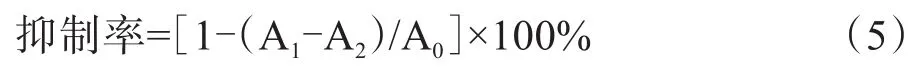
式(5)中,A0为空白组吸光度值;A1为试样组吸光度值;A2为干扰组吸光度值
1.2.6 喀什骏枣多糖体外模拟消化
1.2.6.1 口腔模拟消化
唾液的采集参考文献[27]并适当修改,向1名健康的志愿者采集新鲜澄清的唾液样品,确保其在近三个月内未服用抗生素类药物且无慢性疾病。初始唾液弃掉,将收集到的唾液以4 000 r/min离心15 min去除细胞,收集上清液,置于-20℃下保存备用。将红枣多糖配制成2 mg/mL溶液,取若干试管,A管加入2 mL唾液和2 mL多糖溶液,B管加入2 mL唾液和2 mL蒸馏水,C管加入2 mL多糖溶液和2 mL蒸馏水,置于37 ℃,120 r/min摇床内反应,在0 h,2 h,4 h取样,沸水浴5 min,准备后续指标的测定,各组试验重复3次。消化产物进行分子量、还原糖含量的测定。
1.2.6.2 胃肠道模拟消化
按照参考文献的要求配制胃液、肠液[28]。称取20 mg红枣多糖,加10 mL胃液,放在37℃,120 r/min摇床内反应,在0 h、2 h、4 h、6 h分别取样1 mL,沸水浴5 min。消化6 h后用NaHCO3调至pH为7,加肠液1.8 mL,混合均匀,继续37℃,120 r/min摇床内反应,在0 h、2 h、4 h、6 h分别取样1 mL,沸水浴5 min。同时设立空白对照组,只加胃液、肠液,不加红枣多糖,每次试验做3个平行。消化产物进行分子量、还原糖含量的测定。
1.2.6.3 消化产物分子量测定
取离心过后的唾液、胃液、肠液上清液和经唾液、胃液、肠液上清液消化0 h、4 h之后的样品于试管中,过0.22 μm的水系滤膜。通过高效液相色谱仪测定,分析条件:色谱柱为Waters UltrahydrogelTM500(7.8*300 mm),检测器为示差折光检测器,柱温与检测器的温度均为35℃,流动相为去离子水,流速为0.6 mL/min,进样量为20 μL。
1.2.6.4 消化产物还原糖含量测定
采用3,5-二硝基水杨酸(DNS)比色法[29]测定消化产物中还原糖的含量。DNS溶液需提前制备,一周后使用。
1.2.7 喀什骏枣多糖体外发酵
1.2.7.1 制备人体肠道菌群
征集3名健康志愿者的粪便,制备过滤液,收集备用。
1.2.7.2 体外发酵红枣多糖
设置两个实验组,在超净工作台中进行。多糖组:在发酵管中,将1 mL的多糖溶液(20 mg/mL)与9 mL人体肠道菌群培养液混合,在漩涡振荡器上涡旋均匀;空白组:将1 mL去离子水与9 mL人体肠道菌群培养液混合,在漩涡振荡器上涡旋均匀,之后将全部的密闭厌氧发酵管置于37℃恒温发酵培养箱中培养发酵,并且在培养0 h、1 h、2 h、6 h、12 h、24 h、48 h后,依次取出厌氧发酵管,停止多糖发酵。每个时间点做3次平行[30]。
1.2.7.3 测定酵解产物的pH
发酵结束后,将培养0 h、1 h、2 h、6 h、12 h、24 h、48 h时间点取出的多糖组和空白组酵解产物进行离心(8 000 r/min,15 min),之后将全部的上清液转移到10 mL的EP管中,每组每个时间点平行测定3次。
1.2.7.4 测定酵解产物中的总糖和还原糖含量
取出离心酵解上清液,将其稀释15倍,参考1.2.3中苯酚-硫酸法测定酵解产物中的总糖含量;参考1.2.6.4中的DNS比色法测定酵解产物中还原糖的含量。
1.2.7.5 测定酵解产物中的葡萄糖含量的变化
将模拟消化后不同阶段的多糖提取上清液稀释10倍,过0.22 μm的滤膜备用。液相色谱的分析条件:检测器为示差检测器;柱温为30℃;进样量为10 μL;流动相为0.005 mol/L H2SO4-H2O;流速为0.5 mL/min。
1.3 统计学分析
使用SPSS 25.0软件和originpro 2019b软件进行数据处理和作图,数据以(±SD)表示,P<0.05表示差异显著具有统计学意义。
2 结果与讨论
2.1 多糖得率结果分析
由图1可知,克州酸枣和阿克苏骏枣多糖得率明显较高,分别达6.81%、6.73%,喀什骏枣、若羌灰枣、哈密大枣的多糖提取率无显著性差异,而和田骏枣多糖最低,为5.28%,与李霄等[31]测定的红枣多糖得率6.27%~6.99%相比具有一定的差异,这种差别可能与多糖的提取工艺条件有关。

图1 不同产区红枣多糖得率
2.2 理化指标测定结果分析
通过碱提醇沉法提取制备红枣多糖,理化指标结果如表1所示,来自6个不同产区的红枣多糖总糖含量各不相同,整体总糖含量水平较高,阿克苏骏枣多糖总糖含量高达72.62%,其次是喀什骏枣多糖,达67.25%,最低的是克州酸枣多糖,为55.79%,与段景峰等[20]测定的红枣多糖含量33.90%~53.87%相比存在一定的差异性,可能受脱蛋白、去除小分子等去杂质过程的影响;6个产区红枣多糖中蛋白质最低为2.88%,最高为6.73%,与王向红等[32]测定的蛋白质含量4.04%~6.84%范围内相比有一定差异性,可能与红枣多糖的结构有关系;喀什骏枣多糖糖醛酸含量最高,为9.24%,其次克州酸枣,为8.34%,若羌灰枣多糖最低,为6.03%,不同产区红枣多糖中糖醛酸含量具有显著性差异(P<0.05);克州酸枣多糖硫酸根含量最高,占比34.92%,其次是喀什骏枣,达32.26%,其余较低,样品之间具有显著性差异(P<0.05)。

表1 不同产区红枣多糖的理化指标 %
2.3 不同产区红枣多糖抗氧化活性的比较
2.3.1 总抗氧化能力的测定结果分析
图2为利用T-AOC试剂盒测定6个产区多糖的总抗氧化能力,T-AOC试剂盒测定原理是在酸性环境下,还原Fe3+-三吡啶三吖嗪(Fe3+-TPTZ)产生蓝色的Fe2+-TPTZ的能力反映了总抗氧化能力。结果显示,6个产区红枣多糖的总抗氧化能力大小顺序为:喀什骏枣>克州酸枣>阿克苏骏枣>若羌灰枣>和田骏枣>哈密大枣,即南疆红枣多糖的抗氧化性普遍大于东疆红枣多糖的抗氧化性,也有相关文献表明多糖的抗氧化性大小与红枣多糖的分子量及理化特性组成比例等也有一定的关系[4]。
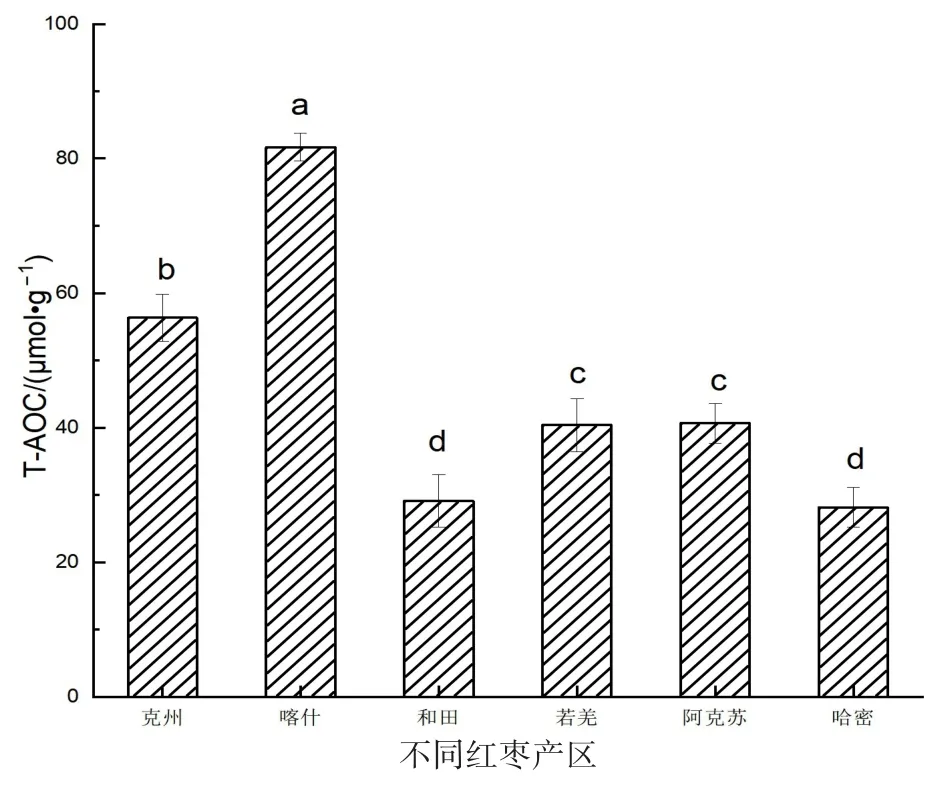
图2 不同产区红枣多糖总抗氧化能力
2.3.2 不同产区红枣多糖对DPPH自由基的清除效果
图 3(a-1)与图 3(a-2)表示在 0.062 5~1.000 0 mg/mL时,6个产区红枣多糖和Vc对DPPH自由基清除能力和对应的IC50值(半抑制质量浓度值),结果表明,随着多糖浓度升高清除能力增加的趋势,其中喀什骏枣的DPPH自由基清除能力最强,IC50值为1.433,在1.000 0 mg/mL浓度时清除率达到47.23%,但其清除能力仍低于Vc;超氧阴离子是一种较弱的氧化剂,但它可能与羟基分子进行结合从而破坏DNA和其他生物分子物质,对其进行研究很有必要。
2.3.3 不同产区红枣多糖对羟基自由基的清除效果
图3(b-1)与图3(b-2)表示在0.0625~1.0000mg/mL时,分析6个产区红枣多糖和Vc对羟基自由基清除能力和对应的IC50值,结果表明,清除效果与多糖浓度呈正相关,且不同的产区和多糖浓度的改变对羟基自由基清除率能力影响较大,在0.062 5~1.000 0 mg/mL范围内,喀什骏枣多糖对羟基自由基的清除率为20.63%~77.56%,增加了275.96%,在0.062 5 mg/mL浓度时,喀什骏枣多糖的清除能力高于哈密大枣多糖的清除能力,而其他浓度下,哈密大枣多糖大于喀什骏枣多糖的清除能力,哈密大枣多糖的IC50(0.278 mg/mL)低于喀什骏枣多糖的IC50值(0.423 mg/mL),可能因地理环境差异、多糖结构差别等因素而存在较大的差异性。
2.3.4 不同产区红枣多糖对超氧阴离子自由基的清除效果
图3(c-1)与图3(c-2)表示6个产区对超氧阴离子自由基的清除能力,结果显示,清除能力大小为:喀什骏枣(IC50=49.000 mg/mL)>阿克苏骏枣(IC50=89.634 mg/mL)>克州酸枣(IC50=370.398 mg/mL)>若羌灰枣(IC50=431.435 mg/mL)>哈密大枣(IC50=444.293 mg/mL)>和田骏枣(IC50=621.453 mg/mL),而若羌、哈密、和田3个产区多糖的清除能力相差不大。以上结果表明红枣多糖具有抗氧化性,不同产区的红枣多糖的抗氧化存在一定的差异性,对红枣的功能开发和利用具有促进作用,其中,喀什骏枣多糖的抗氧化能力在T-AOC、DPPH自由基清除能力、超氧阴离子清除能力方面较强,因此,选择喀什骏枣进行后续的体外模拟胃肠道消化研究。

图3 不同产区红枣多糖对自由基的清除能力和对应的IC50值
2.4 不同产区红枣多糖抑制α-淀粉酶活性能力的测定结果
图4表示6个产区的红枣多糖对α-淀粉酶活性的抑制效果。结果表明,随着红枣多糖浓度升高,对α-淀粉酶活性的抑制作用也不断上升,且不同产区提取多糖的抑制率不同,整体呈现上升趋势。其中,和田骏枣多糖具有较强的抑制α-淀粉酶活性,在浓度为0.250 0 mg/mL浓度时对α-淀粉酶活性的抑制率可达23.04%,高于若羌灰枣、阿克苏骏枣、克州酸枣多糖对α-淀粉酶活性的最大抑制率,6个产区对α-淀粉酶活性的IC50值分别为10.089 mg/mL(和田骏枣)、16.087 mg/mL(喀什骏枣)、23.742 mg/mL(哈密大枣)、30.106 mg/mL(若羌灰枣)、57.639 mg/mL(阿克苏骏枣)、66.263 mg/mL(克州酸枣)。

图4 不同产区红枣多糖对α-淀粉酶的抑制效果和对应的IC50值
2.5 体外消化结果分析
2.5.1 多糖消化产物的分子量及含糖量变化
表2为多糖在唾液、胃液、肠液消化后产物分子量和还原糖的测定结果。结果表明,红枣多糖的分子量在唾液里消化开始至消化4 h时,分子量的大小无显著性差异,红枣多糖的分子量在模拟胃液里和在模拟肠液里消化开始至消化6 h时,分子量无显著性差异,说明红枣多糖在唾液、模拟胃液与模拟肠液中经过消化分子量无显著性变化。红枣多糖进行唾液消化时,还原糖含量无显著性变化,在进行模拟胃液消化时,还原糖含量显著性增加(P<0.05),进行模拟肠液消化是在红枣粗多糖进行6 h的模拟胃液消化的基础上进行的,还原糖含量平稳增加(P>0.05)。由此可得出:多糖的分子量不会在唾液、胃液、肠液消化过程中发生显著性变化,多糖中还原糖含量在唾液、肠液中未发现显著性变化,在模拟胃液中还原糖含量呈现显著增加的趋势。

表2 红枣多糖消化产物分子量和还原糖含量
2.6 体外发酵结果分析
2.6.1 酵解产物pH变化
图5表示多糖组和空白组酵解7个时间点的pH值的变化,红枣多糖在酵解过程中,pH整体呈下降趋势,其中0~2 h有显著性变化,2~48 h无显著性变化,多糖组的pH从6.43下降到5.52,空白组的pH整体是高于多糖组的,只是在酵解时间0~2 h内略微降低,在酵解时间2~48 h内,空白组pH几乎保持平衡,且没有显著性变化。研究表明,多糖可以提供一定的H+,多糖在酵解过程中可以被肠道里的菌群继续利用,发生了结构的变化,生成短链脂肪酸(SCFA),使得pH降低[33]。

图5 多糖酵解溶液和空白组pH值
2.6.2 酵解产物中还原糖和总糖含量变化
如表3所示,酵解初始时,还原糖的含量为(0.379±0.016)mg/mL,总糖的含量为(1.750±0.069)mg/mL。体外酵解1 h之后,还原糖的含量增加到了(0.401±0.019)mg/mL,而总糖浓度下降到了(1.607±0.070)mg/mL。在酵解12~48 h之间,总糖含量下降且显著性明显。由此可知,在体外酵解的0~48 h过程中,还原糖的含量变化趋势是先增加后降低,而总糖含量变化趋势是一直下降的。

表3 多糖体外酵解产物还原糖和总糖含量
2.6.3 酵解产物中葡萄糖含量变化
多糖是由无数单糖以糖苷键连接聚合而成,在酵解过程中,多糖会被分解,游离出单糖。如表4所示,酵解开始时,葡萄糖的浓度为3.45 mg/L,酵解48 h后,葡萄糖的浓度为0.050 mg/L,含量微乎其微,说明葡萄糖被肠道菌群大量消耗利用,导致多糖含量减少。

表4 多糖体外酵解后的葡萄糖含量
3 讨论
唾液是机体进行食物消化第一步的消化液,可消化食物中存在的淀粉。胃液和肠液也是食物消化过程中重要的消化液,多糖在不同消化液中的降解变化趋势受多糖来源和种类的影响。如铁皮石斛多糖在胃液中较弱地被消化(P>0.05),在胃肠液中不能被消化降解[33],大粒车前子多糖的分子量在胃、肠道消化过程中发生了显著性降低[22],桑叶多糖在模拟胃、肠道中不能被分解,分子量也无显著性变化[34]。本研究中,红枣多糖在唾液消化过程中,分子量大小和还原糖含量无变化(P>0.05),说明红枣多糖未分解,在模拟胃液消化过程中,分子量未发生变化,还原糖含量增加。
发酵过程中pH值的变化是一个重要考察指标,pH值影响肠道菌群和SCFA的生成,较弱的pH可能更有助于SCFA中丁酸及产丁酸菌的生长。本实验中发现,酵解过程中随着酵解时间的增加,多糖组的pH整体呈显著性下降趋势,与DING Q等[35]结果较相似,是因为此间有大量微生物增殖并产生了大量的H+。酵解产物中还原糖的含量在酵解0~48 h之间,还原糖含量是先增加再减少,可能是因为多糖的糖苷键在酵解过程中被破坏,产生部分单糖和还原糖,它们处于酵解阶段继续被消化,导致酵解过程中还原糖含量降低,多糖能够被肠道微生物分解利用,因此酵解过程中总糖的含量、葡萄糖含量一直在减少,本研究与HU J L[36]等研究的关于膳食纤维在模拟酵解阶段的结果一致。
4 结论
综上所述,新疆6个产区的红枣多糖对各体系自由基清除率随多糖浓度升高而增强,具有一定的抗氧化活性,但不同产区红枣多糖抗氧化活性存在一定的差异性,其中,喀什骏枣多糖在DPPH和超氧阴离子清除率方面的抗氧化能力较强。以喀什骏枣多糖为研究对象,研究红枣多糖的体外模拟消化、发酵情况,发现红枣多糖在消化过程中不能被消化,在体外模拟酵解过程中,能够被肠道微生物分解利用,从而提高肠道的益生功能。本研究为红枣的种植、深加工发展提供了一定理论依据,但基于多组学研究红枣多糖的体外酵解动态和机制仍有待深入分析。
