芍药苷通过抑制Notch-1 信号通路影响肝癌细胞增殖、侵袭和凋亡的机制研究
2022-06-23谢齐贵陈湛蕾
夏 亮 谢齐贵 陈湛蕾
肝癌是最常发生的恶性肿瘤之一[1]。尽管肝癌的治疗手段不断发展,包括手术切除、移植、消融、经动脉化学栓塞等,但疗效仍不令人满意[2]。芍药苷是从白芍根中分离出来的一种生物活性成分,具有免疫调节、降血糖和降压等作用[3-4]。已有研究发现,芍药苷在多种人类癌症中具有抗肿瘤功能,例如肺癌、乳腺癌、肝癌等[5-7]。然而,芍药苷介导的抗肝肿瘤机制尚未完全明确。因此,本研究拟利用肝癌HepG2 细胞系,研究芍药苷对肝癌细胞增殖、侵袭、凋亡的影响及其潜在机制,报道如下。
1 实验材料
1.1 材料 人肝癌细胞HepG2(上海富衡生物科技有限公司,货号FH0076)。
1.2 药物及试剂 芍药苷(麦克林,批号C10081578);DMEM 培养基(美国Gibco 公司,批号11965092);EDTA-胰蛋白酶消化液(美国Gibco 公司,批号25200072);胎牛血清(美国Gibco 公司,批号12483020)、磷酸盐缓冲盐水(PBS)(碧云天生物技术研究所,批号C0221A);青霉素-链霉素溶液(美国Gibco 公司,批号15070063);CCK-8 试剂盒(日本Dojindo 公司,批号CK-04);transwell 小室(美国Corning 公司,批号3422);基质胶(美国BD 公司,批号P0873K);TRIzol 试剂(美国Invitrogen 公司,批号IK5013);PrimeScriptRT 试剂盒、SYBRPremix Ex Taq 试剂盒(日本Takara 公司,批号RR047A、RR0584);膜联蛋白V/碘化丙锭(Annexin-V/PI)凋亡试剂盒(美国BD 公司,批号6301518);RIPA 裂解液、磷酸酶抑制剂、封闭液、一抗稀释液、二抗稀释液、ECL 发光显影液、BCA 蛋白浓度测定试剂盒(碧云天生物技术研究所,批号P0013B、ST019、P0252、P0256、P0258、P0018FS、P0012S);兔抗人Notch-1 单克隆抗体、鼠抗人Hes-1 单克隆抗体、鼠抗人β-肌动蛋白(英国Abcam 公司,批号ab52627、ab119776、ab8226)。
1.3 仪器 FACS Calibur 流式细胞仪(美国BD公司);ELx800 酶标仪(美国BioTek Instuments 公司);奥林巴斯AI09 倒置光学显微镜(日本奥林巴斯公司);Pierce ECL 系统(美国通用公司)。
2 实验方法
2.1 细胞培养及分组 使用含10%的胎牛血清、1%双抗的DMEM 培养基培养人肝癌细胞HepG2,并将其置入37 ℃、5%CO2的增湿培养箱中培养。待细胞融合度达到80%~90%时传代以备后续实验使用。将HepG2 细胞分为四组,空白对照组仅使用正常培养液进行培养。根据既往发表相关文献[8-9],确定芍药苷用药浓度范围,设置低、中、高剂量,组细胞培养液中加入芍药苷,分别使其药物浓度为25、50、75 μmol/L。
2.2 CCK-8 实验测定细胞增殖活性 将处于对数生长期的细胞,按照104个/孔的密度接种于96 孔板中,设置3 个重复,放回培养箱继续培养至次日。加入不同浓度芍药苷(0、25、50、75、100、150 μmol/L)培养24 h 后,每孔加入10 μL CCK-8,继续培养3 h,使用酶标仪检测450 nm 波长处的吸光度值(A)。
2.3 Transwell 实验检测细胞侵袭能力 将100 μL细胞悬液以5×103个/孔的密度接种于涂有基质胶的Transwell 上层小室中,在无血清的DMEM 培养基中孵育,下层小室加入600 μL 含有10%血清的DMEM培养基。24 h 后将细胞用甲醇固定15 min,并用2%结晶紫染色。用棉签移除小室膜上未迁移的细胞,使用倒置显微镜拍照,记录跨膜细胞数。
2.4 流式细胞仪检测细胞凋亡率 将处于对数生长期HepG2 细胞以3×104个/孔的密度接种于6 孔板中,按上述分组处理细胞24 h,后消化细胞,并用预冷的PBS 洗涤细胞3 次,以3 000 r/min 离心10 min,留取细胞沉淀,加入500 μL 结合缓冲液后,依次加入5 μL Annexin-V/FITC 染液和10 μL PI 染液,室温避光孵育15 min,立即进行流式细胞仪检测,记录各组凋亡情况。
2.5 Western blot 检测细胞表达蛋白水平 取对数生长期的HepG2 细胞以3×104个/孔的密度接种于6孔板中,次日按上述分组处理细胞24 h,加入RIPA裂解液裂解细胞,冰裂30 min 后,以12 000 g、4 ℃离心30 min 吸取上清,用BCA 法测定蛋白浓度。每组取20 μg 蛋白加入SDS-PAGE 凝胶孔道进行电泳,后转移至PVDF 膜上。使用封闭液室温封闭膜1 h,后使用TBST 洗膜3 次,加入对应一抗,置于4 ℃摇床孵育过夜。次日洗膜3 次,加入对应二抗室温孵育2 h,后用ECL 发光显影液在曝光系统中进行蛋白条带成像。使用ImageJ 软件进行蛋白条带灰度分析。
2.6 统计学方法 应用SPSS 22.0 统计软件统计分析数据。本研究中所有实验均独立重复3 次。符合正态分布的计量资料以均数±标准差()表示。单一处理条件下,组间比较采用单因素方差分析,两组比较使用Student’s t 检验。P<0.05 视为差异具有统计学意义。
3 结果
3.1 芍药苷对HepG2 细胞增殖活性的影响 各组细胞培养24 h 后,与空白对照组细胞比较,随着芍药苷处理浓度增加,细胞增殖活性呈剂量依赖性显著降低(P<0.05),见表1。
表1 各组肝癌HepG2 细胞OD 值、增殖活性比较()
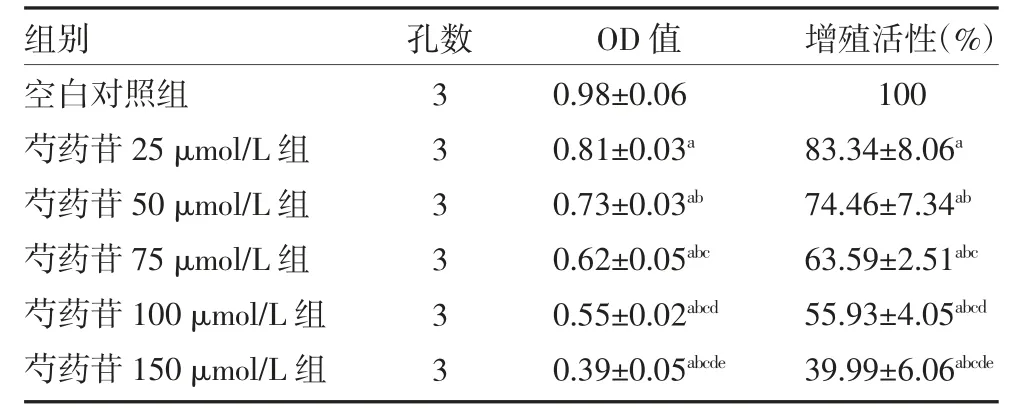
表1 各组肝癌HepG2 细胞OD 值、增殖活性比较()
注:空白对照组给予芍药苷0 μmol/L;芍药苷25 μmol/L 组给予芍药苷25 μmol/L;芍药苷50 μmol/L 组给予芍药苷50 μmol/L;芍药苷75 μmol/L 组给予芍药苷75 μmol/L;芍药苷100 μmol/L 组给予芍药苷100 μmol/L;芍药苷150 μmol/L 组给予芍药苷150 μmol/L;与空白对照组比较,aP<0.05;与芍药苷25 μmol/L 组比较,bP<0.05;与芍药苷50 μmol/L 组比较,cP<0.05;与芍药苷75 μmol/L 组比较,dP<0.05;与芍药苷100 μmol/L 组比较,eP<0.05
3.2 芍药苷对HepG2 细胞增侵袭能力的影响 与空白对照组比较,芍药苷低、中、高剂量组的细胞穿膜数显著减少(P<0.05),且芍药苷低、中、高剂量组抑制细胞侵袭能力呈剂量依赖性(P<0.05),见表2和图1。
表2 各组肝癌HepG2 细胞穿膜数目比较(个,)

表2 各组肝癌HepG2 细胞穿膜数目比较(个,)
注:空白对照组给予芍药苷0 μmol/L;芍药苷低剂量组给予芍药苷25 μmol/L;芍药苷中剂量组给予芍药苷50 μmol/L;芍药苷高剂量组给予芍药苷75 μmol/L;与空白对照组比较,aP<0.05;与芍药苷低剂量组比较,bP<0.05;与芍药苷中剂量组比较,cP<0.05
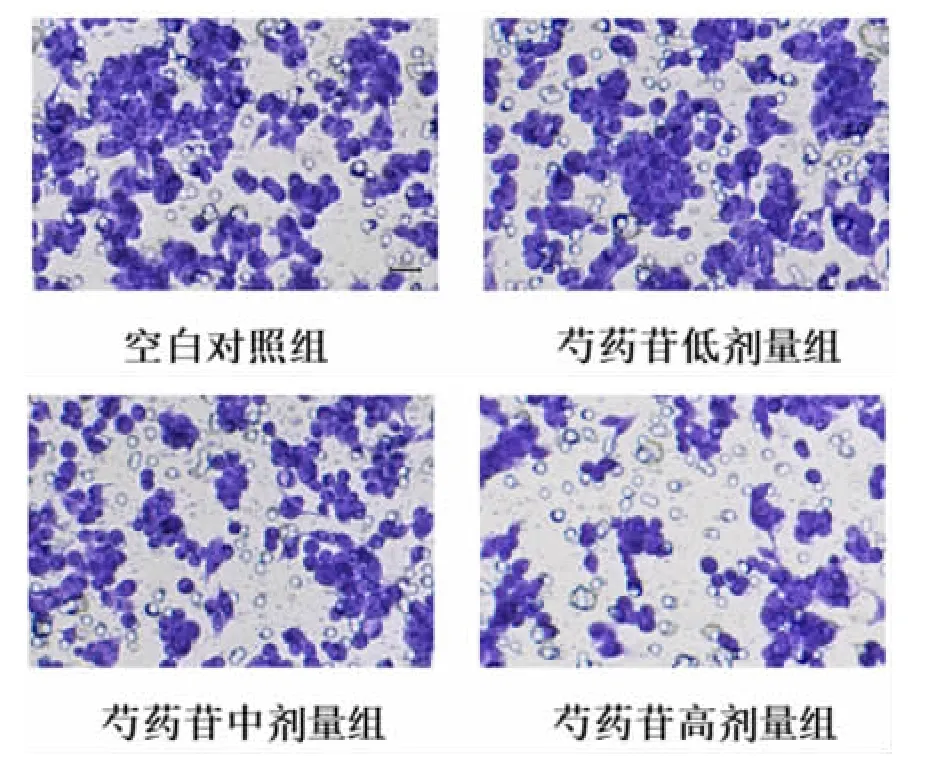
图1 芍药苷对HepG2 细胞增侵袭能力的影响(2%结晶紫染色,×40)
3.3 芍药苷对HepG2 细胞凋亡反应的影响 Annexin-V/PI 双染法结果显示,与空白对照组比较,芍药苷处理组HepG2 细胞凋亡率显著增加(P 均<0.05),且细胞凋亡率随芍药苷的处理浓度增加而升高(P<0.05),见表3。
表3 各组肝癌HepG2 细胞凋亡率比较(%,)

表3 各组肝癌HepG2 细胞凋亡率比较(%,)
注:空白对照组给予芍药苷0 μmol/L;芍药苷低剂量组给予芍药苷25 μmol/L;芍药苷中剂量组给予芍药苷50 μmol/L;芍药苷高剂量组给予芍药苷75 μmol/L;与空白对照组比较,aP<0.05;与芍药苷低剂量组比较,bP<0.05;与芍药苷中剂量组比较,cP<0.05
3.4 芍药苷对HepG2 细胞Notch-1 信号通路的影响 与空白对照组比较,芍药苷处理组Notch-1 及Hes-1 蛋白表达显著降低(P 均<0.05),且随芍药苷处理浓度增加,蛋白表达逐渐降低(P 均<0.05)。
4 讨论
目前,肝癌死亡的主要原因是肿瘤的复发和转移[10]。因此,抑制肝癌细胞侵袭、增殖具有重要意义。化疗药物为抑制肝癌转移的主要治疗手段,但其低特异性导致了众多不良反应和毒副作用[11]。与典型的化疗药物相比,药物植物有望成为更有效的治疗方法[12]。本研究结果表明,芍药苷可呈剂量依赖性降低肝癌细胞增殖活性。此外,在用芍药苷处理HepG2细胞24 h 后,随着芍药苷给药浓度的增加,细胞侵袭性逐渐降低,表明芍药苷成功地抑制了肝癌细胞的侵袭能力。Liu 等[7]发现,芍药苷可抑制HepG2 肝癌细胞的增殖、迁移和侵袭,与本研究结果一致。
表4 各组肝癌HepG2 细胞蛋白表达比较()

表4 各组肝癌HepG2 细胞蛋白表达比较()
注:空白对照组给予芍药苷0 μmol/L;芍药苷低剂量组给予芍药苷25 μmol/L;芍药苷中剂量组给予芍药苷50 μmol/L;芍药苷高剂量组给予芍药苷75 μmol/L;与空白对照组相比,aP<0.05;与芍药苷低剂量组比较,bP<0.05;与芍药苷中剂量组比较,cP<0.05
Notch 信号通路是一种保守的信号转导通路,对细胞发育和凋亡非常重要[13-15]。在哺乳动物的四种Notch 受体中,Notch-1 是主要受体[16]。既往有研究证明,Notch-1 信号通路与肝癌的增殖、侵袭和转移有关[17-18];因此,通过抑制该信号通路的活性有可能抑制肝癌细胞的上述功能。本研究观察了Notch 信号通路在芍药苷抑制肝癌细胞增殖、侵袭,并诱导凋亡中的潜在作用。我们发现,HepG2 细胞暴露于芍药苷24 h 后,参与Notch-1 信号通路的Notch-1 和Hes-1蛋白表达水平呈剂量依赖性显著降低。提示芍药苷可能通过抑制Notch-1 信号通路,从而抑制肝癌细胞的增殖、侵袭,并诱导凋亡。
综上所述,芍药苷显著抑制肝癌细胞HepG2 增殖和侵袭能力,还可诱导细胞发生凋亡,其机制可能与芍药苷抑制Notch-1/Hes-1 信号通路有关。
