P4HA3 基因与结直肠癌进展及不良预后的相关性研究
2022-06-23方帅帅袁马驰
方帅帅 袁马驰
结直肠癌(colorectal cancer,CRC)是全球发病率最高的恶性肿瘤之一,尤其在发达国家中的发病率始终居高不下[1]。在我国,由于缺乏早期检测,50%的CRC 患者确诊时已是中晚期,导致部分患者错失了最佳的根治机会[2]。研究表明,CRC 中的关键基因可作为其诊断、预防和治疗的分子标志物,并且能够揭示CRC 的发病机制[3]。脯氨酰4-羟化酶α-3(prolyl 4-hydroxylase alpha 3,P4HA3)基因在CRC中发挥重要作用,但具体作用机制尚不清楚。本研究运用生物信息学方法探究P4HA3 与CRC 的进展及预后的相关性,并通过免疫组化实验进行验证,旨在探讨P4HA3 基因在CRC 进展及不良预后中的作用,为CRC 治疗提供新的策略。
1 材料与方法
1.1 实验试剂 P4HA3(批号PA5-52483)和山羊抗兔IgG(批号A16116)购于美国Invitrogen 公司;阻断内源性过氧化物酶阻断剂(批号35000)购于美国Thermo Fisher Scientific 公司;石蜡(批号YA0012)、PBS 缓冲液(批号P1022)、抗原修复液(批号C1035)、DAB 显色(批号DA1010)和苏木素(批号H8070)购于北京Solarbio 公司。
1.2 数据来源 从The Cancer Genome Atlas(TCGA)数据库下载CRC 的基因数据和临床数据,含有647例CRC 患者肿瘤组织和51 例癌旁组织(距肿瘤组织5 cm 以上)。
1.3 P4HA3 基因表达数据的获取 应用R 软件BiocManager 及limma 提取P4HA3 表达数据,并提取P4HA3 在CRC 组织及其对应正常结直肠组织中的表达数据[4]。然后,利用R 软件对P4HA3 表达数据及配对数据进行可视化分析[5]。
1.4 P4HA3 基因与临床病理特征预后分析 卡方检验研究P4HA3 的表达与年龄、性别、Stage、T、N 和M 分期等CRC 临床特征的关联。
1.5 P4HA3 基因的生存分析 将P4HA3 基因表达及临床病理数据与患者生存数据整合,利用R 软件的survival 包进行生存分析,获得P4HA3 基因对患者生存状态的影响并作生存曲线进行可视化分析[6]。
1.6 P4HA3 基因表达与生存分析的验证 利用基因表达谱交互分析(gene expression profile interaction,GEPIA)数据库(http://gepia.cancer-pku.cn/index.html)对P4HA3 基因进行表达与生存分析。
1.7 P4HA3 基因的单基因富集分析 利用Perl 软件整理所需的P4HA3 基因表达数据集及表型数据,并采用基因集富集分析(gene set enrichment analysis,GSEA)软件(http://software.broad-institute.org/gsea)对P4HA3 基因进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.8 免疫组化分析 收集2020 年6 月至2021 年6月杭州市第三人民医院病理科30 例CRC 患者手术切除肿瘤和癌旁组织蜡块样本进行回顾性分析,本研究经医院伦理委员会审核通过(伦理批号:2021KA040)。手工染色检测CRC 和癌旁组织中P4HA3 蛋白表达。经石蜡切片脱蜡水化、抗原修复、滴加阻断内源性过氧化物酶阻断剂、一抗P4HA3(1∶100)室温反应60 min、复温和二抗山羊抗兔IgG 室温反应20 min,最后DAB 显色、苏木素复染、脱水封片和显微镜观察。
2 结果
2.1 P4HA3 基因在CRC 中的表达 本文基于TCGA-CRC 数据对P4HA3 在CRC 中的表达进行分析发现,与51 例癌旁组织相比,P4HA3 在647 例CRC 组织中高表达(P<0.01,见图1A)。其中,50 例的癌旁组织和肿瘤组织样本为配对样本。进一步对P4HA3 基因在配对的CRC 肿瘤组织及癌旁组织中的表达进行分析,结果显示,P4HA3 在CRC 组织高表达(P<0.01,见图1B)。
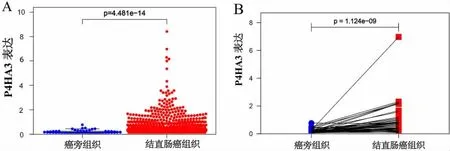
图1 P4HA3 基因在结直肠癌中的表达
2.2 P4HA3 基因与临床病理相关性分析 去除临床数据不完整和生存时间小于30 d 的样本数据,剩余538 个CRC 组织样本,按P4HA3 在CRC 中表达中位数(0.47)分为高表达组和低表达组。不同临床特征与P4HA3 表达的关系见表1,结果显示,P4HA3表达与CRC 患者Stage 分期(χ2=9.970,P<0.05)、T 分期(χ2=10.040,P<0.05)和N 分期(χ2=15.270,P<0.05)具有相关性,但与CRC 患者年龄、性别和M 分期无关(P>0.05)。
2.3 P4HA3 基因生存分析 对P4HA3 基因进行生存分析,结果显示与P4HA3 低表达的CRC 患者相比,P4HA3 高表达的患者生存时间明显缩短(见图2),P4HA3 高表达与CRC 患者的不良预后相关(P<0.05)。
2.4 P4HA3 基因的GEPIA 数据库验证 利用GEPIA 数据库检验P4HA3 基因在CRC 中的作用。与癌旁组织相比,P4HA3 基因在CRC 样本中高表达(见图3A)。P4HA3 基因与Stage 分期呈正相关(见图3B),并且P4HA3 与CRC 患者不良预后相关(P<0.05,见图3C、D),与TCGA 数据库分析结果一致。
2.5 P4HA3 基因的KEGG 通路富集分析 利用GSEA 对P4HA3 进行KEGG 通路富集分析,结果见表2(FDR<0.05),P4HA3 基因主要富集到MAPK 信号通路、TGF-β 信号通路、WNT 信号通路、TOLL 样受体信号通路、NOD 样受体信号通路、JAK-STAT 信号通路和VEGF 信号通路等,且这些信号通路与多种恶性肿瘤的发生发展有关。
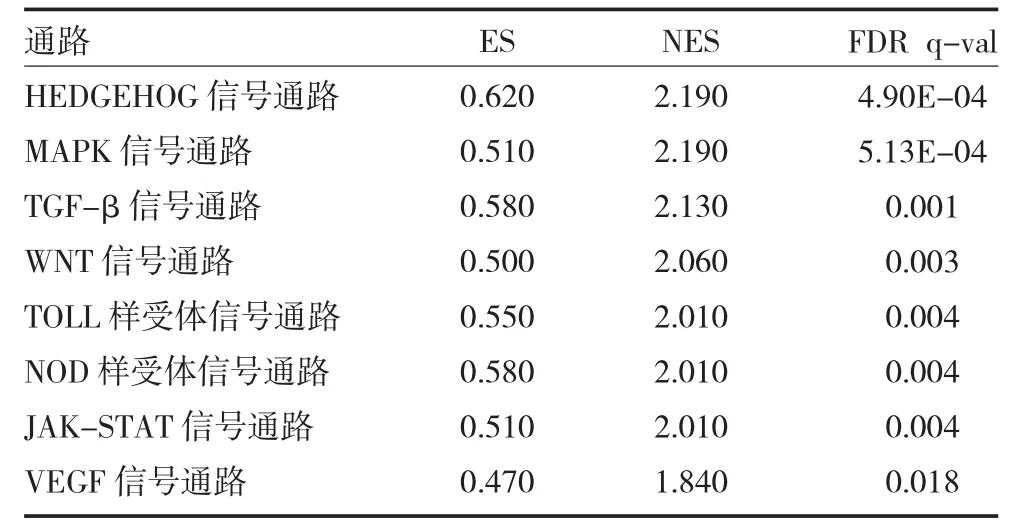
表2 P4HA3 基因的KEGG 通路富集分析部分结果
2.6 P4HA3 基因的临床验证 本研究通过免疫组化对P4HA3 基因在CRC 组织中的表达进行临床验证。免疫组化结果显示,癌旁组织颜色较淡或几乎无染色;而CRC 肿瘤组织均大量分布且呈现黄色或棕褐色染色颗粒。颜色越深,P4HA3 蛋白表达越高。免疫组化典型图片见图4A 和B(分别为癌旁组织和肿瘤组织)。
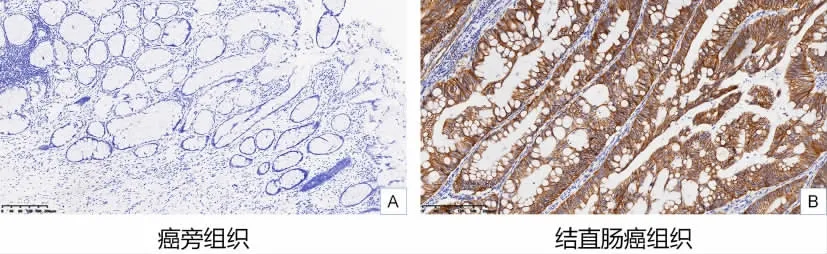
图4 免疫组化检测P4HA3 蛋白(200×)
3 讨论
CRC 是常见的恶性肿瘤之一,其发病率逐年升高[7]。CRC 患者的治疗方式主要有手术、化疗和放疗等,但这些治疗方式对晚期患者疗效有限[8]。研究发现,分子标志物在CRC 患者的预后评估中可发挥关键作用[9],有助于CRC 患者的诊断、预后和治疗[10]。
P4H 是维持胶原稳定性的必需酶,P4H 是一个α2β2 四聚体,其P4HA 是酶的底物结合结构域[11]。P4HA 的异常调节与一系列的病理过程有关,包括肿瘤的发生和发展[12]。P4HA 亚型包含P4HA1、P4HA2和P4HA3,而P4HA3 在正常组织中的表达非常低[13]。近年来,多项研究发现P4HA3 作为多种肿瘤的致癌基因,与肿瘤生长和生存期较差呈正相关[14]。然而,P4HA3 在CRC 中的作用尚未进行研究。因此,探讨P4HA3 基因在CRC 的进展及预后中的作用具有重要意义。
本研究发现,P4HA3 在CRC 肿瘤组织高表达,并且与CRC 患者的Stage、T 和N 分期显著相关,表明P4HA3 参与CRC 的发生发展。本研究通过生存分析发现,高表达P4HA3 的CRC 患者总生存时间明显缩短,这表明P4HA3 与CRC 的不良预后密切相关。KEGG 通路富集分析结果表明,P4HA3 基因主要富集到MAPK 信号通路、TGF-β 信号通路、WNT信号通路和JAK-STAT 信号通路等信号通路上。这些通路与多种恶性肿瘤的发生发展紧密相关,且P4HA3 可能通过激活这些信号通路进而参与调控CRC 进展。同时,有研究显示P4HA3 是一种胶原修饰酶基因,P4HA3 与乳腺癌预后及胃癌细胞转移有关[15-16]。P4HA3 在垂体腺瘤中表达上调,并且会促进垂体腺瘤细胞增殖、迁移和侵袭[17]。这些报道与我们的研究结果P4HA3 基因在CRC 患者中发挥重要作用具有一致性。
此外,本研究还通过免疫组化分析对P4HA3 在CRC 肿瘤组织和癌旁组织中的表达进行回顾性验证,发现P4HA3 在癌旁组织中低表达,而P4HA3 在CRC 组织中高表达。进一步验证了本研究生物信息学分析结果的真实性和准确性,揭示了P4HA3 基因在CRC 的进展及预后中的重要作用。
综上所述,本研究通过生物信息学和免疫组化分析验证了P4HA3 基因与CRC 的进展及不良预后显著相关。深入分析表明P4HA3 基因可作为CRC预后的分子标志物,有望成为CRC 患者新的治疗靶点,P4HA3 基因在CRC 中的作用机制值得深入探究。
