桃叶珊瑚苷对去势大鼠骨质疏松的治疗作用及其机制研究
2022-06-23王朝南苏忠良董晓敏
王朝南 苏忠良 董晓敏
骨质疏松症是由多种原因导致骨密度和骨质量降低,微观结构破坏致使骨脆性增加、强度降低而容易发生骨折的一种全身性骨疾病[1]。中药治疗骨质疏松症具有毒副作用小等多方面优势,越来越受到人们的青睐[2]。研究证实,杜仲具有抗骨质疏松作用,能刺激成骨细胞增殖,增加骨密度,改善骨质流失、骨小梁破坏等症状[3]。桃叶珊瑚苷作为中药杜仲、车前草等有效成分之一,分布广泛,属环烯醚萜苷类,具有多种生物学活性,包括抗炎、护肝解毒、抗氧化、抗骨质疏松等作用[4]。本研究旨在探讨桃叶珊瑚苷防治骨质疏松的作用及可能机制,报道如下。
1 实验材料
1.1 动物 选择Wistar 大鼠48 只,雌性,2 个月龄,体质量(225±25)g,SPF 级,由温州医科大学实验动物中心提供。使用许可证号:SYXK(浙)2005-0061。大鼠自由饮水进食,室温(24±2)℃,相对湿度50%~70%,12 h 昼夜循环灯光。本实验经温州医科大学动物中心伦理委员会理审核通过(wydw2019-0326)。
1.2 主要试剂与仪器 桃叶珊瑚苷(纯度98%,上海源叶生物科技有限公司,批号B21238);戊巴比妥钠(美国Sigma 公司,批号20201011);注射用青霉素钠(华北制药股份有限公司,批号H20013036);碱性磷酸酶(ALP)、骨钙素(BGP)酶联免疫吸附试验(ELISA)检测试剂盒(上海酶联生物科技有限公司,批号分别为ml003415、ml002883);TRIzol 试剂(美国Invitrogen 公司,批号15596018);反转录试剂盒(美国Thermo 公司,批号K1621);双能X 线骨密度仪(美国Hologic 公司,型号:Discovery Wi);实时定量PCR 仪(美国Roche 公司,型号:9600);LEICA RM2235 切片机(德国LEICA 公司,型号:RM2235)。
2 实验方法
2.1 动物分组及造模 取48 只Wistar 大鼠,采用随机数字表法分为桃叶珊瑚苷高、低剂量组,模型组和假手术组,每组12 只。所有大鼠腹腔注射1%戊巴比妥钠30 mg/kg 进行麻醉,其中桃叶珊瑚苷高、低剂量组和模型组雌性大鼠行双侧卵巢切除术,构建骨质疏松模型,另外12 只大鼠,切开腹腔但不切除卵巢作为假手术组,所有大鼠术后连续3 d 肌注青霉素钠,均给予普通饲料,自由饮食。术后第4 周开始各组分别给药,模型组和假手术组腹腔注射生理盐水(20 mL/kg),桃叶珊瑚苷高剂量组(10 mg/kg)、低剂量组(5 mg/kg)腹腔等量给药(20 mL/kg),1 次/d,共给药8 周。
2.2 大鼠血清ALP 和BGP 水平测定 给药8 周后,使用戊巴比妥钠麻醉大鼠,切开腹部,暴露腹主动脉,使用采血管收集腹主动脉血,分离血清,采用ELISA 法检测血清中骨形成因子ALP 和BGP 的含量。
2.3 骨密度检测 给药8 周后,锐刀切取大鼠左侧大腿,剔除软组织,用双能X 线骨密度仪测定四组大鼠左股骨骨密度,重置大鼠股骨并反复测量3 次,取平均值。
2.4 观察HE 染色大鼠骨组织形态表现 将存放在多聚甲醛的大鼠胫骨取出,脱钙7 d 后用石蜡包埋,切成5 μm 厚的切片。对切片进行HE 染色。封闭好的切片在电子显微镜下观察并收集照片。
2.5 骨组织骨保护素(OPG)、细胞核因子κB 受体活化因子配体(RANKL)mRNA 表达测定 给药8 周后,取大鼠右侧股骨,提取总RNA,反转录试剂盒合成cDNA,采用甘油醛-3-磷酸脱氢酶(GAPDH)作为内参照,在实时定量PCR 仪中进行扩增,反应条件:94 ℃5 min;55 ℃30 s;72 ℃4 min,40 个循环。引物由英潍捷基(上海)贸易有限公司提供,各基因的引物序列见表1。
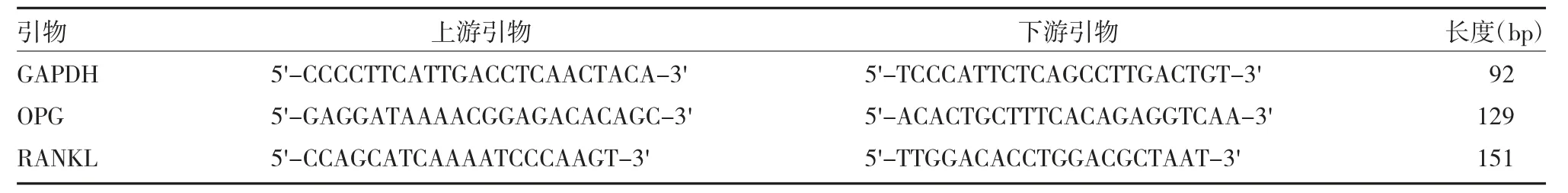
表1 RT-PCR 目的基因引物的序列
2.6 统计学方法 应用SPSS 22.0 统计软件进行统计分析。计量资料均符合正态分布,以均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验。P<0.05 为差异有统计学意义。
3 结果
3.1 桃叶珊瑚苷对大鼠血清骨形成因子水平的影响给药8 周后,与假手术组比较,模型组大鼠血清ALP 与BGP 含量均升高(P 均<0.01);与模型组比较,桃叶珊瑚苷高剂量组血清ALP 与BGP 含量均降低(P 均<0.01),但桃叶珊瑚苷低剂量组降低不明显(P 均>0.05)。见表2。
表2 各组大鼠血清ALP 与BGP 含量比较()
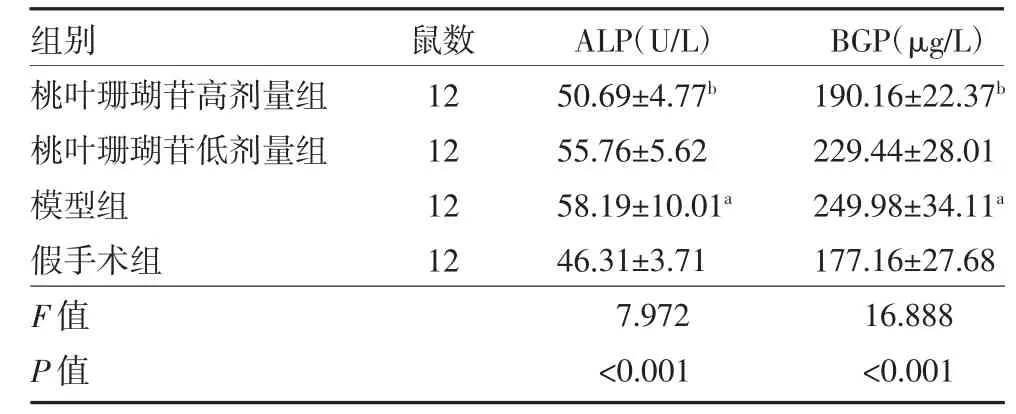
表2 各组大鼠血清ALP 与BGP 含量比较()
注:桃叶珊瑚苷高剂量组为卵巢切除+桃叶珊瑚苷10 mg/kg 腹腔注射;桃叶珊瑚苷低剂量组为卵巢切除+桃叶珊瑚苷5 mg/kg 腹腔注射;模型组为卵巢切除+生理盐水腹腔注射;假手术组为卵巢不切除+生理盐水腹腔注射;ALP 为碱性磷酸酶;BGP 为骨钙素;与假手术组比较,aP<0.01;与模型组比较,bP<0.01
3.2 桃叶珊瑚苷对大鼠骨密度的影响 给药8 周后,与假手术组比较,模型组大鼠骨密度值显著降低(P<0.01),说明切除大鼠卵巢制作骨质疏松模型成功。与模型组比较,桃叶珊瑚苷高、低剂量组大鼠骨密度值显著升高(P<0.01 或P<0.05)。见表3。
表3 各组大鼠股骨骨密度比较(mg/cm2,)
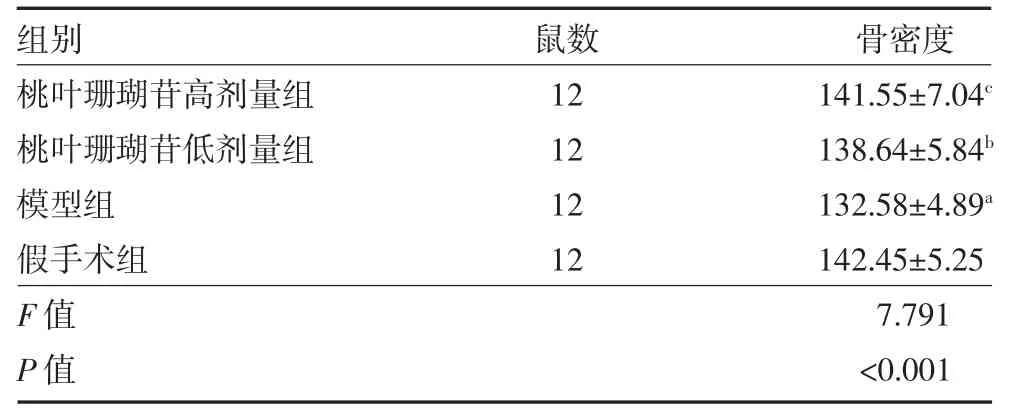
表3 各组大鼠股骨骨密度比较(mg/cm2,)
注:桃叶珊瑚苷高剂量组为卵巢切除+桃叶珊瑚苷10 mg/kg 腹腔注射;桃叶珊瑚苷低剂量组为卵巢切除+桃叶珊瑚苷5 mg/kg 腹腔注射;模型组为卵巢切除+生理盐水腹腔注射;假手术组为卵巢不切除+生理盐水腹腔注射;与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
3.3 桃叶珊瑚苷对大鼠骨组织形态的影响 给药8周后,假手术组股骨骨小梁排列紧密,成骨结构完好,模型组中骨小梁稀疏,少于假手术组,其结构排列不规则,可见连接断裂;桃叶珊瑚苷高剂量组骨小梁结构紧密,连续性较好,相对于高剂量组,低剂量组骨小梁骨偏少、偏稀,见图1。
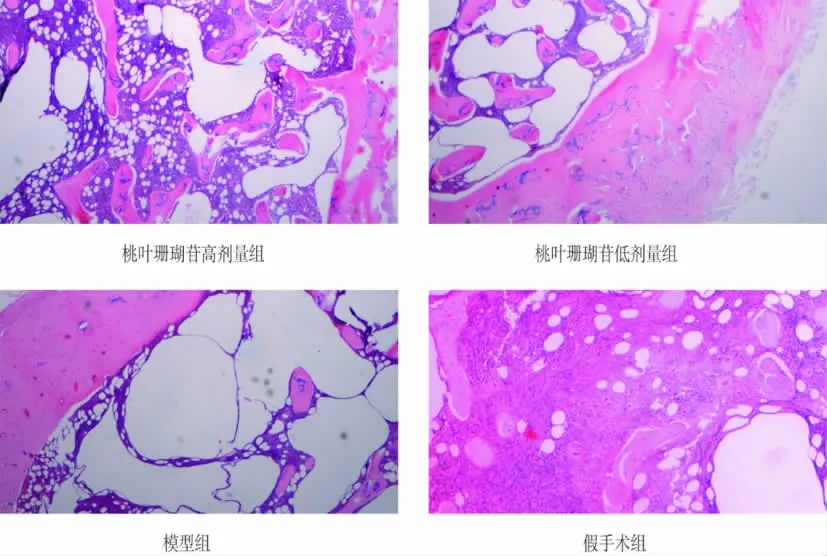
图1 四组大鼠骨组织形态学观察(HE 染色,10×10)
3.4 桃叶珊瑚苷对大鼠骨组织OPG、RANKL mRNA表达的影响 给药8 周后,与假手术组比较,模型组大鼠骨组织OPG mRNA 表达显著降低(P<0.01),而RANKL mRNA 表达显著升高(P<0.01)。与模型组比较,桃叶珊瑚苷高、低剂量组大鼠OPG mRNA 表达显著升高(P<0.01 或P<0.05),而RANKL mRNA 表达显著降低(P<0.01 或P<0.05)。见表4。
表4 各组大鼠骨组织OPG、RANKL mRNA 表达水平比较()
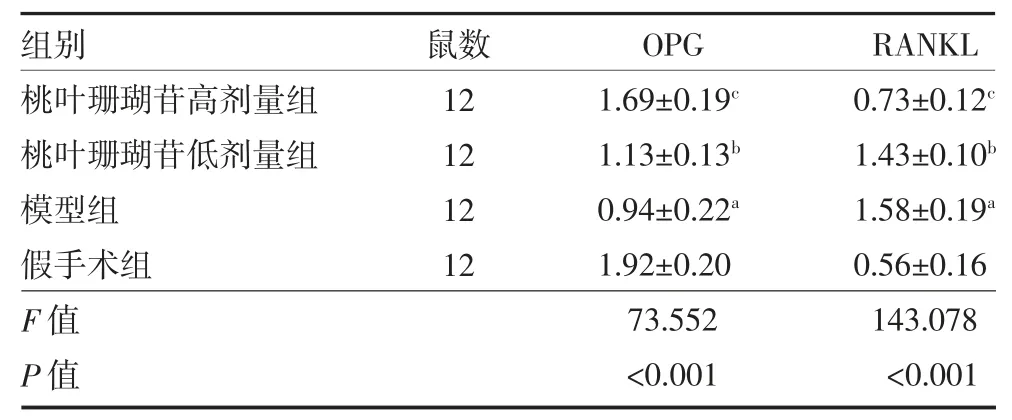
表4 各组大鼠骨组织OPG、RANKL mRNA 表达水平比较()
注:桃叶珊瑚苷高剂量组为卵巢切除+桃叶珊瑚苷10 mg/kg 腹腔注射;桃叶珊瑚苷低剂量组为卵巢切除+桃叶珊瑚苷5 mg/kg 腹腔注射;模型组为卵巢切除+生理盐水腹腔注射;假手术组为卵巢不切除+生理盐水腹腔注射;OPG 为骨保护素;RANKL 为细胞核因子κB 受体活化因子配体;与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
4 讨论
目前我国逐渐步入老年化社会,骨质疏松是老年患者致残和致死的主要原因之一,对社会经济产生重大影响[5]。目前治疗骨质疏松的西药很多,如双磷酸盐类、降钙素类、甲状旁腺激素、骨硬化素抗体等[6]。经过治疗后,骨质疏松患者总体生存率有所提升,但不良反应(如心脑血管疾病、非典型骨折和骨肉瘤等)的发生率也相应升高[7-8]。近年来,中药在治疗骨质疏松方面因具有“标本兼顾”、毒副作用小、取材方便等优势,而逐渐得到临床认可[9]。桃叶珊瑚苷是多种中草药的活性成分之一,具有护肝解毒、抗氧化、抗炎、抗骨质疏松等药理学作用,有较好的利用价值[10]。研究证实,桃叶珊瑚苷通过促进成骨作用和抑止破骨细胞活性产生抗骨质疏松的效应[11]。
骨密度是衡量骨质疏松程度及骨量变化的重要指标[12],本实验结果显示,给药8 周后,与假手术组比较,模型组大鼠骨密度值显著降低,显示大鼠骨质疏松建模成功。与模型组比较,桃叶珊瑚苷高、低剂量组骨密度值升高,证实了桃叶珊瑚苷能够促进骨形成。血清ALP 及BGP 主要由骨细胞分泌,在骨的矿化过程中起到关键性的作用,去势大鼠由于雌激素的缺乏而代偿性增加ALP 和BGP 的分泌[13-14]。模型组血清ALP 与BGP 含量明显高于假手术组,与骨密度呈负相关,进一步证明模型组骨质疏松模型制作成功。给药8 周后桃叶珊瑚苷高、低剂量组比模型组大鼠骨密度增加,而ALP 与BGP 降低,骨密度和ALP 及BGP 有负相关性,且病理结果显示桃叶珊瑚苷高剂量组大鼠骨小梁结构紧密,连续性较好,说明桃叶珊瑚苷具有促进骨形成、防止骨质丢失作用。
OPG/RANKL/RANK 信号通路是介导骨吸收和骨形成平衡的重要信号通路[15]。为了探讨桃叶珊瑚苷是否通过OPG/RANKL/RANK 通路调节破骨细胞的分化以影响骨代谢,本研究结果发现,注射桃叶珊瑚苷8 周后,桃叶珊瑚苷高剂量组上调OPG mRNA 表达,下调RANKL mRNA 表达,其通过调节OPG/RANKL/RANK 信号通路影响成骨细胞与破骨细胞之间的相互作用,可达到治疗骨质疏松的目的。
综上所述,桃叶珊瑚苷能够促进骨形成,减缓骨丢失,其机制可能通过OPG/RANKL/RANK 系统发挥治疗骨质疏松作用,相关机制有待深入研究。
