甲炎康泰对自身免疫性甲状腺炎大鼠PI3K/Akt/mTOR信号通路的影响
2022-06-22张秋娥潘雅婧张程斐赵丹吴丽丽秦灵灵刘铜华
张秋娥 潘雅婧 张程斐 赵丹 吴丽丽 秦灵灵 刘铜华
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是由于多因子功能紊乱导致的一种器官特异性自身免疫性疾病,其临床诊断通过血清甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)和抗甲状腺球蛋白抗体(anti-thyroglobulin antibodies,TgAb)的阳性表达以确诊[1]。目前遗传易感性、环境因素、营养因素和免疫紊乱是公认的导致AIT发生的重要因素[2-3],但其病因未完全阐明,尚无针对病因的治疗手段。
磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路长期以来被认为是细胞代谢、生长、存活的关键调节因子,mTOR是细胞内自噬的主要抑制因子,它受到PI3K/Akt通路的正调节。临床研究通过提取桥本甲状腺炎患者甲状腺滤泡上皮细胞进行研究,发现自噬相关蛋白减少。甲状腺滤泡细胞自噬参与了桥本甲状腺炎的发展[4],激活PI3K/Akt/mTOR信号通路使AIT的症状加重[5-6]。因此,研究组推测甲炎康泰可能作用于PI3K/Akt/mTOR信号通路,参与了对细胞自噬的调节作用来改善AIT病情。
1 材料与方法
1.1 实验动物
SPF级Lewis大鼠30只,6周龄,雌性,体质量115~145 g。购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。
1.2 实验药物
甲炎康泰组方:柴胡10 g、郁金20 g、夏枯草30 g、穿山龙10 g、浙贝母15 g、玄参10 g、山慈菇6 g、黄芪30 g、乌梅15 g。甲炎康泰颗粒剂购于北京康仁堂药业有限公司,溶于去离子水,置于4℃冰箱储存。参考课题组前期实验结果,本实验给药剂量2.834 g/kg[7]。
1.3 实验试剂
碘化钠(玛雅试剂有限公司产品,批号:MA-YA-CR-2831),猪甲状腺球蛋白(Thyroglobulin from Porcine thyroid gland,PTg)(美国Sigma公司,批号:#018K7012),弗氏不完全佐剂(Incomplete Freunds Adjuvant,IFA)(美国Sigma公司,批号:#SLCB8702),弗氏完全佐剂(Complete Freunds Adjuvant,CFA)(美国Sigma公司,批号:#SLCF1289),TPO-Ab Elisa kit(CUSABIO,批号:CO331050347),Trizol(美国Ambion公司),异丙醇(北京化工厂),PCR试剂盒(南京维诺赞生物科技股份有限公司),BASO脱蜡剂(珠海贝索生物技术有限公司,批号:C210702),无水乙醇(北京化工厂),伊红(美国Sigma公司),PI3KCA(proteintech公司,货号:20583-I-AP),Anti-Akt1 (phospho S473)(Abcam公司,批号:GR150067-1),Phospho-mTOR (Ser2448)(CST公司),苏木精染色液(北京普利莱基因技术有限公司,货号:C1411),羊血清工作液(北京中杉金桥生物技术有限公司,批号:2109D0617),DAB显色试剂盒(北京普利莱基因技术有限公司,批号:20A1CB1072),中性树胶(北京普利莱基因技术有限公司)。GAPDH、PI3K、Akt、mTOR基因的PCR引物均由上海生工生物工程股份有限公司设计、合成(引物序列及引物长度见表1)。
乳化剂的配制:实验时将1 mg PTg溶于1L PBS得到0.1% PTg溶液,再按等体积比例将该溶液与CFA研磨混合成乳剂得到终浓度0.05% PTg-CFA乳剂;同法配制0.05% PTg-IFA乳剂。碘化钠水溶液的配制:100 mL去离子水中加入64 mg NaI,配制成0.064% NaI溶液。
以上试剂现用现配,碘化钠水溶液注意避光。
1.4 实验仪器
台式高速冷冻离心机(德国SIGMA公司,3K15);Thermo labsystem MK3酶标仪(美国Thermo公司);OLYMPUS BH-2光镜(日本奥林巴斯公司);全自动新型电热培养箱(上海智诚分析仪器制造有限公司);其他手术相关器械。
1.5 实验方法
1.5.1 动物分组与造模 建立AIT模型[8]:根据体质量,采用区组随机法选取10只Lewis大鼠为正常对照组,其余为造模组。第一周适应性喂养正常进食饮水,第二周开始AIT造模,造模组Lewis大鼠自由饮用0.064% NaI溶液,正常对照组Lewis大鼠自由饮水。第3周造模组Lewis大鼠行初次免疫:每次在每只Lewis大鼠双侧腹股沟皮下、背部皮下、颈部皮下多点注射PTg-CFA乳剂0.2 mL,此周皮下注射2次,间隔三天。加强免疫:第4~8周配制PTg-IFA乳剂进行每周1次的皮下多点注射。造模成功验证方法:采集大鼠眶静脉血,Elisa法检测大鼠血清中TPOAb抗体水平。
1.5.2 给药方法 造模结束后,根据TPOAb浓度,将成模大鼠随机分为模型组与甲炎康泰组,每组10只,第8周开始给药。甲炎康泰组大鼠给予甲炎康泰水溶液灌胃,其余组予等体积去离子水灌胃,灌药体积为1 mL/100 mg,每日一次。连续给药8周。
1.5.3 取材方法 各组大鼠灌胃干预8周后,禁食12小时,腹腔注射2%戊巴比妥钠溶液(40 mg/kg),麻醉后行腹主动脉取血,负压真空采血管采集外周血,室温静置后离心(4℃,3 000r/min)10分钟,吸取上清,-80℃冰箱超低温保存,用于后续血清指标检测(本实验中每组取6只大鼠血清进行Elisa检测);每组取6只大鼠的甲状腺组织用于后续苏木精—伊红(hematoxylin-eosin,HE)染色以及免疫组织化学检测,另一侧甲状腺组织进行PCR检测(因RNA纯度问题,最终本实验中用4只)。
1.6 指标检测
1.6.1 血清抗体检测 Elisa法检测大鼠外周血清中TPOAb抗体水平。按说明书:酶标板加10 μL标准品、样品,另设空白孔,加一抗50 μL(空白孔不加),37℃恒温培养箱1小时,wash buffer洗板后加入二抗50 μL,37℃恒温培养箱30分钟,洗板完毕加显色液避光显色15分钟,酶标仪读取OD值,拟合标准曲线计算TPOAb浓度。
1.6.2 病理变化观察 取甲状腺组织,石蜡包埋,切片,二甲苯脱蜡,梯度乙醇脱水,自来水低速冲洗,苏木精染色5分钟,加0.5%的盐酸,加入0.5%的氨水回蓝30秒,伊红溶液染色2分钟,乙醇梯度处理,二甲苯浸泡,封片,镜下观察病理变化。
1.6.3 实时荧光定量PCR(real-time quantitative PCR,qRT-PCR) 采用逆转录定量PCR方法检测甲状腺组织中PI3K、Akt、mTOR mRNA的表达。Trizol法提取甲状腺组织RNA后,利用反转录试剂盒,根据说明书,以37℃,15分钟;85℃,5秒进行反转录。PCR反应体系:10 μL SYBR qPCR Master Mix,0.04 μL上引,1 μL下引,2μL cDNA稀释液,7.92 μL dH2O。PCR扩增依据厂商说明书条件:95℃预变性30秒;95℃变性5秒,退火60℃延伸30秒,循环反应40次,95℃,15秒,60℃持续60秒,采集溶解曲线,最后统计Ct值,结果以GAPDH为内参,正常组样本为对照,采用2-△△Ct相对定量法比较各组目标mRNA的表达差异。引物序列见表1。

表1 qRT-PCR引物
1.6.4 免疫组织化学分析 甲状腺组织石蜡包埋切片后脱蜡复水,Trition、3%H2O2处理,柠檬酸盐溶液高温抗原修复,山羊血清封闭,滴加一抗4℃,12小时后复温PBS冲洗,滴加二抗,DAB显色,苏木精染色,自来水低速冲洗,酒精梯度脱水,BASO脱蜡剂浸泡,滴加中性树胶封片。镜下拍照分析,运用Image-Pro Plus6.0,Media Cybernetics系统进行吸光度检测,分析PI3K、P-Akt、P-mTOR的平均光密度(IOD/Area),进行统计学处理。
1.7 数据处理
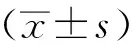
2 结果
2.1 各组大鼠外周血中TPOAb浓度测定
与正常组大鼠比较,模型组大鼠外周血TPOAb滴度值均升高(P<0.05)。与模型组相比,甲炎康泰组TPOAb滴度值降低,差异具有统计学意义(P<0.05)。见表2。
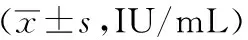
表2 各组大鼠血清TPOAb含量比较
2.2 各组大鼠甲状腺病理观察
200倍镜下可见正常组大鼠甲状腺滤泡上皮细胞排列整齐,滤泡圆形完整,滤泡腔内胶质丰富,未见淋巴细胞等浸润;与正常组对比,模型组AIT大鼠甲状腺滤泡上皮细胞可见明显破坏,滤泡部分萎缩甚至消失,滤泡腔内胶质减少,滤泡间隙可见明显浸润淋巴细胞;甲炎康泰组大鼠甲状腺滤泡上皮细胞较完整,滤泡形态较规则,镜下可见胶质略少,甲状腺滤泡细胞间偶见淋巴细胞浸润,与模型组比较普遍轻微。见图1。
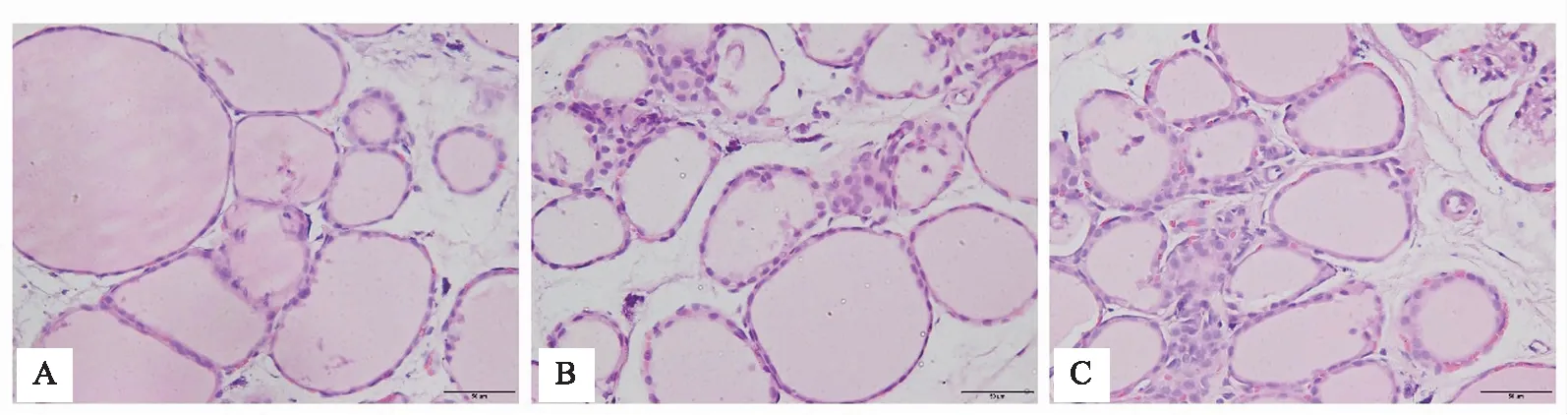
注: A 正常组;B 模型组;C 甲炎康泰组。
2.3 各组大鼠甲状腺组织中PI3K、Akt、mTOR的mRNA表达情况
模型组大鼠甲状腺组织PI3K、Akt、mTOR的mRNA表达较正常组显著升高(P<0.05);与模型组比较,甲炎康泰组PI3K、Akt、mTOR的mRNA表达降低,差异具有统计学意义(P<0.05)。见表3。

表3 各组大鼠甲状腺组织PI3K、Akt、mTOR的mRNA表达情况比较
2.4 各组大鼠甲状腺组织中PI3K、P-Akt、P-mTOR蛋白表达情况
400倍镜下可见各组大鼠甲状腺组织PI3K、P-Akt、P-mTOR免疫阳性物呈棕色,计算并统计平均光密度值,正常组大鼠甲状腺组织内有较少PI3K、P-Akt、P-mTOR蛋白表达,模型组大鼠PI3K、P-Akt、P-mTOR蛋白均为阳性表达。与模型组比较,甲炎康泰组PI3K、P-Akt、P-mTOR蛋白表达减少(P<0.05),见表4,图2、3、4。

表4 各组大鼠甲状腺组织PI3K、P-Akt、P-mTOR蛋白表达比较
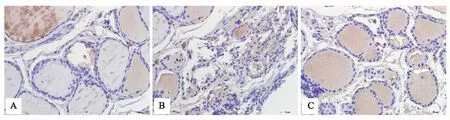
注: A 正常组;B 模型组;C 甲炎康泰组。
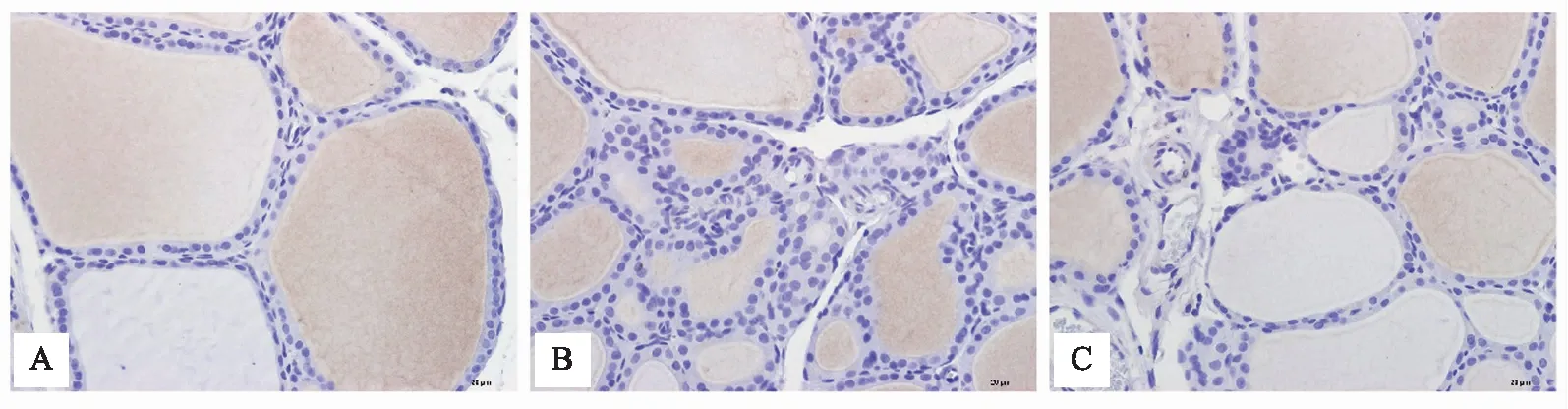
注: A 正常组;B 模型组;C 甲炎康泰组。
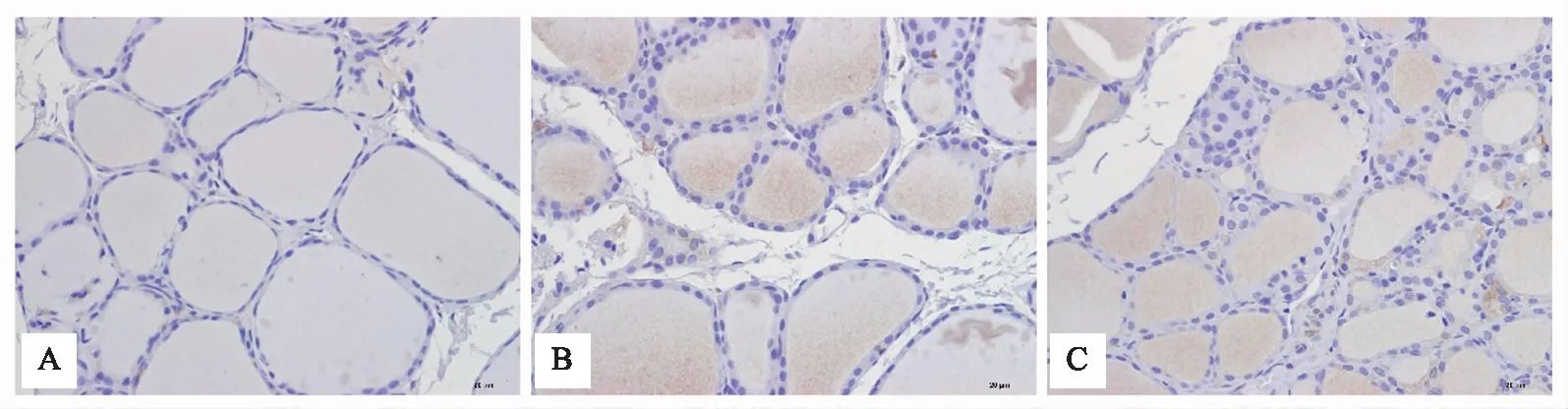
注: A 正常组;B 模型组;C 甲炎康泰组。
3 讨论
AIT是一种常见的器官特异性自体免疫性疾病,起病隐匿,病程较长,病情反复,常合并其他自身免疫性疾病[9-11],可引起女性不孕、流产[12]、脱发[13]等。除了躯体并发症,患者也可能出现精神障碍,如抑郁症、焦虑症[14]等。AIT迁延不愈,可导致甲亢反复发生,可并发甲状腺结节,最终导致甲状腺功能减退而不得不采用替代治疗[1]。AIT发病主要是自身免疫耐受被破坏的结果,细胞和体液免疫反应,特异性地影响特定组织[15-17],其中T淋巴细胞直接破坏甲状腺组织,导致一系列连锁反应,其分泌的细胞因子等可通过触发和增强免疫应答及炎性反应而加剧AIT病变[15]。
PI3K/Akt/mTOR信号通路作为自噬的经典途径,已被证明在AIT的发生发展中起着重要作用[6,18-20],此通路是由一系列不同的反应通过特定的受体激活的生长因子(包括激素、细胞因子和趋化因子)通过各种机制激活PI3K。PI3K启动磷酸肌醇-3激酶调控通路,特异性结合Akt和磷酸肌醇依赖的蛋白激酶1(phosphoinositide-dependent protein kinase-1,PDK1),促进PDK1对Akt磷酸化和激活[21],Akt间接激活mTOR,当TSC2在Ser939被激活的Akt磷酸化时,它从TSC1分离出来[22],导致mTORC1的激活,mTORC1直接磷酸化下游底物,抑制自噬[23]。自噬是一种保守的细胞过程,涉及自噬体的形成,自噬体包裹着细胞质货物,包括长寿命蛋白质、蛋白质聚集体和细胞器,并将这些货物输送到溶酶体进行降解[24]。最新研究已经证明了自噬在先天性和适应性免疫反应中的重要作用[24-26]。T细胞在胸腺从分化到成熟、在外周的存活和其功能受到自噬水平的影响[26]。此外,自噬的诱导促进了抗原肽递送到主要组织相容性复合物II类负载区,并随后表达到CD4+T细胞[27-28]。自噬过程参与了自身免疫和炎性疾病的发展,对免疫和炎症的有益和有害影响起到了平衡作用[29]。T细胞消融引起严重的自身免疫反应,与mTOR激活和代谢重编程有关,这些激活引起外周T细胞的自发激活和加速分化,药物性mTOR抑制剂对T细胞缺陷和免疫调节障碍有积极作用[30]。
AIT可归属于中医“瘿病”“瘿瘤”等范畴,中医药特色治疗在AIT的治疗方面有着独特优势[31]。甲炎康泰(专利号CN106421633A)由柴胡、郁金、夏枯草、穿山龙、浙贝母、玄参、山慈菇、黄芪、乌梅组方而成,是刘铜华教授在多年临床治疗中不断总结而成的疗效明确的经验方。本病诱因主要为情志失调,致肝郁气滞。肝郁犯脾,脾虚痰积,气滞、痰结瘀阻于颈前,日久因实致虚,伤阴耗气,损及阴阳。因此,甲炎康泰全方功以疏肝理气,可达到消痰散结化瘀的治疗目的[32]。
前期研究显示,甲炎康泰能降低Th17/Treg比例,下调血清白介素(interleukin,IL)-6、IL-17A、IL-23p19、转化生长因子-β1等Th17相关细胞因子分泌,上调血清IL-2、IL-10等Treg相关细胞因子分泌[33],纠正Th1/Th2失衡[34]。本次实验结果表明,与模型组相比,甲炎康泰组大鼠外周血TPOAb滴度降低,给药甲炎康泰干预后甲状腺组织淋巴细胞浸润减轻,一定程度上缓解了AIT病情。相比模型组,甲炎康泰组甲状腺组织中PI3K、Akt、mTOR mRNA相对表达量明显下降,PI3K、P-Akt、P-mTOR蛋白表达量明显下降。因此,甲炎康泰可能通过抑制PI3K/Akt/mTOR信号通路,促进细胞自噬,来维持T细胞稳态,进而减轻炎症反应,延缓AIT发生发展。
综上所述,甲炎康泰治疗AIT可能与其能够抑制PI3K/Akt/mTOR信号通路有关。但本实验仅初步验证了甲炎康泰对于PI3K/Akt/mTOR信号通路的调节作用,下游靶蛋白等尚未进行验证,与其他信号通路是否有协同作用,也有待更进一步的实验探索。
