TACE序贯MWA联合阿帕替尼治疗不可切除肝癌的临床研究
2022-06-22乔元岗张伟伟
刘 松 王 倩 乔元岗※ 张伟伟
原发性肝癌(primary hepatic carcinoma,PHC)作为严重危害人类生命健康的恶性肿瘤,在我国发病率高居恶性肿瘤的第4位,死亡率居第2位[1]。大多数原发性肝癌在确诊时已达中晚期,失去了手术切除的最佳时机[2]。随着介入医学技术的进步,给予不能手术的中晚期肝癌患者经导管肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)序贯微波消融术(microwave ablation,MWA)的联合治疗模式逐渐被大众所认可。文献报道,TACE联合MWA明显提高了肿瘤患者的生存率,且安全性良好[3],但是肿瘤灭活不彻底、侧支血管再生等情况仍困扰着广大医患,研究[4]表明联合靶向药物等可促进灭活肿瘤细胞。阿帕替尼是我国自主研发的抗血管生成、多靶点抗肿瘤药物,多个文献报告阿帕替尼对肝癌治疗有效,且无明显不良反应[5,6]。本文主要探讨TACE序贯MWA联合阿帕替尼治疗不可切除肝癌的疗效及安全性。
1.资料与方法
1.1 临床资料 本研究收集2018年1月至2020年1月我院收治的40例中晚期肝癌患者的临床资料,所有患者均无外科手术切除指征,采用TACE序贯MWA联合阿帕替尼治疗的方案。本组40例患者中男性32例,女性8例,年龄32~75岁,中位年龄52岁。肝功能Child-Pugh分级A级32例,B级8例;肿瘤直径中位数为7.8(5.6~15.1)cm;AFP≥400μg/L28例。
1.2 入组标准 纳入标准:①外科不可手术切除的确诊的中晚期肝癌;②肝功能Child-Pugh A/B;④门静脉主干未完全阻塞或虽然门静脉主干完全阻塞但肝门有较多代偿性侧支血管形成;⑤ECOG体力状态评分0~1分。排除标准:①肝功能Child-Pugh C级;②凝血功能严重减退,且无法纠正;③门静脉主干完善阻塞,且侧支循环代偿少;④合并活动性肝炎或严重感染且不能同时治疗;⑤ECOG评分≥2分;⑥肿瘤全身广泛转移。
1.3 方法
1.3.1 TACE:采用Seldinger穿刺技术,经皮股动脉穿刺,超选择性肿瘤供血动脉后再行肝动脉化疗栓塞。灌注化疗药物为奥沙利铂甘露醇注射液300ml,栓塞剂为碘油混合乳化剂10ml。根据肿瘤大小及血供变化情况,必要时再次行TACE术。
1.3.2 MWA:TACE术后3~5周序贯行CT引导下MWA治疗。术前经增强CT确定肿瘤大小、数目、边界及毗邻关系。消融功率80~100W,时间6~12min。
1.3.3 阿帕替尼治疗:介入治疗1周后即开始口服甲磺酸阿帕替尼250mg,每日1次。患者签署知情同意书,告知不良反应和副作用。
1.4 随访复查和疗效评价
1.4.1 随访:所有患者出院后以电话访问及门诊复查等方式进行随访,随访起点从第一次行介入治疗开始,终点为患者死亡或2021年1月31日,随访期间无病例丢失。
1.4.2 疗效评价:据改良实体瘤评价标准改良版实体瘤疗效评价标准(modified response evaluation criteria in solid tumors,mRECIST)评估肿瘤完全缓(CR)、部分缓解(PR)、稳定(SD)、肿瘤进展(PD)、客观缓解率(ORR)、疾病控制率(DCR)及总生存期(OS)。ORR为CR与PR之和。DCR的定义为CR、PR与SD之和。OS指患者从联合治疗开始至末次随访时间或任何原因致患者死亡的时间。
1.4.3 安全性评价:随访记录的不良反应主要包括呕吐、腹泻、发热、高血压病、手足综合征、蛋白尿等症状,同时观察与TACE+MWA联用后有无不良反应增效。
1.4.4 统计学方法:所有结果数据均采用SPSS 22.0进行统计学分析。计数资料以例(%)表示,总生存时间以中位数表示。
2.结果
2.1 疗效 本组患者随访时间为8~32个月,中位随访时间为24个月。患者术后3个月ORR和DCR分别为62.5%和97.5%;术后6个月、12个月ORR和DCR分别为65.0%、85.0%和52.5%、78.9%,见表1。
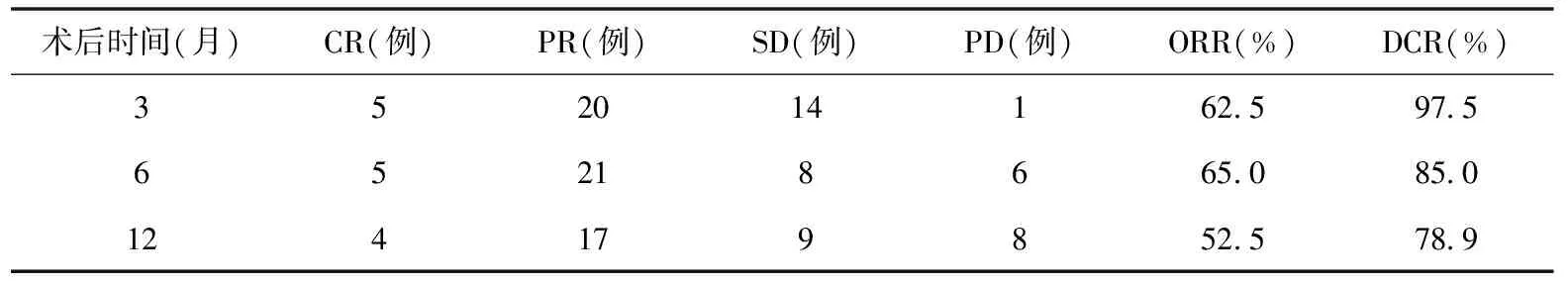
表1 联合治疗术后反应疗效评价
2.2 生存情况 患者中位生存时间28个月,6个月、1年、2年累积生存率分别为95.0%、67.5%、37.5%,见表2。

表2 联合治疗术后生存情况
2.3 安全性评价 联合治疗主要不良反应为有腹痛、发热、呕吐及阿帕替尼相关的手足皮肤反应、腹泻、高血压等。大多数不良反应轻微,可耐受或对症处理后好转,未发生严重不良事件。(表3)。
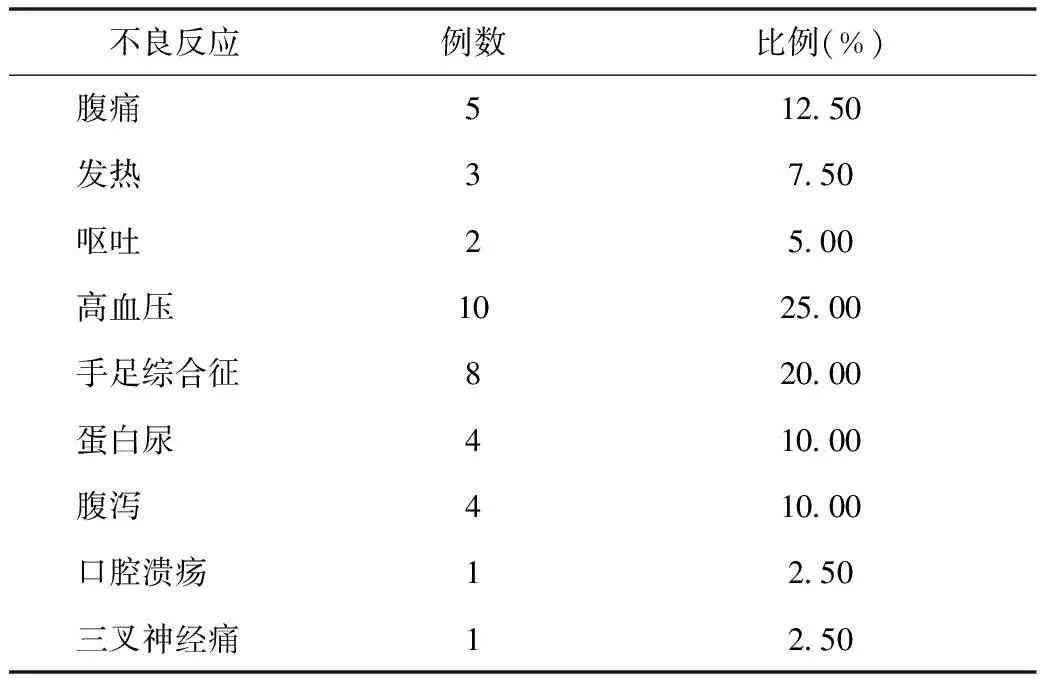
表3 不良反应发生率
3.讨论
TACE和MWA治疗因微创和可重复性的优势,已成为中晚期肝癌患者常用的治疗手段。TACE疗法是经动脉插管注入化疗药物与栓塞剂,使肿瘤缺血性坏死。但研究[7]表明单纯行TACE术有栓塞不彻底、肿瘤易复发等问题,往往治疗效果不佳。MWA是目前应用较为广泛的热消融技术,不仅依靠高温造成肿瘤凝固坏死,还可提高机体免疫力,进一步提高TACE的疗效[8]。有研究显示,TACE序贯MWA可显著降低肿瘤复发率,延长患者的生存期[9,10]。
研究表明,VEGF是目前已知的作用最强的促血管生长因子[11],肝癌组织中VEGF表达明显增强[12]。肝癌患者行TACE术后VEGF等促血管因子表达增强,诱发肿瘤新生血管生成。阿帕替尼可多靶点阻断VEGF表达,从而抑制肿瘤新生血管生成。文献报道,肝癌患者行WMA术后,血清VEGF水平较术前明显降低[13]。三者联合使用将能更好地抑制肿瘤细胞生长、侵袭,改善肝癌患者的预后。
TACE序贯MWA联合阿帕替尼口服可获得较好临床获益。本组患者术后3个月ORR和DCR分别为62.5%和97.5%;术后6个月、12个月ORR和DCR分别为65.0%、85%和52.5%、78.9%。多个文献[14,15]报道TACE联合阿帕替尼治疗肝癌ORR及DCR、6个月、12个月生存期均明显优于单纯TACE组。同时,进行的一项随机对照试验显示,微波热凝术联合阿帕替尼与单纯微波热凝术比较,疾病控制率和生存期有提高,显示出一定的积极作用[16]。一项关于与TACE术后联合索拉菲尼、RFA治疗肝细胞癌对比单纯TACE联合RFA的研究[17],复发生存率、总生存时间均高于观察组。本组患者的6个月、1年、2年累积生存率分别为95%、67.5%、37.5%,中位生存时间达到了28个月。通过本研究可初步显示该联合方案可延长肝癌患者的生存期。
本研究结果显示,患者不良反应主要为腹痛、发热、呕吐等TACE及WMW术后反应。对于阿帕替尼相关药物反应如手足皮肤反应、高血压等对症处理或减半服药好转,并未出现联合使用的非预期并发症,也未出现Ⅳ级严重不良反应。本研究由于样本量较小,同时随访时间较短,后续还需大规模的临床试验数据来验证该结论。
