BT5T5-Ag NCs 荧光探针对ATP 高灵敏、高选择性的检测
2022-06-21张保柱张爱众温广明
张保柱,张爱众,温广明
(晋中学院α.化学化工系;b.资产管理部,山西 晋中 030619)
三磷酸腺苷(ATP)作为一种重要的能量源,在细胞代谢的调节方面起到极其重要的作用,在绝大多数生物发生的各种类型的生物化学反应中扮演着能量提供者的角色[1].ATP 的浓度和消耗速率能够反映细胞的活性,而且与细胞的生存能力和损伤有一定的联系.许多像帕金森症、组织缺氧症、低血糖症、局部缺血症和一些恶性肿瘤等疾病常与ATP含量的异常有关[1].由于ATP 在临床和生物学上的重要性,因此在生物化学和分子生物学研究领域开发简单、灵敏的ATP 检测方法是至关重要的.
过去的几十年,研究人员提出了各种各样检测ATP 的方法,像高效液相色谱法[2]、荧光法[3~7]、化学发光法[8]和比色法[9~10].在这些检测方法中,基于适配体的荧光传感具有灵敏、特异、方便和仪器易于使用的优点,受到研究者的高度关注[11~13]. 适配体是合成的单链DNA 或RNA,它是通过“SELEX”程序进行人工选择,它可以特异性地识别包括蛋白质、金属离子、小分子和细胞等各种各样的靶标.
近年来,金属纳米簇越来越引起人们的关注,这是由于其独特的性能以及被广泛应用到生物传感、生物成像和光伏电池等领域.其中银纳米簇(简称Ag NCs)在溶液中比金纳米簇发出更明亮的荧光,而且应用更广泛[14].如果没有模板或保护剂,Ag NCs 的寿命很短,容易聚集为纳米颗粒,失去独特的荧光性能[14].有许多像硫醇、树枝状大分子、聚合物和DNA 寡合苷酸等物质能用来保护Ag NCs[14].其中用DNA 稳定的Ag NCs 具有生物相容性好、毒性小、光稳定好和荧光可调等优点而被广泛应用[14].
基于适配体和Ag NCs 的优点,本研究设计了ATP 适配体和位于ATP 适配体两端的Ag NCs 成核序列的DNA 模板,将此DNA 模板命名为BT5T5.在BT5T5 模板两端的成核序列上合成Ag NCs,然后加入ATP,ATP 与其适配体特异性结合使适配体的构象发生改变,导致荧光较弱的Ag NCs 互相靠近荧光增强,ATP 便得到检测.
1 实验部分
1.1 试剂与仪器
BT5T5 寡合苷酸、ATP、CTP、GTP 和UTP 购自生工生物工程(上海)股份有限公司,胎牛血清蛋白购自上海源叶生物科技有限公司,AgNO3、NaBH4购自上海阿拉丁生化科技股份有限公司,所有试剂均为分析纯,未进一步纯化.磷酸氢二钠-磷酸二氢钠缓冲溶液(简称PBS,20 mM,pH 7.0)在所有实验中使用.所有溶液用Milli-Q 水(18.2 M Ω cm)配置.
BT5T5 寡合苷酸的序列:

注:斜体字部分为Ag NCs 成核序列;粗体字部分为ATP 适配体;下划线部分为连结序列.
FS5 稳态瞬态荧光光谱仪(英国利文斯顿爱丁堡仪器公司).
1.2 实验方法
1.2.1 BT5T5-Ag NCs 的合成
本实验中,BT5T5-Ag NCs 的合成方法是按照以前文献报道进行并做了适当的调整[15].将DNA(3 μM)和AgNO3(18 μM)分别加入PBS(20 mM,pH 7.0)溶液中,混匀后放在冰箱的冷藏中,在4 ℃下避光孵育20 min,紧接着把新配置的NaBH4(18 μM)加入上述溶液,摇匀后同样置于冰箱的冷藏中,避光孵育1 h.BT5T5-Ag NCs 合成完成.
1.2.2 ATP 的检测
将不同浓度的ATP(0~24 mM)加入BT5T5-Ag NCs 溶液中,孵育5 min 后在室温下测定其荧光光谱.对于ATP 的选择性,实验方法与检测ATP 相同,只不过是用CTP、GTP 和UTP 代替了ATP.
1.2.3 BT5T5-Ag NCs 探针的实际应用
用ATP 传感器检测稀释胎牛血清中的ATP.把不同浓度的ATP 标准样品溶液用检测ATP 的方法来检测.
2 结果与讨论
2.1 BT5T5-Ag NCs 的激发和发射波长
BT5T5-Ag NCs 的最佳激发和发射波长对ATP灵敏性的检测有一定的影响[15].BT5T5-Ag NCs 的激发和发射波长用FS5-稳态瞬态荧光仪来测定.具体方法是用一定数值的激发波长来测定其发射波长,然后固定发射波长来扫激发,扫出的激发和发射的图形要基本对称且强度相等.如图1 所示,曲线a 和b 分别为BT5T5-Ag NCs 的激发和发射光谱,其激发和发射波长分别为550 nm 和620 nm.
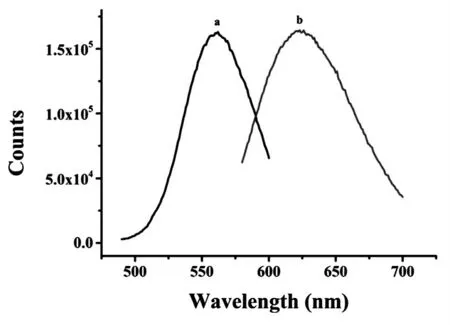
图1 BT5T5-Ag NCs 的激发(曲线a)和发射(曲线b)光谱
2.2 ATP 与BT5T5-Ag NCs 荧光探针的作用时间
对ATP 与BT5T5-Ag NCs 荧光探针的作用时间进行测定.如图2 所示,BT5T5-Ag NCs 的荧光强度随着作用时间的增加逐渐增强,5 min 时达到平台,在0.5 h 内荧光强度几乎不变.因此5 min 作为ATP 最佳检测时间.
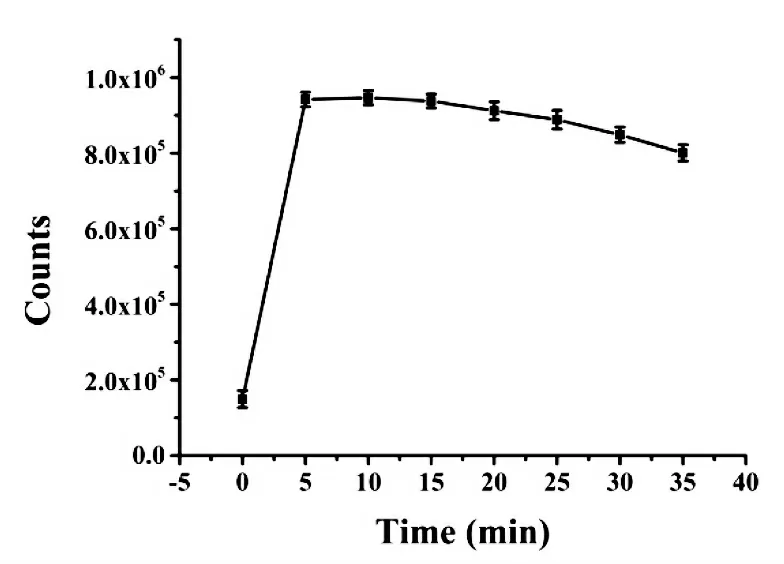
图2 BT5T5-Ag NCs 荧光强度随ATP 与BT5T5-Ag NCs 作用时间的变化关系图
2.3 BT5T5-Ag NCs 荧光探针的稳定性
对BT5T5-Ag NCs 的稳定性进行研究. 如图3所示:180 min 之前,BT5T5-Ag NCs 荧光强度逐渐增强;180 min 时,荧光强度增加到最大,之后荧光强度缓慢下降. 因此对于后续实验是在制备Ag NCs 加入NaBH4后3 h 左右进行.
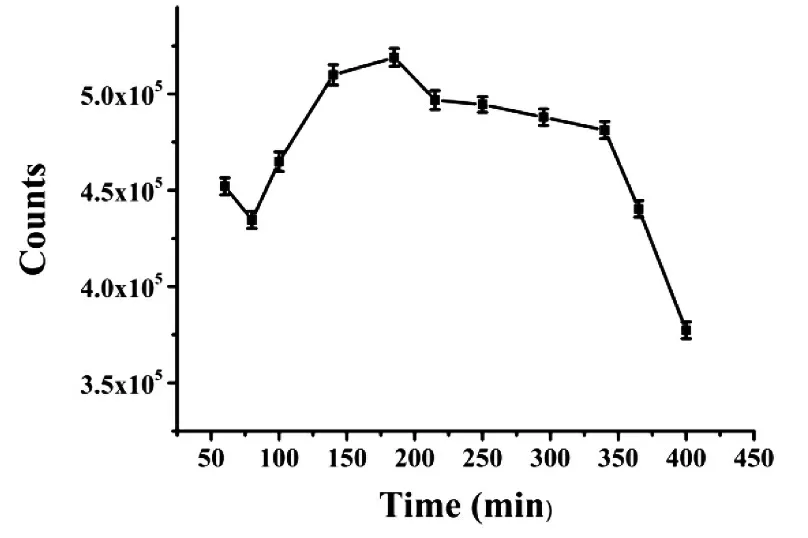
图3 BT5T5-Ag NCs(λex=550 nm)的荧光强度随时间的变化
2.4 ATP 的检测
在最佳实验条件下对ATP 做定量检测.将0~24 mM ATP 加到BT5T5-Ag NCs 溶液中,测得相应的荧光光谱.如图4A 和B,图4A 为加入不同浓度的ATP时BT5T5-Ag NCs 的荧光光谱图,图4B 为BT5T5-Ag NCs 的荧光强度随ATP 浓度的变化关系图,插图为其线性关系图.在6~21 mM(R=0.968 7,线性方程为F=-112 717.7+57 731.1CATP)范围内BT5T5-Ag NCs 的荧光强度逐渐增强,ATP 的检测限为16 μM(由空白样标准偏差的3 倍除以标准曲线的斜率计算所得).该检测限低于以前所报道的0.44 mM 和0.65 mM[16,17],因此该荧光探针是高度灵敏的.

图4 加入不同浓度的ATP(0-24 mM)BT5T5-Ag NCs 的荧光光谱图
2.5 BT5T5-Ag NCs 荧光探针的选择性
选择性是评价荧光探针性能的一个关键参数[15]. 为了评估使用BT5T5-Ag NCs 检测ATP 的拟议策略的特异性,研究了ATP 和其他类似物,包括CTP、UTP 和GTP.如图5 显示,只有ATP 导致F/F0显著增加,而CTP、UTP 和GTP 增加不明显.该结果清楚地显示BT5T5-Ag NCs 荧光探针对ATP 的选择性好.
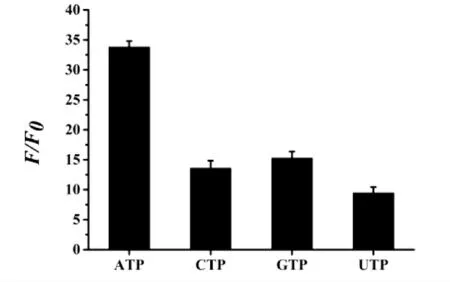
图5 ATP 的特异性(F0 和F 分别是未加和加入ATP、CTP、UTP 和GTP 的荧光强度.
2.6 实际样品中ATP 的检测
为了评价BT5T5-Ag NCs 探针在实际样品中的应用和精确性,把3、6、9、12 mM 的ATP 分别加入稀释了的胎牛血清溶液中并且用该探针测定.回收率和相对标准偏差列于表1 中,回收率的范围为98.4 %~106.0%,相对标准偏差的范围为0.96 %~4.04%,该结果表明探针的精确率非常高.测量所得的相对标准偏差与报道的数值相当[18~19].上述结果证明该探针检测实际样品中的ATP 是可靠的.

表1 用该探针测量胎牛血清溶液中的ATP(N=3)
3 结论
总之,本研究基于BT5T5-Ag NCs,设计了一种检测ATP 荧光增强的荧光探针. ATP 与其适配体结合使得适配体构象发生改变,导致适配体两端荧光较弱的Ag NCs 互相靠近,荧光增强.该探针费用低,毒性小,操作简单,灵敏性高,选择性好.在0~24 mM 范围内ATP 的检测限为16 μM.而且,该探针成功地检测了胎牛血清中的ATP.因此该探针对生物样品中ATP 的检测具有广阔的应用前景.
