山西堡子酒大曲菌群结构及多样性分析
2022-06-21郑同庆
郑同庆
(山西堡子酒业有限公司生产部,山西 晋中 030600)
酿酒大曲含有物种丰富的微生物菌群,在酿酒过程中作为微生物发酵剂使用[1].这种微生物菌群可将酿酒原料分解成白酒中的前体风味物质,它们的结构和数量直接决定着酒体的风格和产品质量[2].对酿酒大曲中微生物菌群结构进行解析,是了解酿酒过程中微生物作用的重要方法[3][4].分析酿酒大曲中优势菌群及其功能关系,对于酿造工艺的改进和产品质量的提升具有重要的意义[5].在微生物研究的早期,多采用分离培养法进行研究,这种方法所受限制颇多,得到的结果容易受多种因素影响,且操作繁琐,所用时间较长,获得的可培养微生物种类不足样品中的1%,无法对其进行微生物结构的解析[6].近年来,基于DNA 分子标记技术在微生物菌群结构的研究中得到了迅速的发展,特别是高通量测序技术的出现与广泛应用,使其成为微生物研究领域的主要分析工具.高通量测序相比传统实验优点突出,对于样品中复杂的微生物菌群可轻松、实时、快速地进行测序读取,测序结果更准确、更全面[7].
关于酒曲的研究国内多集中于研究酒曲中微生物组成结构、酒曲理化性质及对酒曲中功能菌群的分析.施安辉等对山东梁山徐坊大曲进行研究,得出大曲中细菌、酵母、霉菌在全部培养微生物中所占比重和优势菌种类存在差异[8]. 徐瑾等较不同理化条件下,得出样品细菌群落PCR-DGGE 最优分析条件,研究了样品菌群构成的动态变化规律[9].雷震河对大曲和酒醅中的微生物构成进行研究,得出大曲中优势细菌门包括厚壁细菌门、变形菌门等,优势真菌包括曲霉菌属、热子囊菌属、根霉菌属等[10].曹苗文等对清香型白酒中功能型曲的应用进行研究,发现在酿造过程中加入功能性曲,酒体中物质成分发生极大改变[11].目前在清香型大曲研究中,对酿造工艺的研究较多,而对清香大曲菌群结构解析鲜有报道,采用高通量测序全面解析清香大曲细菌和真菌多样性的研究未见报道.
本文以山西榆次堡子酒(清香型白酒)大曲为研究对象,对大曲中真菌、细菌的总DNA 进行了提取,通过高通量测序技术,全面解析大曲微生物菌群结构,并对微生物功能基因进行预测. 本研究对全面了解堡子酒大曲微生物菌群结构提供科学依据,对传统白酒酿造改造升级具有广泛的应用前景.
1 材料与方法
1.1 实验材料
本研究中的实验材料(清香型堡子酒酿酒大曲)采自山西堡子酒业有限公司.
取样方法:取酒厂粉碎后贮存期为7 天的堡子酒大曲,随机抽取酒曲袋,取袋中上部、中部、下部酒曲混合,编号为DQ.
1.2 实验方法
1.2.1 DNA 提取及高通量测序
取采集到的样品酿酒大曲10 g,迅速密封于无菌袋中,-20 ℃保存备用.
对样品进行预处理后,使用E.Z.N.ATM Mag-Bind DNA Kit(OMEGA)试剂盒进行基因组DNA 的提取. 对得到的样品DNA 进行扩增,PCR扩增所用引物见表1.对经过扩增的产物进行2%琼脂糖凝胶电泳检测文库大小,检测合格后的扩增产物送到测序公司(上海生工)进行高通量测序.

表1 16S PCR 与ITS PCR 引物
1.2.2 数据统计分析
采 用R 3.6.0、Fasttree 2.1.7、Python 2.7.3、PICRUSt 1.1.4、FUNGuild 1.0 等软件,对高通量测序结果进行处理与分析.本文使用RDP 16S 数据库、Unite 数据库等.
2 结果与分析
2.1 样品测序结果预处理
数据预处理:首先需将得到的双端测序数据拼接成一条完整的序列,并对所有样品的原始数据进行质量过滤,以获得有效标签.主要包括以下步骤:去除引物接头,进行拼接、过滤,得到高质量的序列数据.
表2 为样品测序的双端序列经过拼接得到的原始序列信息和经过滤后的序列信息.对比可以看出,样品原始序列经过滤后,有效序列数得到降低;最短序列长度和最长序列长度发生变化,说明异常长度的序列被去除;同时平均序列长度发生改变,过滤后的平均序列长度与测序目的片段的长度范围更接近,提高了后续处理结果的准确性.

表2 样品序列数据信息统计
2.2 样品测序结果分析
2.2.1 OTU 统计
将质控后的序列以97%的相似度阈值聚类为操作分类单元(Operational Taxonomic Units,OTU),获得OTUs 序列数信息. 样本16S 测序获得的OTUs 序列数为57 402 条,ITS 测序获得的OTUs 序列数为70 631 条;对16S 测序结果进行聚类得到126 个OTUs,对ITS 测序结果进行聚类得到48 个OTUs.
2.2.2 微生物物种注释及分类学分析
使用QIIME 和SILVA 数据库对OTUs 的代表性序列进行物种注释和分析,以获得各分类水平上的类群信息(由于16S 和ITS 的高通量测序对于亲缘关系较近的种分辨率不高,部分微生物在种水平未被分辨出,故种水平的物种信息未列出).通过统计大曲样品的群落组成,得出细菌类群共获得了11 门、20 纲、33 目、71 科、103 属;真菌类群共获得了5 门、11 纲、21 目、35 科、54 属.无论在哪个分类水平,得到的细菌数量均多于真菌,表明细菌在各水平的数量分布均高于真菌,大曲中细菌菌群的多样性高于真菌菌群.
2.3 微生物群落多样性分析
2.3.1 Alpha 多样性指数分析
通过评估Alpha 多样性指数,可以表征微生物群落的多样性、丰富度和均匀程度.在97%相似度水平下,样品Alpha 多样性指数值如表3 所示.依据表3 对样品的几种指标进行分析对比,来分析样品的复杂程度.与真菌相比,大曲中细菌的ACE、Chao 和Shannon 指数均较高,且Simpson 指数较低,表明细菌类群中物种的数量较多,细菌菌群丰富度大于真菌菌群,提示细菌可能在酿酒过程中发挥着重要的作用;样品中细菌和真菌的Coverage 值均在0.99 以上,说明样本中序列被测出的概率较高,样本文库的覆盖率较高,反映出本次测序结果能够代表样品中菌群的真实情况.

表3 Alpha 多样性指数统计
2.3.2 稀释性曲线特征分析
采用对测序序列进行随机抽样的方法,以抽到的序列数与它们所能代表的OTU 数目构建稀疏性曲线.图1 为所构建的持续抽样下新OTUs 出现的稀疏性曲线:起初,曲线随测序条数的增多而急剧升高,表明样品中出现了大量的物种;随后稀疏性曲线趋于平坦,则表示测序数据接近饱和,说明所取样品量足以覆盖所有细菌和真菌;且图1(a)曲线平缓后的高度较图1(b)高,进一步说明样品中细菌丰富度较真菌高.
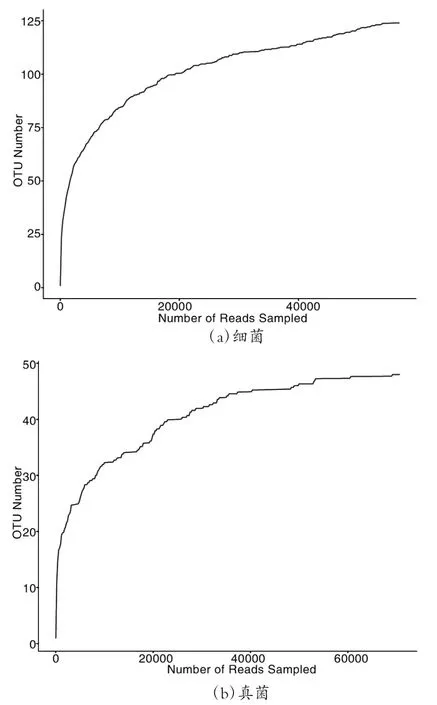
图1 样品稀释曲线
2.4 物种组成分析
2.4.1 门水平物种组成分析
对样本在门水平进行物种多样性组成分析可知,大曲样本细菌在门水平主要有五大门类:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝细菌门(Cyanobacteria_Chloroplast)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes). 清香型白酒大曲中细菌在门水平上还存在所占一定比例的未分类菌群和其他菌群(占比小于1 %). 其中变形菌门占43.8%、厚壁菌门占37.3 %和蓝细菌门占13.5%为细菌门类的优势菌群.清香型白酒大曲真菌在门水平主要有三大门类:子囊菌门(Ascomycota)、毛霉菌门(Mucoromycota)、担子菌门(Basidiomycota). 其中子囊菌门在真菌中占绝对优势,占总丰度的99.1%.与真菌群落相比,堡子酒大曲中的细菌在门类水平上的菌群数量更为丰富,且各细菌门之间的相对丰度比例相差较小;而真菌群落中的各门类所占比重相差较大,主要以子囊菌门占主导.对比张双燕[12]关于清香型大曲微生物组成的研究,样品大曲中菌群种类组成与其所用大曲相似,但各个菌群所占比重存在差异.
2.4.2 属水平物种组成分析
对样本在属水平进行物种多样性组成分析可知,清香型白酒大曲细菌在属水平的菌群分布主要包括:泛菌属(Pantoea)、乳酸杆菌属(Lactobacillus)、链霉菌属(Streptophyta)、葡萄球菌属(Staphylococcus)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)、短杆菌属(Brevibacterium)、醋酸杆菌属(Acetobacter)、根瘤菌属(Rhizobium)、假单胞菌属(Pseudomonas)、短波单胞菌属(Brevundimonas)、节杆菌属(Arthrobacter)、嗜冷杆菌属(Psychrobacter)、不动杆菌属(Acinetobacter)、黄杆菌属(Chryseobacterium)、盐单胞菌属(Halomonas)等,未分类的菌群和其他菌群丰度占总菌群的17.7%.其中泛菌属、乳酸杆菌属、链霉菌属为细菌属水平的优势菌属,分别占35.4%、17.5%和13.5%;乳酸菌能够产生乳酸等白酒风味的前体物质和影响发酵环境,作为优势菌群具有重要作用,其在大曲中的含量决定着大曲的质量[13].乳酸可减少酒体刺激、延长白酒后味,在清香型白酒入口绵柔中得到体现,但乳酸含量过多会使口感酸涩,严重影响白酒风味[14][15].
清香型白酒大曲真菌在属水平的菌群分布:有孢圆酵母属(Torulaspora)、伊萨酵母属(Issatchenkia)、毕赤酵母(Pichia)、生丝毕赤酵母属(Hyphopichia)、根霉属(Rhizopus)、双足囊菌属(Dipodascus)、曲霉(Aspergillus)、横梗霉属(Lichtheimia)、念珠菌(Candida)、酵母菌(Saccharomyces)、丝孢酵母属(Trichosporon)等,其他菌群丰度占总菌群的0.7 %.真菌在属水平不存在未得到分类注释的菌群.其中孢圆酵母属、伊萨酵母属、毕赤酵母为真菌属水平的优势菌属,分别占52.6%、33.5%和9.7%,孢圆酵母属在真菌菌群属水平占有绝对优势.从真菌属水平菌群结构上看,大多菌属为酵母菌、根霉和曲霉等,其中酵母菌发酵能力较强,根霉和曲霉系主要糖化菌,可为酿造过程提供发酵动力[16][17],这些真菌在提高高粱的利用率和白酒出酒率方面具有重要的作用.
2.5 微生物功能基因预测分析
2.5.1 细菌功能基因预测
PICRUSt 是一种利用16S rDNA 预测功能基因组成及含量的生物信息学工具,其能够更好地分析样本的功能信息. 在COG(Clusters of Orthologous Groups,直系同源簇数据库)功能数据库进行预测,得出预测结果.
从样品细菌中注释到了4 167 个COG,如表4,这些COG 存在23 个功能类别中.其中氨基酸转运与代谢、碳水化合物运输和代谢、转录、一般功能预测在样品中均高表达,而RNA 的加工与修饰、染色质结构与动力学、真核细胞的细胞外结构、核外结构、细胞骨架的表达则相对较低.细菌中氨基酸转运与代谢、碳水化合物运输和代谢的高表达,究其原因可能与清香型堡子酒大曲制作工艺有关,堡子酒大曲以大麦、豌豆等为主要原料,酿造过程中需微生物进行发酵分解[18][19].

表4 COG 二级分类功能预测结果
2.5.2 真菌功能基因预测
采用FUNGuild 预测清香型白酒大曲样品真菌群落的营养型和功能群,预测结果如表5.样品大曲被鉴定出三种营养型,分别为病理营养型(Pathotroph)、腐生营养型(Saprotroph)以及共生营养型(Symbiotroph),占比分别为34.2%、17.7%、14.3%,其余为FUNGuild 暂不可鉴别的功能群. 从营养型来说,样品中真菌以病理营养型为主,占比显著高于腐生营养型和共生营养型,反映出清香型白酒大曲有利于病理营养型真菌的生长.样品大曲共有6 个功能群从真菌中鉴定出来,分别为动物病原 菌(Animal Pathogen)、 植 物 病 原 菌(Plant Pathogen)、未定义腐生真菌(Undefined Saprotroph)、土壤腐生真菌(Soil Saprotroph)、动物内生真菌(Animal Endosymbiont)、内生真菌Endophyte),其中动物病原菌和未定义腐生真菌在样本大曲中活性较高.样品中未被鉴别出的真菌占比38.3%,可见清香型白酒大曲真菌的功能存在一定的复杂性,对此部分真菌仍待深入研究.
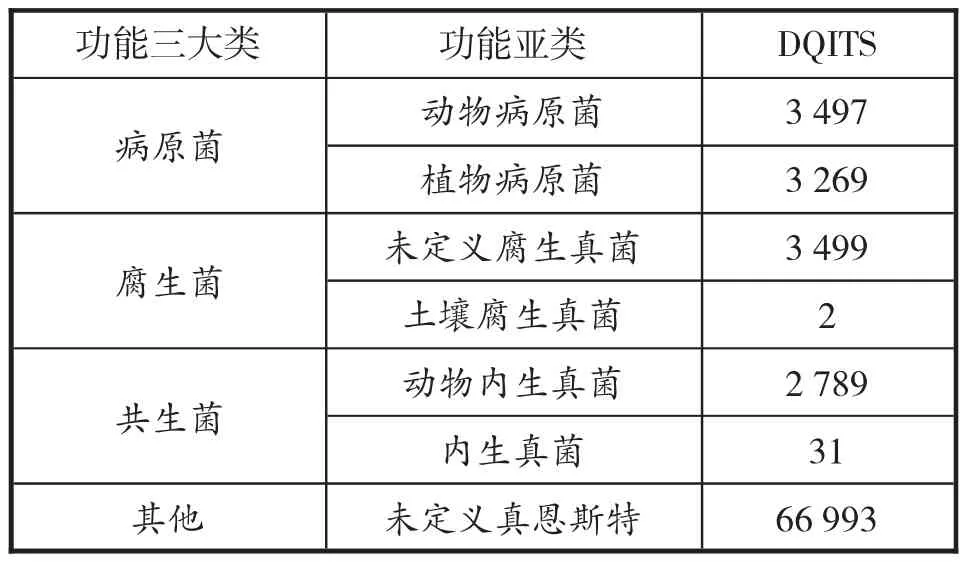
表5 真菌功能分类
3 结论
本研究通过高通量测序技术分析了清香型白酒大曲微生物的菌群特征,阐明了样品大曲中微生物群落结构,并对微生物进行了功能基因预测.通过测序对大曲样品进行分析,得出大曲中细菌和真菌在各水平的菌群分布情况存在差异性,细菌丰富度和均匀程度较真菌高;对样品进行物种组成分析,得出在门水平细菌中变形菌门、厚壁菌门和蓝细菌门为细菌门类的优势菌群,占比为43.8 %、37.7%、13.5%.
真菌中子囊菌门为门水平绝对优势菌群,占比为99.1%.在属水平中泛菌属、乳酸杆菌属、链霉菌属为细菌属水平的优势菌属,占比35.4%、17.5%和13.5%.孢圆酵母属在真菌菌群属水平占有绝对优势,占比为52.6%.对样品进行功能基因预测分析,得出细菌中氨基酸转运与代谢、碳水化合物运输和代谢、转录、一般功能预测表达水平高;真菌被鉴定出三种营养型和六个功能群.
