基于光学相干断层扫描血管成像技术智能预测先天性心脏病围术期转归的临床研究
2022-06-21李聪孔令聪胡联亭袁海云任赟赵翰鹏王艳陈炫卉刘华章况宇梁会营余洪华杨小红
李聪 孔令聪 胡联亭 袁海云 任赟 赵翰鹏 王艳陈炫卉 刘华章 况宇 梁会营 余洪华 杨小红
1华南理工大学医学院(广州 510006);2广东省人民医院,广东省医学科学院,广东省眼病防治研究所眼科(广州 510080);3广东省人民医院,广东省医学科学院医学大数据中心(广州 510080);4广东省人民医院,广东省医学科学院,广东省心血管病研究所心外科,广东省华南结构性心脏病重点实验室(广州 510080);5汕头大学医学院(广东汕头 515041);6南方医科大学(广州 510000)
先天性心脏病(congenital heart disease,CHD)是最常见的先天性畸形,全球约1%的活产儿受其影响,每年约有26 万名患儿因CHD 死亡[1]。在我国,每年新增CHD 患者可高达15~20 万[2],给患者家庭及社会带来严重的负担。随着手术及围术期监护技术的进步,CHD 生存率有了显著提高,但围术期不良结局事件仍是增加医疗费用和术后死亡风险的重要原因[3]。因此术前开展CHD 围术期转归预测对制定医疗策略、优化资源配置及提高医疗质量有重要意义。然而,传统的CHD 转归评估系统需依赖大量的临床个体数据且应用复杂[4],目前尚缺乏便捷有效的围术期转归评估方法。
眼底作为人体唯一可直视的活体血管窗口,是观察全身微循环的重要媒介。光学相干断层扫描血管成像(OCTA)不仅能够无创高分辨率地成像眼底不同分层的血管情况,而且能够便捷地观察到毛细血管级别的微血管调节,已被广泛证实与心血管疾病的发生发展密切相关[5]。早期研究显示,微循环灌注不足与CHD 术后并发症的发生密切相关[6-7],提示微循环监测在CHD 转归预测中的重要价值。前期研究中[8-9]已利用OCTA 发现,CHD 患者眼底微循环灌注不良与全身缺氧程度密切相关,并且CHD 术前眼底微循环低灌注与体外循环时间及术后住院时间的延长具有显著相关性。因此,基于OCTA 的无创便捷眼底检查方式有望成为评估CHD 围术期转归的新途径。
近几年,人工智能在眼底影像数据的挖掘和应用发展迅速[10-11],在识别全身病相关眼底影像改变领域具有极大的潜力,但既往研究主要集中在眼底二维成像模式,关于OCTA 的研究较少。本研究首次利用术前OCTA 图像联合人工智能构建CHD 围术期转归预测模型,以探究基于OCTA 图像的智能模型在CHD 转归预测中的应用价值。
1 资料与方法
1.1 一般资料 本研究为前瞻性研究,遵循赫尔辛基宣言,收集患者资料前均签署纸质知情同意书,在广东省人民医院医学伦理委员会监督下开展(伦理编号:GDREC2018148H(R1))。收集2017年5月至2021年5月拟于我院行CHD 矫正手术患者的临床资料和术前OCTA 图像。随访收集患者围术期失血量、术后死亡、早期并发症及术后住院时间等转归相关资料。
1.2 纳入与排除标准 纳入标准:(1)术前经超声心动图或心血管造影等确诊为CHD;(2)拟行体外循环心脏矫正术;(3)全身条件可配合眼科检查。排除标准:(1)眼内压>21 mmHg;(2)青光眼、视网膜疾病或其他眼底疾病病史;(3)眼内手术史;(4)其他先天性疾病病史;(5)高血压、糖尿病、脑卒中或血液系统疾病等全身病史。
1.3 OCTA 图像的获取与标注 每位患者均在术前行双眼OCTA 检查(RTVue-XR avanti;optovue,fremont,CA,USA),扫描模式选择为以黄斑中心凹为中心扫描的黄斑6×6 mm2高清扫描模式及以视盘为中心扫描的视盘4.5 × 4.5 mm2高清扫描模式。OCTA 图像排除标准:(1)图像质量指数<6;(2)残余伪影;(3)分层错误;(4)缺失任意一层图像;(5)合并眼部病变。
根据有无发生围术期不良转归进行OCTA 图像的标注。主要结局是术后过度失血,定义为术后24 h 内失血量>75 百分位数。次要结局是围术期复合不良结局,定义为发生术后死亡、欧洲胸外科先心数据库定义的术后早期并发症及术后住院时间>14 d 中的任意一项。
1.4 数据预处理与划分 选取黄斑和视盘部位的OCTA 图像,为充分利用眼底OCTA 图像信息,纳入了黄斑和视盘不同分层的图像,每只眼共有8 张有效OCTA 图像,其图像大小均为400×400 像素。同一眼的8 张OCTA 图像被顺序叠加在一起,共同组成一张8 通道的图像。
将入组的CHD 患者按照4∶1 的比例,随机划分成训练集和测试集,划分过程中最大程度的保证阳性和阴性样本的占比在训练集和测试集中保持一致。由于训练数据样本量较少且存在数据不均衡问题,故使用两阶段数据增强来扩充训练集样本量,同时平衡阳性和阴性样本的占比。
第一阶段使用50%概率的上下翻转以及左右翻转等经典数据增强技术对阳性样本进行扩充,使阳性样本量与阴性的样本量大致平衡。第二阶段使用拼接增强对训练集进行扩充[12],使训练集中的阳性样本量达到13 144 256(2363),阴性样本量达到11 697 083(2273),合计24 841 339,其可以保证对深度学习模型参数进行充分的优化更新。同时,为了将测试集中OCTA 图像的通道数与训练集统一,测试集中的图像在深度方向上被重复叠加3 次。
1.5 基于OCTA图像的转归预测模型的构建 本研究使用了基于卷积神经网络的ResNet50 变体来建立模型以处理图像信息并进行预测(图1)。基于术前OCTA 图像构建两个预测模型:过度失血预测模型和复合不良结局预测模型。模型中将首层的输入通道修改为24,以匹配经过数据增强后的OCTA图像,并以前馈神经网络代替ResNet50 的全连接层,用于输出预测结果。其余层保留了ResNet50 的原始结构,并采用迁移学习初始化其参数,减小训练难度。本实验使用的深度学习框架是PyTorch,其支持图形处理器(GPU)运算。用于训练的GPU为显卡内存12 GB 的NVIDIA RTX3060。
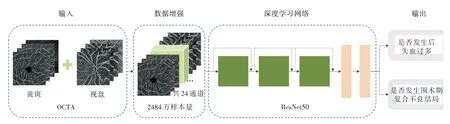
图1 基于OCTA 图像和深度学习的先天性心脏病围术期转归预测模型Fig.1 Perioperative outcome prediction model for congenital heart disease based on OCTA images and deep learning
1.6 统计学方法 使用SPSS 25.0 软件分析数据。根据Shapiro-Wilk 检验检测数据的正态性,符合正态分布的计量资料表示为均数±标准差,两组间比较使用独立样本t检验。计数资料表示为例数和百分数,比较采用χ2检验。利用准确率、灵敏度、特异度和受试者工作特性曲线下面积(AUC)评价模型的性能。以P<0.05 为差异具有统计学意义。
2 结果
2.1 基本临床资料 本研究纳入了210 例行体外循环CHD 矫正术的患者,排除合并眼部疾病的8 例,选择质量佳且分层正确的眼别的图像,最终共纳入202 例患者369 眼的临床资料和术前OCTA图像,其中女119 例,男83 例,年龄5 ~64 岁,平均(26 ± 13)岁。发生术后过度失血的患者共45 例79 眼(22.3%),发生围术期复合不良结局的患者共58例87眼(28.7%)。在202例患者369眼中,153例286 眼用于模型训练,49 例83 眼用于模型性能评估。在两个数据集中,有无发生不良转归患者在年龄、性别等基本特征差异均无统计学意义(表1)。
表1 训练集和测试集受试者的临床特征Tab.1 Clinical characteristics of participants in training and test dataset ±s

表1 训练集和测试集受试者的临床特征Tab.1 Clinical characteristics of participants in training and test dataset ±s
训练集是否发生术后过度失血是 否t/χ2值P 值是否发生术后复合不良结局是 否t/χ2值P 值测试集是否发生术后过度失血是 否t/χ2值P 值是否发生术后复合不良结局是 否t/χ2值P 值例数34 119 43 110 11 38 15 34眼数(只)59 227 67 219 20 63 22 61年龄(岁)26.68±11.44 25.26±13.88 0.54 0.58 27.12±12.96 25.92±12.15 0.54 0.59 27.36±7.50 26.53±11.18 0.23 0.81 24.60±18.47 24.59±11.42 0.01 0.99性别(女/男,例)21/13 71/48 0.05 0.83 28/15 60/50 1.41 0.23 4/7 23/15 1.16 0.28 7/8 24/10 2.56 0.11
2.2 预测模型的性能评估 基于术前OCTA 图像和深度学习构建了两个CHD 围术期转归预测模型并评估了模型性能。其中,术后过度失血预测模型在测试集中的AUC 为0.82,灵敏度为0.90,特异度为0.75,准确率为0.78;围术期复合不良结局预测模型在测试集中的AUC 为0.81,灵敏度为0.83,特异度为0.80,准确率为0.81。两个围术期转归预测模型均表现出较为优异的预测性能(图2)。
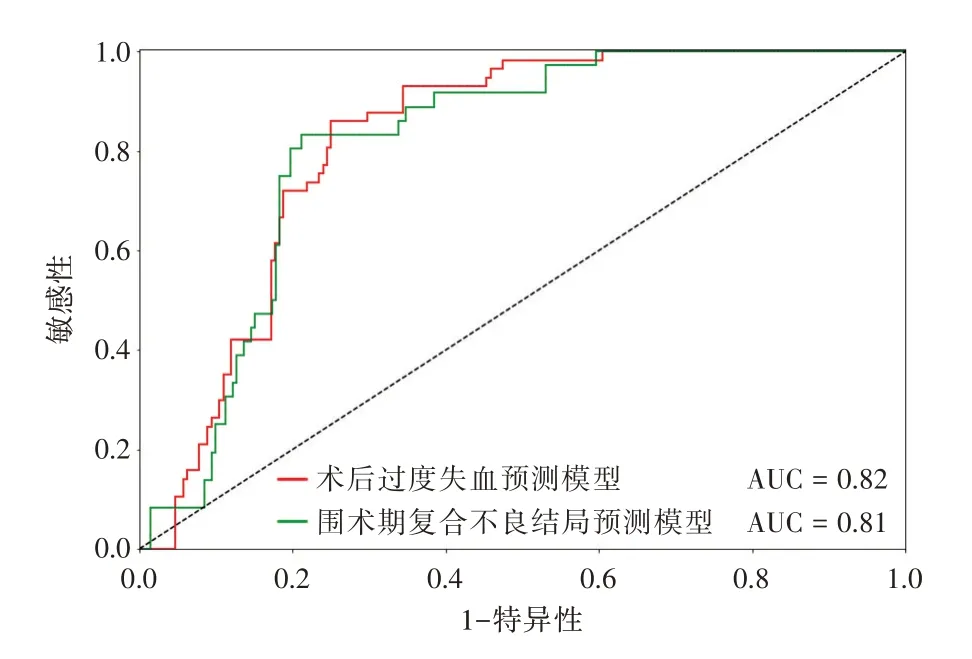
图2 人工智能模型预测先天性心脏病围术期不良转归的ROC 曲线Fig.2 ROC curve of intelligent models in prediction of adverse perioperative outcomes of congenital heart disease
3 讨论
手术是治疗CHD 的主要手段,随着手术及监护技术的改进,CHD 患者的生存率得到了显著改善,但围术期不良结局事件的发生仍是影响患者生存率和生活质量的重要因素。目前,探讨一种便捷、精准的CHD 转归预测策略,一直是心外科医生关注的重点和热点[13]。微循环是止凝血、炎症反应及稳态调节的重要场所,在心脏手术转归中起到重要作用[14]。既往研究显示早期微循环的灌注不足可预测术后并发症的发生,并且术后早期微血管反应性的降低与术后过度失血也是密切相关的[15-16],这提示着术前微循环的评估可能是建立CHD 手术患者个性化治疗策略的有效工具。但目前针对CHD 矫正术的研究较少。
目前,大部分手术转归预测模型都是基于回归模型建立的。既往有研究利用机器学习建立了CHD 转归预测模型,但需要结合大量临床信息,且应用较为复杂,难以进行推广应用。ZENG 等[17]基于2 308 例CHD 患者手术数据,利用XGBoost 机器学习开发并验证了术后并发症预测模型,其AUC达到0.82,但该模型中包含体外循环时间等术中因素,不适于术前进行转归预测,临床医生难以根据预测模型制定个性化治疗策略。宋晓琪等[18]综合手术复杂性和年龄、影像及实验室检查等术前危险因素,利用机器学习建立CHD 患者术后住院病死率的预测模型,AUC 可达到0.889,但该模型术前因素中实验室检查需有创,且需依赖大量的临床个体数据,仍需进一步探索更为便捷无创的CHD 手术转归评估方式。
眼部血管与心脏微循环具有许多相似的解剖和生理特征,为评估心脏手术患者的全身微循环提供了一个无创便捷的窗口。既往大量研究已证实眼部微循环可提供心血管疾病发生发展的相关信息并能用于预测未来心血管事件的风险[19-20]。此外,眼底微循环监测手段无创便捷,可用作心血管疾病的新型筛查、诊断和预后工具。利用眼底微循环监测CHD 不良转归将具有巨大的应用前景。
近年来,人工智能在眼科图像及大数据处理方面取得了突破性进展。眼睛作为无创的全身微循环观察窗口,现有研究不仅仅关注在眼病本身,更多的是探索眼睛这个窗口在全身疾病中的应用价值。但现有的眼科人工智能研究主要集中在眼底照相等二维成像技术,其中包含的血管信息十分有限,并且眼底照相成像的主要是眼底较大血管级别,无法提供全面的微循环信息。本研究所使用的OCTA 是一种新型的无创微循环监测工具,可快速重建眼部血管的三维结构且无需注射造影剂,现已广泛用于心脑血管疾病的微循环监测[21]。本研究利用术前OCTA 图像和深度学习建立的转归预测模型,可高效预测CHD 患者的围术期不良转归,利用单一眼底图像的AUC 即可达到0.82,为CHD 转归预测提供了新思路。利用该模型可辅助提升心外科医生对术后转归不良的高风险患者的早期识别和筛选能力,从而在术前对高风险患者进行针对性的干预,降低围术期不良事件的发生,极大改善患者的预后。
基于微循环与心脏手术预后的强相关性及本课题组前期利用OCTA 观察CHD 患者视网膜微循环的研究结果,本研究创新性地结合术前OCTA图像和人工智能技术建立了CHD 围术期转归预测模型,为CHD 围术期转归评估提供了新思路和新方法。但本研究也存在一定的局限性:首先,由于CHD 患病率较低且OCTA 是一种相对较新的眼科成像技术,本研究入组的CHD 患者样本量较小,虽然本研究采用数据增强等技术进行了数据扩增,但仍需扩大样本量进行进一步的研究。其次,本研究的阳性样本相对较少,高敏感度是预测样本不均任务中最需要的特性之一,预测模型均具有较高的敏感度,因此避免了模型因样本不均而忽略阳性样本的问题。此外,本研究建立的模型的预测性能相对既往研究较低,但是本研究模型输入的仅仅是单一眼底图像,而既往的模型输入的是大量临床个体数据,未来在本模型中加入一些临床易得的指标将有望提高模型的预测性能。最后,本研究建立的预测模型未经过独立外部测试集进行验证,将在后续研究中进行多中心的外部验证证实模型稳定性和效能,同时也将收集不同机型的OCTA 图像,提升模型泛化能力和临床普适性。
综上所述,基于术前OCTA 图像和深度学习建立的CHD 围术期转归智能预测模型可达到较好的预测性能,有望用于辅助CHD 患者的诊疗实践。但目前研究只是单中心、小样本的研究,未来仍需要扩大样本量并进行外部验证进一步验证模型的跨医疗机构、跨人群的泛化能力。
