黄芪甲苷上调miR-199a-5p表达抑制氧糖剥夺/再灌注诱导的神经干细胞凋亡
2022-06-21李钰丁文倩李琳许家栋方燕杨琰胡小伟储利胜
李钰 丁文倩 李琳 许家栋 方燕 杨琰 胡小伟 储利胜
浙江中医药大学基础医学院 杭州 310053
缺血性脑卒中是中枢神经系统常见疾病,也是成年人致死致残的主要原因。目前,组织型纤溶酶原激活剂是临床治疗脑缺血的唯一有效药物,但治疗时间窗狭窄和颅内出血的风险限制了其临床应用[1]。研究表明,内源性神经发生或神经干细胞移植可促进脑缺血后神经修复和神经功能恢复[2-3],然而脑缺血损伤区的微环境导致细胞大量死亡,限制了其疗效[4]。因此,促进神经干细胞存活为脑缺血的治疗提供了一个有效策略。
黄芪是中医临床治疗脑缺血的常用中药,黄芪甲苷是黄芪的主要有效成分之一。既往研究发现,黄芪甲苷对脑缺血急性期损伤具有保护作用[5]。最近研究发现,黄芪甲苷能促进氧糖剥夺/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)损伤的神经干细胞增殖和分化[6],增强脑缺血后神经发生和神经功能恢复[7-8],还能促进移植的神经干细胞增殖和分化,改善阿尔茨海默病模型大鼠的认知能力[9],但具体机制尚不完全清楚。微小核糖核酸(microRNA,miR)是一类长度为19~22个的核苷酸的单链非编码RNA,通过与靶基因mRNA的3’端非翻译区不完全或完全互补结合,抑制mRNA翻译或使其降解,从而负性调控靶基因表达[10]。近年来研究证实,miRNA调控神经干细胞增殖、分化、迁移和凋亡等过程[11-12]。 研究发现,miR-199a-5p在脑内广泛表达[13],脑和脊髓缺血再灌注损伤后miR-199a-5p表达减少,miR-199a-5p过表达抑制神经细胞凋亡[14-15]。上述研究提示miR-199a-5p可能介导脑缺血后神经干细胞凋亡。本研究旨在体外观察黄芪甲苷是否通过上调miR-199a-5p缓解OGD/R诱导的神经干细胞损伤,为脑缺血后的临床治疗提供指导。
1 材料和方法
1.1 材料
1.1.1 动物 无特定病原体(specific pathogen free,SPF)级孕14 d雌性SD大鼠,购于上海西普尔-必凯实验动物有限公司[实验动物生产许可证号:SCXK(沪)2018-0006],饲养于浙江中医药大学实验动物中心[实验动物使用许可证号:SYXK(浙)2018-0012]。饲养环境温度(22±1)℃,相对湿度40%~60%,12 h/12 h明暗循环,自由进食和饮水。本研究严格按照动物实验伦理规范进行实验(伦理审查批准号:ZSLL-2017-111)。
1.1.2 主要试剂 黄芪甲苷(纯度为97.4%)购于中国食品药品检定研究院(批号:110781-201616);DMEM/F12培养基购于杭州吉诺生物医药技术有限公司(批号:17011001);胎牛血清、B-27和表皮生长因子(epidermal growth factor,EGF)均购于美国Gibco公司(批号:1527494、1827407、1745454);碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)购于美国PeproTech公司(批号:1860104);脂质体2000购于美国Thermo Fisher Scientific公司 (批号:1854316);Accutase和5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU)均购于美国Sigma公司(批号:SLBS1935V、HMBD8875V);绵羊多克隆BrdU抗体购于美国Abcam公司(批号:GR3380504-2);小鼠单克隆抗体巢蛋白(Nestin)和小鼠单克隆抗体神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)均购于美国Santa Cruz公司 (批号:B2515、A2510);兔多克隆抗体神经元特异性核蛋白(neuronal nuclei,NeuN)购于美国Millipore公司 (批号:3305071);兔切割型半胱氨酸天冬氨酸蛋白水解酶-3(cleaved caspase-3)多克隆抗体和兔caspase-3多克隆抗体均购于美国Cell Signaling Technology公司(批号:07、08);小鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 单克隆抗体购于杭州华安生物技术有限公司(批号:HO0408);异硫氰酸荧光素标记磷脂结合蛋白/碘化丙啶(Annexin-fluorescein isothiocyanate isomer/propidium iodide,Annexin Ⅴ-FITC/PI)细胞凋亡检测试剂盒购于美国BD公司(批号:4293719);Trizol试剂购于 德 国 QIAGEN 公 司 (批 号 :55708000);Mir-XTMmiRNA First-Strand Synthesis Kit和SYBR Premix Ex TaqTMⅡ试剂盒购于宝生物工程(大连)有限公司(批号:1701060A、AKA1005);miR-199a-5p拮抗剂和miR-199a-5p拮抗剂对照购于广州锐博生物科技有限公司(批号:1518697130、111439753)。
1.1.3 主要仪器 4111型二氧化碳培养箱购于美国Thermo Fisher Scientific公司;27310型缺氧小室购于美国Stemcell公司;ELx800型全自动酶标仪购于美国Bio-Tech公司;C6型流式细胞仪为美国BD公司产品;DMIL型倒置荧光显微镜购于德国Leica公司;Light-Cycler 96型实时荧光定量聚合酶链式反应(Realtime quantitative polymerase chain reaction,Realtime qPCR)仪为美国Roche公司产品;T100型RNA反转录仪、PowerPacTMBasic型垂直电泳转膜系统和FluorChem Q型凝胶成像系统均购于美国Bio-Rad公司。
1.2 方法
1.2.1 神经干细胞分离、原代培养与传代 取14 d胎鼠的大脑皮层,切成1 mm3的组织块,0.25%胰酶消化15 min,经200目筛网过滤,1 000 r/min离心5 min后弃上清液,以神经干细胞完全培养基(DMEM/F12+2%B27+20 ng·mL-1EGF+20 ng·mL-1bFGF+1%青-链霉素)重悬,接种于培养瓶中,置于37℃、5%CO2培养箱中培养,前3 d每天换液,待神经球形成后,2~3 d换液1次。 1周后传代,每3 d换液1次,每7~8 d传代1次,将第3~5代细胞用于后续实验。
1.2.2 神经干细胞鉴定
1.2.2.1 神经干细胞标志物检测 将神经干细胞球经Accutase消化成单细胞悬液,以每孔2×104个细胞的数量接种到0.1 mg·mL-1多聚赖氨酸包被的96孔板,正常贴壁培养24 h后进行后续实验。4%多聚甲醛固定30 min,0.1%聚乙二醇辛基苯基醚(Triton X-100)处理细胞15 min,10%山羊血清封闭1 h,加小鼠Nestin单克隆抗体 (稀释比例:1∶100),4 ℃孵育过夜,加入FITC标记的山羊抗小鼠二抗(稀释比例:1∶100)孵育1 h,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)复染,封片,倒置荧光显微镜下观察并拍照。每组设5个平行复孔,每孔随机取3个不同视野,对Nestin标记细胞进行计数,取平均值作为测量值。
1.2.2.2 神经干细胞增殖特性检测 以BrdU/Nestin免疫荧光双标染色检测神经干细胞增殖特性。将神经干细胞以每孔2×104个细胞的数量接种于96孔板,在神经干细胞完全培养基中加入终浓度为10 μmol·L-1的BrdU培养24 h。以4%多聚甲醛固定30 min,0.1%Triton X-100破膜15 min,2 mol·L-1氯化氢变性30 min,0.1 mol·L-1硼酸于室温下中和反应10 min,3%过氧化氢灭活内源性过氧化物酶20 min,5%驴血清封闭1 h,加入绵羊BrdU多克隆抗体(稀释比例:1∶200)及鼠Nestin抗体(稀释比例:1∶100),4 ℃孵育过夜,加Cy3标记驴抗绵羊二抗(稀释比例:1∶100)和FITC标记驴抗鼠二抗(稀释比例:1∶100),37 ℃避光孵育1 h,DAPI复染,封片,倒置荧光显微镜观察并拍照。每组设5个平行复孔,每孔随机取3个不同视野,对双标记细胞进行计数,取平均值作为测量值。
1.2.2.3 神经干细胞分化能力检测 以NeuN、GFAP免疫荧光染色检测神经干细胞分化为神经元和星形胶质细胞的情况。神经干细胞用无定向分化培养基(DMEM/F12培养基+1%胎牛血清)培养7 d,4%多聚甲醛固定30 min,0.1%TritonX-100破膜15 min,10%羊血清封闭1 h,加入兔NeuN多克隆抗体(稀释比例:1∶100)及小鼠GFAP单克隆抗体(稀释比例:1∶100),4℃避光孵育过夜后,加入FITC标记羊抗兔二抗(稀释比例:1∶100)和Cy3标记羊抗小鼠二抗(稀释比例:1∶100),37 ℃孵育1 h,DAPI复染,封片,倒置荧光显微镜观察并拍照。每组设5个平行复孔,每孔随机取3个不同视野,细胞数计数,取平均值作为测量值。
1.2.3 OGD/R模型的建立 参照文献[16]中的方法,神经干细胞经Accutase消化成单细胞悬液,以每孔2×104个细胞的数量接种于96孔板,培养24 h后将DMEM/F12培养基更换为无糖培养基,并将细胞置于缺氧小室中,以三元混合气(94%N2、5%CO2、1%O2)培养8 h,然后更换为正常细胞培养基,37℃,5%CO2培养箱中继续培养72 h。正常对照组采用正常培养基,在37℃,5%CO2培养箱中培养相同时间。
1.2.4 细胞分组与干预措施 除正常对照组外,将神经干细胞消化成单细胞悬液后重悬,并按1×106个/mL的数量接种于6孔板,分为模型对照组、黄芪甲苷组、黄芪甲苷+miR-199a-5p拮抗剂组(拮抗剂组)、黄芪甲苷+miR-199a-5p拮抗剂对照组 (拮抗剂对照组)。采用脂质体2000,将miR-199a-5p拮抗剂及对照转染到神经干细胞,具体方法参照说明书进行。转染前1 d,神经干细胞经Accutase消化成单细胞悬液,按1×106个/mL的数量接种于6孔板,待细胞融合到70%~80%时转染。 转染前,取4 μL的脂质体2000,以96 μL的Opti-MEM培养基稀释;10 μL拮抗剂或拮抗剂对照以90 μL的Opti-MEM培养基稀释,然后将两者混匀,室温孵育15 min,将混合液加至不含抗生素的完全培养基中,拮抗剂和拮抗剂对照转染浓度均为100 nmol·L-1。 将细胞放置在37 ℃、5%CO2的培养箱中培养4 h后换液,继续培养24 h后,进行OGD/R干预,再灌注时加入黄芪甲苷处理72 h。
1.2.5 细胞活性检测 采用2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐[2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfonic acid benzene)-2H-tetrazole monosodium salt,CCK-8]法检测黄芪甲苷对正常神经干细胞活性的影响。神经干细胞以Accutase消化成单细胞悬液,以每孔2×104个细胞的数量接种于96孔板中,每孔100 μL。神经干细胞OGD干预8 h后,分别加入含0、1、10、25、50、100、200 μmol·L-1黄芪甲苷的正常培养基孵育72 h,每孔加入10 μL CCK-8溶液继续培养4 h,酶标仪450 nm测定每孔的吸光度值,计算细胞存活率。细胞存活率(%)=(各组吸光度值-空白孔吸光度值)/(正常对照组吸光度值-空白孔吸光度值)×100%。每组设5个平行复孔。
1.2.6 Annexin Ⅴ-FITC/PI双染法检测神经干细胞凋亡 各组细胞以Accutase消化成单细胞悬液,并接种于6孔板(数量为1×106个/mL)中,每组设3个复孔,按照试剂盒说明书进行操作。4℃预冷磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤两次,加入5 μL Annexin Ⅴ-FITC,稍混匀后避光孵育15 min,再加入5 μL PI染液避光孵育5 min,加入300 μL结合缓冲液混匀,流式细胞仪检测细胞凋亡率。
1.2.7 Real-time qPCR检测miR-199a-5p基因表达采用Trizol法提取总RNA,按照Mir-XTMmiRNA First-Strand Synthesis Kit试剂盒说明书进行逆转录,反应条件为:37℃ 60 min,85℃ 5 s。按照SYBR Premix Ex TaqTMⅡ 试剂盒说明书进行PCR,反应条件为:95℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。以U6为内参,采用2-△△Ct法计算基因相对表达量。每个样品设3个复孔,引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.2.8 免疫印迹法检测caspase-3、cleaved caspase-3蛋白表达 收集各组细胞,加入200 μL蛋白裂解液,冰上裂解30 min,4 ℃下12 000 r/min离心15 min,取上清液,二喹啉甲酸(bicinchoninic acid,BCA)法测定总蛋白含量。取20 μg蛋白样品进行凝胶电泳,恒流转膜2 h,常温下5%牛血清白蛋白(bovine albumin,BSA)封闭2 h,加入兔caspase-3多克隆抗体(稀释比例:1∶1 000)、兔cleaved caspase-3多克隆抗体(稀释比例:1∶1 000)和小鼠GAPDH单克隆抗体(稀释比例:1∶1 000),4℃孵育过夜;洗膜后分别加入羊抗兔辣根过氧化物酶IgG和羊抗鼠辣根过氧化物酶IgG(稀释比例:1∶5 000),室温孵育2 h;化学发光底物显色,Bio-Rad成像系统显影成像,采用Image J软件分析各条带的灰度值,结果用cleaved caspase-3/caspase-3灰度值比值表示。
1.3 统计学分析 采用SPSS 25.0统计软件进行统计学分析。计量资料以±s表示。多组样本均数之间比较采用单因素方差分析,组间两两比较采用Student-Newman-Keuls法。以P<0.05为差异有统计学意义。
2 结果
2.1 神经干细胞的体外培养与鉴定 神经干细胞呈悬浮状态,聚集成球,中心变暗,折光性好。见图1A。Nestin免疫荧光染色结果显示,神经干细胞阳性率约为98.41%。见图1B。神经干细胞增殖检测显示,BrdU/Nestin阳性细胞百分比约为17.14%。见图1C。神经干细胞分化检测结果显示,神经干细胞约19.32%分化为神经元(NeuN阳性细胞),约67.83%分化为星形胶质细胞(GFAP阳性细胞)。见图1D。上述结果提示,所培养的细胞为神经干细胞。
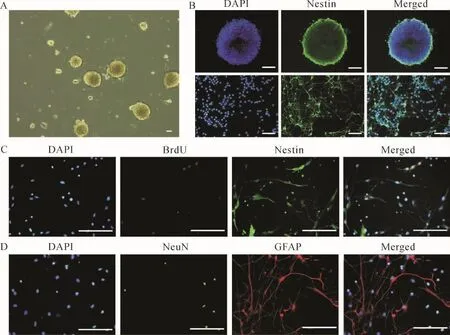
图1 神经干细胞的体外培养与鉴定Fig.1 Culture and identification of neural stem cells in vitro
2.2 黄芪甲苷促进OGD/R损伤的神经干细胞存活首先评价黄芪甲苷对正常培养的神经干细胞活性影响。黄芪甲苷处理72 h后,与正常对照组比较,黄芪甲苷(1~100 μmol·L-1)干预后神经干细胞活性差异无统计学意义(P>0.05),但200 μmol·L-1黄芪甲苷抑制了神经干细胞活性(P<0.01)。 见图2A。
然后观察黄芪甲苷对OGD/R损伤的神经干细胞活性的影响。神经干细胞OGD/R处理后,与正常对照组比较,模型对照组神经干细胞活性下降(P<0.01);与模型对照组比较,50 μmol·L-1和100 μmol·L-1黄芪甲苷组 神经 干 细胞 活性 提 高(P<0.01,P<0.05),且50 μmol·L-1黄芪甲苷效果最佳,因此选取该浓度用于后续实验。见图2B。

图2 黄芪甲苷促进OGD/R损伤后神经干细胞的存活Fig.2 Astragaloside Ⅳ promotes the survival of neural stem cells after OGD/R injury
2.3 黄芪甲苷抑制OGD/R诱导的神经干细胞凋亡 流式细胞术检测结果表明,与正常对照组比较,模型对照组细胞凋亡率显著增加(P<0.01);与模型对照组比较,黄芪甲苷组(50 μmol·L-1)处理后神经干细胞凋亡率显著减少(P<0.01)。 见图3。 结果提示,黄芪甲苷抑制OGD/R诱导的神经干细胞凋亡。

图3 黄芪甲苷抑制OGD/R诱导的神经干细胞凋亡Fig.3 Astragaloside Ⅳ inhibits apoptosis of neural stem cells after OGD/R injury
2.4 黄芪甲苷通过上调miR-199a-5p促进OGD/R损伤的神经干细胞存活 Real-time qPCR结果提示,与正常对照组比较,模型对照组miR-199a-5p表达显著下调(P<0.01);与模型对照组比较,黄芪甲苷组(50 μmol·L-1)处理后miR-199a-5p表达显著上调(P<0.01)。见图4A。采用脂质体2000将miR-199a-5p拮抗剂转染到神经干细胞,Real-time qPCR结果提示,神经干细胞miR-199a-5p表达显著下降约60.53%(P<0.01)。 见图4B。
采用CCK-8检测黄芪甲苷对转染后神经干细胞活性的影响。结果表明,与正常对照组比较,模型对照组神经干细胞活性显著降低(P<0.01);与模型对照组比较,黄芪甲苷(50 μmol·L-1)处理后神经干细胞活性显著升高(P<0.01);与黄芪甲苷组比较,拮抗剂组神经干细胞活性显著降低(P<0.01);拮抗剂对照组神经干细胞活性与黄芪甲苷组差异无统计学意义(P>0.05)。 见图4C。

图4 黄芪甲苷通过上调miR-199a-5p促进OGD/R损伤的神经干细胞存活Fig.4 Astragaloside Ⅳ promotes the survival of neural stem cells by up-regulating miR-199a-5p after OGD/R injury
2.5 黄芪甲苷通过上调miR-199a-5p抑制OGD/R诱导的神经干细胞凋亡 流式细胞术检测结果表明,与正常对照组比较,模型对照组神经干细胞凋亡率显著增加(P<0.01);与模型对照组比较,黄芪甲苷(50 μmol·L-1) 处理后神经干细胞凋亡率显著减少(P<0.01);与黄芪甲苷组比较,拮抗剂组神经干细胞凋亡率显著增加(P<0.01);拮抗剂对照组神经干细胞凋亡率与黄芪甲苷组差异无统计学意义(P>0.05)。见图5。

图5 黄芪甲苷通过上调miR-199a-5p抑制OGD/R诱导的神经干细胞凋亡Fig.5 Astragaloside Ⅳ inhibits apoptosis of neural stem cells by up-regulating miR-199a-5p after OGD/R injury
2.6 黄芪甲苷下调OGD/R损伤的神经干细胞cleaved caspase-3蛋白表达 免疫印迹实验结果显示,各组间caspase-3表达差异无统计学意义(P>0.05);与正常对照组比较,模型对照组神经干细胞cleaved caspase-3蛋白表达显著增加(P<0.01);与模型对照组比较,黄芪甲苷(50 μmol·L-1)处理后神经干细胞cleaved caspase-3蛋白表达显著减少(P<0.01);与黄芪甲苷组比较,拮抗剂组神经干细胞cleaved caspase-3蛋白表达显著增加(P<0.01);拮抗剂对照组神经干细胞cleaved caspase-3蛋白表达与黄芪甲苷组差异无统计学意义(P>0.05)。 见图6。

图6 黄芪甲苷下调OGD/R损伤的神经干细胞cleaved caspase-3蛋白表达Fig.6 Astragaloside Ⅳ reduces cleaved caspase-3 protein expression in neural stem cells after OGD/R injury
3 讨论
内源性神经发生或神经干细胞移植能够促进脑缺血损伤修复和神经功能恢复,但损伤局部微环境导致大量神经干细胞死亡限制其疗效[4]。近年来研究证实,药物干预可以促进OGD/R损伤的神经干细胞存活,减少其凋亡,如阿伐他汀、黄芪多糖、人参皂苷Rg1和白藜芦醇能够促进OGD/R损伤的神经干细胞的存活,抑制其凋亡[16-19]。既往研究发现,黄芪甲苷能够抑制OGD/R损伤的心肌细胞、PC12细胞和神经元凋亡[20-23]。另有研究报道,黄芪甲苷能够促进OGD/R损伤的神经干细胞增殖分化和整体脑缺血损伤后内源性神经发生[6-8]。本研究结果进一步证实,黄芪甲苷促进体外OGD/R损伤的神经干细胞存活,抑制其凋亡。
miRNA参与调控神经干细胞增殖、凋亡、分化和迁移等过程[11-12]。caspase-3是天冬氨酸特异性半胱氨酸蛋白酶caspase家族成员,在凋亡程序的执行中起核心作用[24-25]。研究发现,脑和脊髓缺血再灌注损伤后miR-199a-5p表达显著减少,上调miR-199a-5p表达显著减少神经元凋亡[14-15]。低氧抑制心肌细胞表达miR-199a,过表达miR-199a则能够减少低氧诱导的心肌细胞凋亡,抑制caspase-3、caspase-6、caspase-9和caspase-12表达[26]。骨髓间充质干细胞外泌体通过转运miR-199a-5p,抑制缺血再灌注损伤诱导的肾小管上皮细胞凋亡,减少cleaved caspase-3表达[27]。内皮细胞来源的外泌体通过miR-199a-5p抑制内质网应激诱导的神经细胞凋亡和炎症反应[28]。上述结果表明,miR-199a-5p抑制缺血再灌注损伤后细胞凋亡。研究发现,黄芪甲苷通过下调miR-23a和miR-92a抑制cleaved-caspase-3表达,减少低氧诱导的心肌细胞凋亡[23];还可通过抑制miR-124下调cleaved caspase-3表达,减少低氧诱导的PC12细胞凋亡[22]。本研究发现,OGD/R处理的神经干细胞miR-199a-5p表达下降,黄芪甲苷上调miR-199a-5p表达,促进神经干细胞存活、抑制凋亡。转染miR-199a-5p拮抗剂后,黄芪甲苷的保护效应被逆转。这些结果表明,黄芪甲苷通过上调miR-199a-5p表达促进OGD/R损伤的神经干细胞存活,抑制其凋亡。
本研究采用体外OGD/R模型模拟整体脑缺血再灌注损伤。结果发现,OGD/R抑制神经干细胞存活,促进其凋亡,减少miR-199a-5p表达;黄芪甲苷促进OGD/R损伤的神经干细胞存活,抑制其凋亡,并能上调miR-199a-5p表达,下调cleaved caspase-3蛋白表达,而miR-199a-5p拮抗剂则逆转黄芪甲苷的保护作用。上述结果表明,黄芪甲苷通过上调miR-199a-5p表达抑制OGD/R诱导的神经干细胞损伤。
综上所述,本研究证实黄芪甲苷促进OGD/R损伤的神经干细胞存活、抑制神经干细胞凋亡,机制可能与其上调miR-199a-5p表达,抑制cleaved caspase-3表达有关。但黄芪甲苷上调miR-199a-5p表达保护神经干细胞缺血再灌注损伤的具体机制尚需进一步研究。
