TiO2@C核壳纳米棒薄膜光阳极的制备及其光电催化性能研究
2022-06-20李春晓李俊松何京生
李春晓,李俊松,何京生,刘 琪
(安徽工程大学 材料科学与工程学院,安徽 芜湖 241000)
能源危机和环境污染是目前中国乃至世界都亟待解决的重大问题,安全高效绿色使用太阳能和氢能等一系列新能源迫在眉睫[1]。目前光催化技术由于其安全、可靠、绿色、成本低[2]等特点,已逐渐成为缓解能源枯竭和环境污染问题最有前途的技术之一。自1972年Fujishima和Honda研究出在光照条件下TiO2光阳极能成功分解水以来[3],TiO2、ZnO、WO3、Fe2O3等半导体材料作为光阳极材料被逐渐应用起来。其中TiO2是宽n型带隙的半导体,由于其具有优异的化学稳定性、安全无污染、可循环使用、成本低廉[4]而得到了广泛的研究,但TiO2由于带隙过宽(3.0~3.2 eV)[5],可见光的光响应范围小,载流子复合速率快、寿命短等因素大大影响了TiO2在光催化领域的实际应用,所以如何改善TiO2对可见光的响应区域及降低载流子复合速率等成为其实际应用的关键问题。通常可以通过晶体结构调控[6]、元素掺杂[7]、贵金属沉积[8]和半导体复合[9]等一系列改性措施来改善和提高TiO2的光催化性能。
碳基材料具有稳定性高、成本低、导电率优良[10]等特性,与TiO2复合表现出优异的协同作用。由于碳材料可以作为TiO2光阳极的表界面修饰与改性材料,科研工作者们引入了多种结构的碳材料与TiO2光阳极复合掺杂,如活性炭(AC)[11]、石墨烯(G)[12]、碳纳米管(CNT)[13]或氧化石墨烯(GO)[14]、活性碳纤维(ACF)[15]、碳量子点[16]等并取得了很好的效果。其中葡萄糖(C6H6O6)作为最常见和最廉价的碳水化合物,是地球上含量极其丰富的生物质材料,用C6H6O6为碳源复合TiO2[17],其中C本身可作为良好的电子传输层[18],也对TiO2的表界面起到一定的修饰作用[19],能拓宽其可见光光响应区,提高载流子的分离和转移速率[20],使TiO2的光催化性能明显提高。
本文选用TiO2与C构建了新型核壳纳米棒薄膜光阳极。采用二次水热法和热处理在FTO导电玻璃基体上原位生长了均匀致密的TiO2@C核壳纳米棒薄膜光阳极,并对其微观形貌、材料结构、能带结构以及光电化学性能进行了研究。
1 实验
1.1 试剂
钛酸四正丁酯(TBT)(AR,Aladdin试剂有限公司);去离子水(H2O)(实验室自制);C6H6O6(AR,Aladdin试剂有限公司);盐酸(HCl)(国药集团化学试剂有限公司)。
1.2 实验方法
采用水热法制备TiO2纳米棒薄膜样品。首先向15 mL H2O中缓慢加入15 mL浓盐酸搅拌15 min形成混合液,之后将0.4 mL的TBT加入到水溶液中搅拌20 min至溶液变为澄清备用。最后将澄清溶液转移到装有干净FTO的定制试管中,再放入反应釜内衬后用不锈钢外衬密封拧紧,烘箱设置150 ℃保温4 h。反应结束后取出样品冲洗干净烘干备用。将一定浓度的C6H6O6水溶液加入到定制试管中,再向定制试管中放入制备好的TiO2样品,然后再放入反应釜内衬后用不锈钢外衬密封拧紧,烘箱设置180 ℃保温6 h,反应结束后取出样品冲洗干净烘干,最后N2保护烧550 ℃保温2 h。
不同浓度C6H6O6水溶液(2、4、6、8 mmol/L)制备的核壳纳米棒薄膜光阳极样品记为TiO2@C1、TiO2@C2、TiO2@C3、TiO2@C4。
2 结果与讨论
2.1 光阳极的合成
TiO2和TiO2@C核壳纳米棒薄膜光阳极的合成过程如图1所示。首先把FTO表面清洗干净并烘干,然后通过水热法在FTO导电玻璃表面制备了一层均匀致密的TiO2纳米棒薄膜阵列。通过二次水热法在TiO2纳米棒薄膜阵列表面生长了一层薄薄的致密的C层,C均匀包覆在TiO2纳米棒表面,再进行热处理最终形成了TiO2@C核壳纳米棒薄膜光阳极。

图1 TiO2和TiO2@C的合成示意图
2.2 TiO2和TiO2@C形貌与物相表征
TiO2纳米棒薄膜的SEM图如图2a所示。由图2a可以看出,纳米棒整体排列整齐致密,尺寸大小均匀,其直径为100~200 nm,纳米棒表面光滑,没有明显的颗粒物存在。制备样品的XRD图如图2b所示。除了FTO导电玻璃基体的衍射峰外,其余特征峰值分别为27.45°、36.08°、54.32°、62.74°、69.01°和69.79°,与四方晶系TiO2(JCPDS 21-1276)的(110)、(101)、(211)、(002)、(301)和(112)所在的晶面一一对应,确定样品具有金红石结构[21]。复合的样品在20°~25°之间,TiO2@C样品的峰值略有增加,表明C已成功地包覆在TiO2纳米棒上。

图2 TiO2的SEM图和TiO2与TiO2@C的XRD图
不同浓度的C6H6O6制备的TiO2@C核壳纳米棒薄膜光阳极的SEM图如图3所示。从图3中可以看出,TiO2@C纳米棒排列整齐致密,尺寸大小均匀,其直径为100~200 nm,表面复合C后,TiO2@C与纯TiO2的结构相比没有明显的变化,也并没有改变TiO2的晶体结构,依然保持纳米棒的结构特征,表明包覆的碳层是薄且均匀的。

图3 不同浓度C6H6O6制备的TiO2@C的SEM图
为进一步探究包覆碳层的厚度和碳的结构,TiO2@C核壳纳米棒薄膜光阳极的TEM图如图4所示。由图4a可知,TiO2@C单根纳米棒呈圆柱形,其直径约为180 nm,C层生长厚度约为10 nm,与SEM的图像表征的结构和尺寸吻合。
图4b的纯TiO2的晶格间距尺寸约为0.32 nm,是标准金红石相TiO2的(110)晶面。图中C层均匀地包覆在TiO2纳米棒上,证明形成了界面完整的核壳结构,而不是简单混合,进一步说明了C层与TiO2之间的良好接触,这样的核壳结构有利于电子传输。

图4 TiO2@C核壳纳米棒薄膜光阳极的TEM图
制备的TiO2@C的XPS图谱如图5所示。XPS检测光谱表明,TiO2@C核壳纳米棒薄膜光阳极由C、Ti和O 3种元素组成。在TiO2@C核壳纳米棒薄膜光阳极中O 1s有3个峰值,分别是在533.9 eV、532.8 eV和530.1 eV处的3个强峰,对应的是C=O键、C-O键和Ti-O键。Ti 2p1/2和Ti 2p3/2的XPS峰与纯TiO2的峰一致,出现在464.3 eV和458.5 eV处,这表明Ti4+的化学价与O有一个八面体配位,Ti 2p3/2和Ti 2p1/2之间的结合能差约为5.8 eV,表明Ti的化学状态为Ti4+。图中C 1s有3个峰值,在288.5 eV、286.4 eV和284.8 eV的峰值分别对应于C=O键、C-O键和C-C键。以上结果清楚地表明,已成功地制备出了C包覆的TiO2纳米棒薄膜。

图5 TiO2@C的XPS图
制备的TiO2和TiO2@C核壳纳米棒薄膜光阳极的红外光谱图如图6a所示。由图6a可知,TiO2和TiO2@C在491 cm-1处的峰是Ti-O变形振动的结果,TiO2@C的复合并没有改变纯TiO2的结构。TiO2@C核壳纳米棒薄膜光阳极在1 610 cm-1处观察到弱峰,这是C=O拉伸振动导致的,表明已经成功制备了TiO2@C核壳纳米棒薄膜光阳极。制备的TiO2和TiO2@C核壳纳米棒薄膜光阳极的拉曼光谱图如图6b所示。由图6b可知,中在低频区出现了4个特征峰,分别归属于金红石相TiO2的143 cm-1、239 cm-1、446 cm-1和609 cm-1,证明制备的TiO2是金红石相。TiO2@C在低频区的4个特征峰并没有发生变化,碳的复合并没有改变TiO2的结构特征。另外,1 359 cm-1和1 607 cm-1分别对应C的D峰和G峰,分别代表sp2和sp3中的C原子,图中可看出G峰稍高,代表C的石墨化程度高;D峰略低,C的无序性程度低,C总体结晶性好,更有利于形成电子通道促进电子转移,提高光生电子的转移速率。

图6 TiO2和TiO2@C的红外光谱图和拉曼光谱图
2.3 光电化学性能表征
图7为TiO2@C核壳纳米棒薄膜光阳极和TiO2光阳极在0.1 mol/L无水硫酸钠(Na2SO4)电解液中测得的线性扫描伏安曲线(LSV)和光电流密度曲线(i-t),能够直观表达光阳极在有无光照条件下电流密度大小的实时变化。从图7a中可以看出,在无光照条件下样品的电流密度都很微弱,催化性能低[22]。而在光照条件下,复合样品的光电流密度大小最高为1.65 mA/cm2,与纯TiO2光阳极相比,TiO2@C核壳纳米棒薄膜光阳极的光电流密度明显提升,这表明C层对TiO2的表界面修饰和其自身良好的导电性可以提高TiO2光阳极的光电流密度。
不同浓度C6H6O6制备的TiO2@C核壳纳米棒薄膜光阳极性能具有差异性。C6H6O6水溶液浓度分别为2、4、6、8 mmo/L时制备的TiO2@C光阳极在1.23 V vs.RHE偏压下光电流密度分别为1.42、1.65、1.56、1.29 mA/cm2。刚开始的时候随着C6H6O6浓度的增加,C含量增加,TiO2@C光阳极的光电流密度增加,当C6H6O6浓度为4 mmol/L时,达到最大。这是因为C6H6O6浓度低的时候,C含量少,不能与TiO2形成完整可靠的核壳结构;当C6H6O6浓度增加,TiO2纳米棒上均匀附着了一层薄薄的C层,更好地修饰了TiO2@C的表界面,附着的C层增加了TiO2的光响应区域,提高了载流子的转移速率;当C6H6O6浓度过高的时候,附着的C层包覆过厚,阻碍了光生电子的分离与转移,使得复合光阳极的性能降低。从图7b中的(i-t)曲线可以看出,每次在光照开始的瞬间,所有制备的TiO2@C光阳极的光电流值迅速上升,光照过程中电流传输稳定,表明了光电极良好的催化稳定性,光生电子-空穴的复合得到了改善。当光照结束,光阳极处在无光照条件下时光电流密度瞬间变化至零,这表明所有样品都具有良好的瞬态光响应特性,也说明了在光照条件下光电极中载流子传输速率较快。

图7 TiO2和TiO2@C的LSV图及i-t图
为更好地验证TiO2@C核壳纳米棒薄膜光阳极优异的光电催化性能,采用电化学阻抗谱(EIS)来揭示电极/电解质在表界面上的电荷转移信息,测试采用5 mmol/L的铁氰化钾(K3FeC6N6)和1 mol/L的氯化钾(KCl)溶液作为电解液,开路电压为0.4 V。TiO2和TiO2@C的EIS图如图8所示。由图8可知,TiO2@C复合光阳极所有样品的奈奎斯特图半圆都远小于TiO2,表明复合样品中的电子在转移过程中电阻最小,迁移速率最快。TiO2@C复合光阳极的核壳结构和C对TiO2表界面的修饰作用可以降低电子空穴复合速率,进而表现出更优异的光电催化性能。当C6H6O6浓度为4 mmol/L时奈奎斯特图半圆的直径最小,表明在这个浓度下降低电子空穴复合速率的能力最好,与其光电流性能一致。

图8 TiO2和TiO2@C的EIS图
2.4 机理分析
制备样品的UV-vis光谱图如图9所示。从图9中可以看出,纯TiO2的吸收边位于405 nm左右,可见光光响应区范围小。与纯TiO2相比,TiO2@C复合光阳极在400~800 nm波长处的光吸收显著增强,光响应区范围增大。TiO2和TiO2@C对应的Kubelka-Munk函数与光子能量的关系图如图10所示。通过Kubelka-Munk函数可以计算得到TiO2和TiO2@C核壳纳米棒薄膜光阳极的带隙能量分别约为3.08 eV和2.88 eV,这是由于C层增强了TiO2@C的可见光吸收能力,降低了TiO2@C的带隙结合能。TiO2@C核壳纳米棒薄膜光阳极光响应区的拓宽和带隙结合能的降低更有利于生成光生电子,提高了对太阳光的利用效率。TiO2的Mott-Schottky曲线如图11所示。由图11可知,利用Mott-Schottky(M-S)曲线研究了TiO2的能带结构,对其中曲线的直线部分进行拟合分析,其斜率为正说明TiO2具有n型半导体特征。此外,TiO2的M-S图的横坐标截距分别为-0.8 vs.RHE。TiO2@C中电荷分离和转移示意图及PEC分解水的工作原理如图12所示。当复合材料作为光阳极受可见光照射时,TiO2的CB上产生激发态电子,而C作为良好的电子传输层,电子将迅速转移到C层上,然后转移到FTO基体上。同时,TiO2的VB上的空穴受光生电子转移速率的影响会加速转移,并移动到电极/电解质界面进行氧化反应。TiO2@C复合后C对TiO2的表界面修饰和自身良好的导电性促进了光生电子-空穴的有效分离,提高了载流子寿命,从而提高了其光电催化性能。
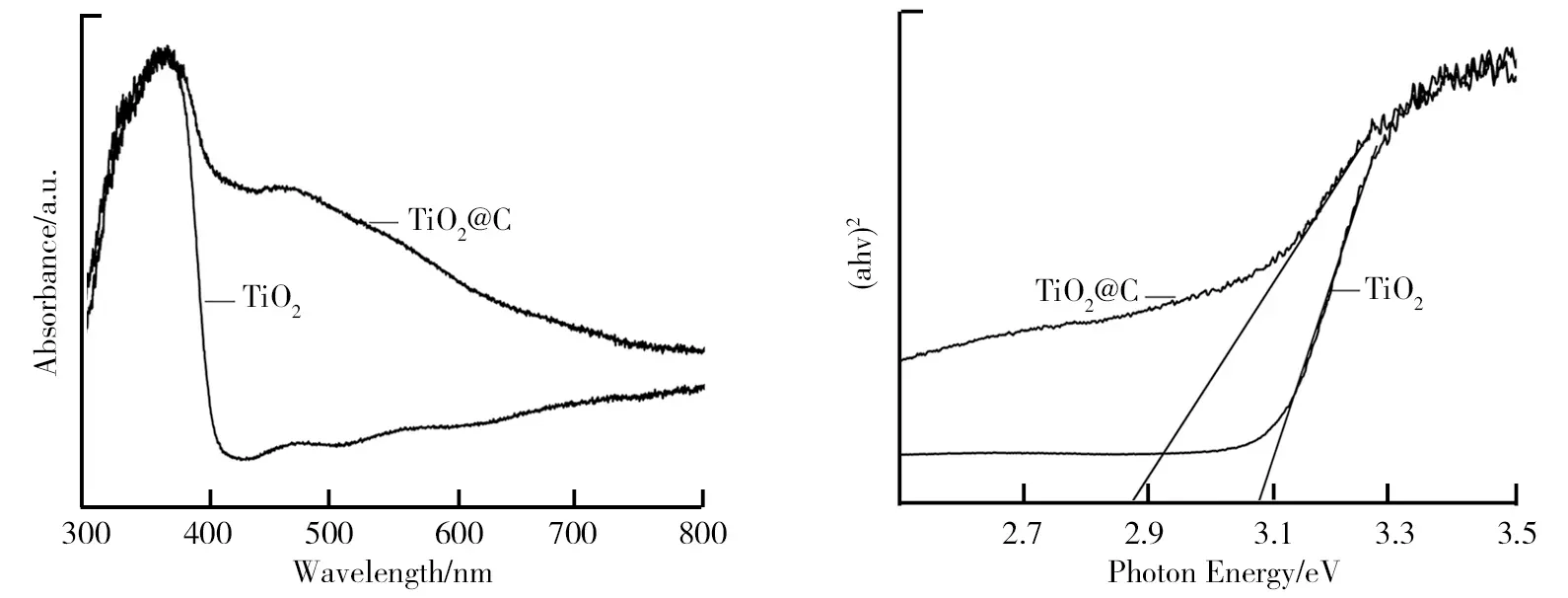
图9 TiO2和TiO2@C的UV-vis图 图10 TiO2和TiO2@C对应的Kubelka-Munk函数与光子能量的关系图

图11 TiO2的Mott-Schottky曲线 图12 TiO2@C中电荷分离和转移示意图及PEC分解水的工作原理
制备的光阳极的光致发光谱如图13所示。TiO2@C核壳纳米棒薄膜光阳极的光致发光强度远弱于纯TiO2。通常认为半导体材料的光致发光是由于其材料表面电子-空穴对分离后再复合导致的,低荧光发射强度意味着材料具有高的电子-空穴分离效率。这说明TiO2@C中载流子的寿命比纯TiO2要长,荧光光谱结果进一步证实了TiO2@C核壳纳米棒薄膜光阳极中光生电子-空穴的有效分离,说明C层提高了电子转移效率,有利于光催化反应的进行。
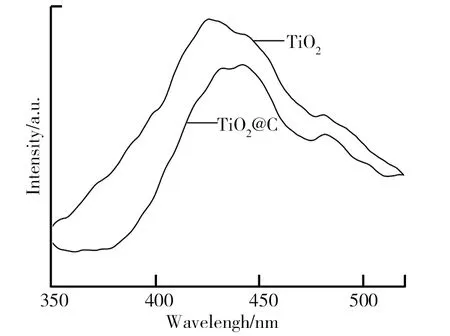
图13 TiO2和TiO2@C的PL图
3 结论
(1)通过水热法在FTO基体表面原位生长了均匀致密的TiO2纳米棒阵列,并通过二次水热法和热处理,成功制备出TiO2@C核壳纳米棒薄膜光阳极。
(2)随着C6H6O6浓度的逐渐增加,TiO2@C核壳纳米棒薄膜光阳极的光电性能表现出先增后减的趋势。最优C6H6O6浓度为4 mmol/L,制备的TiO2@C核壳纳米棒薄膜光阳极在1.23 V vs.RHE条件下的光电流密度为1.65 mA/cm2,是纯TiO2光电流密度大小的1.39倍,复合材料表现出了良好的光电转化性能。
(3)在TiO2@C核壳纳米棒薄膜光阳极中,C层对TiO2的表界面修饰作用和自身良好的导电性,拓宽了TiO2@C可见光光响应区的范围,促进了TiO2@C光生电子的分离和转移,提高了载流子的寿命,使复合材料的光催化性能提升,为构建半导体和碳材料光催化体系提供了一种新的思路。
