基于MATLAB设计纳豆枯草芽孢杆菌快速计数与筛选的方法
2022-06-20韩振兴刘丹丹王梦梦余晨锐胡紫薇黄志阳聂光军
韩振兴,刘丹丹,王梦梦,余晨锐,胡紫薇,黄志阳,聂光军
(安徽工程大学 生物与食品工程学院,安徽 芜湖 241000)
菌落的总数指标在医学药物、生物制品、食品安全等很多方面被用来判断被细菌污染的程度和卫生质量。菌落数的测定方法很多,Howard[1]于1881年首次将琼脂平板培养法用于微生物的检测,如今琼脂平板培养法仍然是国标标准规定的微生物检测方法之一。该方法通过观察肉眼可见的单细胞菌落,人工计数,根据稀释倍数计算出样品中的菌落总数。虽然成本低、操作简单,但工作量大、用时长、分析误差大、效率低,致使实时监测结果滞后[2]。随着科学技术的发展,全自动菌落计数仪已应用于各领域,郭佳等[3]提出Microbio 全自动菌落计数与普通平板计数法在统计学上无明显差异。Smith等[4]应用成像站进行快速菌落计数。梁春梅等[5]将全自动菌落计数仪应用于乳品检测,自动菌落计数仪与目测法无显著性差异,但是样品颜色及颗粒大小对实验结果产生影响。近几年,利用聚合酶链式反应(Polymerase Chain Reaction,PCR)[6]测定细胞生成物来测定菌落总数和利用酶联免疫吸附测定(Enzyme Linked Immunosorbent Assay,ELISA)[7]方法测定抗体含量来测定菌落数,PCR和ELISA方法准确度高,操作简便,但仪器复杂、耗时长、成本较高,不适用于快速、批量检测。
纳豆芽孢杆菌合成的蛋白酶可降解酪蛋白,在其平板上形成透明圈,酶活力大小与透明圈大小呈线性关系。因此,通过观察透明圈与菌落面积的比例(圈径比)即可对菌落进行快速筛选[8]。本方法应用MATLAB处理微生物菌落数字图片,进而开发计数与筛选程序,实现微生物菌落的快速计数与筛选。主要研究:在计数方面,初步研究了照片采集、菌种浓度和不同培养时间对计数准确性的影响;在筛选方面,基于菌落与透明圈部分像素点数目的比值来计算圈径比的菌株筛选准确率。本方法有望提升菌落计数与筛选的方便性、经济性和实用性。
1 材料与方法
1.1 试剂、材料与仪器
试剂与材料:纳豆枯草芽孢杆菌(实验室保藏),牛肉浸膏、葡萄糖、琼脂、氯化钠、蛋白胨和干酪素(均购自国药集团)。仪器:PH104A恒温培养箱、OPPO手机相机、SYQ-DSX-280B高压灭菌锅、TA-214电子天平、HP GT5820打印机和打孔器。
1.2 菌种培养
从50 mL培养基中取2.5 mL(即5%的接种量)纳豆芽孢杆菌于种子培养基(牛肉浸膏5 g/L、葡萄糖5 g/L、胰蛋白胨5 g/L、氯化钠 5 g/L、琼脂15 g/L、pH 7.0)中活化,将培养基放入37 ℃,200 r/min摇床培养14 h。将菌液按10-1、10-2、10-3、10-4、10-5和10-6梯度稀释后,分别吸取100 μL稀释后菌液涂布于固体培养基(牛肉浸膏5 g/L、葡萄糖5 g/L、胰蛋白胨5 g/L、氯化钠 5 g/L、琼脂糖15 g/L、pH 7.0)中,37 ℃培养18 h(空白对照为无菌水)。再选用合适浓度的活化菌液分别涂布于打孔和未打孔的酪蛋白平板(脱脂奶粉50 g/L、琼脂15 g/L、pH 7.0)中,37 ℃培养18 h,拍照留存。
1.3 图像采集
采集方式:拍照。将待计数的培养平板放置于避光纸箱内,打开箱底的灯补光,将手机置于培养基正上方合适的位置,对菌落进行拍照[9]。
1.4 图像处理
(1)二值化。相对于灰度化的图片,二值化图像是没有色度梯度的图片,便于菌落鉴别与计数。因此,本方法首先将灰度化照片二值化。应用MATLAB将上述菌群照片转化成只有0和1两个元素的矩阵的二值图像,并对二值图像中0元素和1元素的总数以及矩阵中元素的分布进行统计及分析。对菌落计数的培养基图片进行处理,菌落为白色,其他部分为黑色。将产透明圈的培养基其圈径比的计数方式分为打孔组和未打孔组,对于打孔组将孔径边缘处理为白色,孔径和透明圈处理为黑色,未打孔组透明圈处理为黑色,其他部分为白色。
(2)去噪点。噪点即图像噪声,在光信号变换时易分布不均,在噪音传播时会产生误差[10],图像信号在生成、传播以及记录时都会被其干扰,给画面分析造成难度。为使画质更加清晰,需消除图片中的噪点,并且对画面变形的地方进行处理[11]。传统的图像去噪点方法大体分为两类:空间域滤波和频域滤波。常用的空间域滤波方法有均值滤波、中值滤波等。本实验采用中值滤波的方式对图像进行降噪处理。
(3)菌落计数程序设计。菌落计数源代码如图1所示。在图1子程序模板[12]的基础上,更改读取照片名称以及阈值大小。

图1 菌落计数源代码
此程序首先读取模板图片“rice.png”,将模板图片二值化处理后,整体读取二值图片,统计元素为1的白色区域个数n,定义一个横向矩阵(n),把n个白色区域逐一代入,统计出每一个白色区域元素的个数,即区域(点菌落)大小,去除过小的杂点区域,自定义过大的黏连区域后,可统计出平板上的菌落数。
(4)菌落筛选程序设计。其中此子程序的一段如图2所示。实际运行时需要更改读取的照片名称以及阈值大小。为了使透明圈图片为一个界限分明、较为理想的图片,自定义灰度图片中灰度值大于100的均等于255,小于100的均等于0。

图2 子程序一段 图3 子程序二段
子程序二段如图3所示。经过子程序一段处理后图片定为tt1,对该图片进行二值化处理,统计透明圈像素点总数a,统计菌落像素点总数b。圈径比公式:
1.5 数据分析
培养好的平板取出后,以人工计数为对照,比较分析本方法的准确性。
2 结果与讨论
2.1 照片采集对计数的影响
MATLAB处理菌落计数照片时,在稀释度相同的条件下,以不同的光照强度(强光和弱光)拍取图片,进行菌落计数及筛选。结果显示:强光对图片的获取不利,强光拍摄的图片整体过度曝光,易将细小的菌群忽略;弱光拍摄图片整体过暗,易把培养基中的气泡也拍成菌群;在光源均匀的适当高光下,拍出来的图片利于软件处理,基于程序算法可以在最大程度上排除干扰。因此,本文后续在暗盒强光[13]条件下选择LED灯带作为照片拍摄的最佳光源。
2.2 菌体培养时间的影响
培养时间对菌落分布影响图如图4所示。将1 mL稀释度为10-6菌液涂布于平板中,分别培养21、24、27、30 h,进行菌落计数。结果显示: 当培养21 h和24 h,平板上菌落较稀疏时,能保持有效的计数结果,当培养27 h和30 h,菌体较稠密时,现有的菌落计数仪难以维持较为精准的结果,且操作重复性较低;将培养不同时间后的菌落平板照片,应用本方法计数后,结果显示,在培养时间较短的情况下,算法程序能够准确无误地进行计数,当培养时间过长,平板上的菌落较浓稠时,二值化处理的图片有部分菌落相粘连,对后面计数操作带来一定影响,应合理地进行粘连分割。因此,后续最佳菌落培养时间选择24 h。

图4 培养时间对菌落分布影响图
2.3 菌种浓度的影响
在相同的培养条件下,分别将10-1、10-3、10-5这3种高中低稀释度的菌液接种在培养基上,37 ℃培养24 h,取出平板进行计数统计。在菌液稀释度为10-3、10-5时,平板上的菌落较为稀疏,人工计数法可以保证计数的准确性。在菌液浓度为10-1时,人工计数法工作量较大,误差较大,难以保持计数的准确性。软件对拍摄清晰、菌落分布均匀、气泡较少的菌落图片分析效果非常准确,对于菌落密集及有粘连的平板,为了得到更加精准的结果,需要进一步对粘连的菌株进行分割。
(1)低浓度(菌液稀释度为10-5)的影响。菌液稀释度为10-5时图片处理结果如图5所示。采用人工计数,菌落数量为65个;MATLAB处理去除19个区域值小于500的域,统计结果如表1所示。
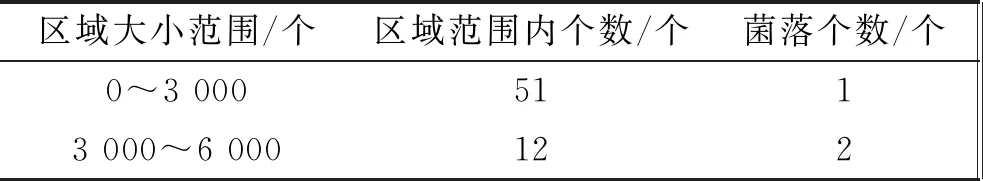
表1 MATLAB处理计数1号统计表

区域大小范围/个区域范围内个数/个菌落个数/个6 000~9 0001315 000~19 00025
(2)中等浓度(菌液稀释度为10-3)的影响。菌液稀释度为10-3时图片处理结果如图6所示。采用人工计数,菌落数量为567个。MATLAB处理去除25个区域值小于100的域,统计结果如表2所示。

表2 MATLAB处理计数2号统计表

区域大小范围/个区域范围内个数/个菌落个数/个1 200~1 500661 500~2 100272 400~2 70029
(3)高浓度(菌液稀释度为10-1)的影响。菌液稀释度为10-1时图片处理结果如图7所示。由图7可知,菌落数量较多且粘连严重,人工难以进行计数。 MATLAB处理去除19个区域值小于10的域,统计结果如表3所示。
由计算结果可知,在高、中、低3种不同稀释度情况下,本法得出的结果与人工计数相比准确率均在90%以上,表明本方法的有效性。

表3 MATLAB处理计数3号统计表

区域大小范围/个区域范围内个数/个菌落个数/个600~70048800~1 0003101 200~1 3001151 300~1 4002171 600~1 800120

图5 菌液稀释度为10-5时图片处理结果

图6 菌液稀释度为10-3时图片处理结果

图7 菌液稀释度为10-1时图片处理结果
2.4 基于圈径比的菌株筛选
图8a为实验培养平板图片,该透明圈的大小合适,人工计算圈径比可操作,将原始图片处理得到二值化图片输入到运行代码中即测得该透明圈的圈径比P=1.529 3,人工测得的圈径比P=1.674 2;精确度=1.529 3/1.674 2×100%=91.34%。

图8 图片处理结果
图9a为实验培养平板图片,该透明圈细小,人眼难以观察,筛选工作无法进行。在高光下对透明圈进行拍照取图,二值化图片后输入到运行代码中,可得该透明圈的圈径比P=6.503 5。由上述结果可知,本方法与人工计算结果准确率都在90%以上。表明本方法可以快速有效进行菌落筛选,一定程度上提升菌种筛选的效率。

图9 图片处理结果
3 讨论
本文主要以纳豆枯草芽孢杆菌作为实验菌来探究菌落计数及筛选方法。利用MATLAB处理数字图像开发的菌落计数及筛选程序,以人工计数的结果为对照,比较分析本程序的准确性。在MATLAB软件主程序的基础上进行子代码程序的设计,初步完成了菌落计数与筛选,探究了图像采集、菌种浓度和培养时间对于本方法准确性的影响。未来,可以通过较为复杂的子程序设计,实现菌落照片的自动化处理及提高准确性。进一步改进子程序,处理较为复杂的图像,针对粘连图片建立多种应答机制,是本方法持续改进的一个方向。
