超声胃镜联合腹腔镜在胃间质瘤手术中的应用
2022-06-20董理 于伟光 贾信奇
董理 于伟光 贾信奇
摘 要:目的 分析在胃间质瘤手术中采取超声胃镜与腹腔镜联合应用的临床应用效果。方法 选取2017年1月~2019年1月牡丹江医学院附属红旗医院收治的胃间质瘤患者82例作为研究对象并对其临床资料进行回顾性分析,按手术方案不同将研究对象进行分组,采取传统开腹手术的为对照组(n=41),采取超声胃镜联合腹腔镜手术的为研究组(n=41)。比较其围术期相关指标、并发症(胃排空障碍、吻合口出血、切口感染)发生率、病理结果和随访结果。结果 ①研究组患者术后首次排气时间、止痛剂使用时间和住院时间比对照组用时更短,术中出血量、腹腔引流量比对照组更少(P<0.05)。②研究组患者术后并发症发生率为2.44%,明显比对照组患者19.51%的并发症发生率要低(P<0.05)。③病理结果提示两组患者镜下切缘均为阴性,达到了R0切除的标准,其Fletcher风险度以及病理检验结果对比均差异无统计学意义(P>0.05)。④术后随访中位时间为30个月,研究组患者有1例肝脏转移,对照组患者肝脏转移、腹腔转移各1例。结论 对胃间质瘤患者而言,采取超聲胃镜联合腹腔镜治疗具有创伤小、术后康复效果好、并发症低的优点。
关键词:超声胃镜;腹腔镜;胃间质瘤;并发症;转移
中图分类号:R735.2 文献标识码:A 文章编号:1009-8011(2022)-12-00-03
胃肠道间质瘤(GIST)是消化系统肿瘤中最为多见的一种非上皮来源的间叶源性肿瘤,其发生部位多数在胃部,其次为小肠、大肠和食管,只有极个别的GIST会发生在腹膜、腹膜后以及肠系膜或胰腺等位置[1]。对于此种肿瘤,临床上多采取手术切除治疗,也是目前最有可能根治此种肿瘤的治疗方案[2]。随着微创技术的应用越来越广泛,腹腔镜下切除GIST得到普遍的认可,但是对于肿体较小(肿瘤直径不足5 cm)或腔内生长的GIST来讲,采取腹腔镜切除术治疗时对肿瘤的定位具有一定的难度[3],通过超声胃镜则能够对肿瘤进行精准定位,同时还能够明确手术切除的范围,对降低胃腔狭窄或是出血等并发症发生风险均具有非常积极的促进作用[4-6]。本次研究将2017年1月~2019年1月牡丹江医学院附属红旗医院收治的此类肿瘤患者抽取了82例并对其临床资料进行了回顾性分析,目的在于分析超声胃镜与腹腔镜联合应用对此类肿瘤患者的临床应用效果。
1 资料与方法
1.1 一般资料
本次研究选取2017年1月至2019年1月牡丹江医学院附属红旗医院收治的胃间质瘤患者82例为研究对象并对其资料进行回顾性分析。按治疗方案不同分组,采取传统开腹手术治疗的41例为对照组,采取超声胃镜联合腹腔镜手术治疗的41例为研究组。对照组患者年龄49~67岁,平均年龄(58.84±2.53)岁;男性患者24例、女性患者17例;肿瘤直径3.3~5 cm,平均直径(4.14±0.35)cm;肿瘤位置:位于胃底的13例,位于胃体的15例,位于胃窦的4例,位于胃小弯的9例;手术方式:胃楔形切除30例,近端胃大部切除5例,远端胃大部切除6例。研究组患者年龄48~68岁,平均年龄(59.12±2.76)岁;男性患者23例、女性患者18例;肿瘤直径3.5~5 cm之间,平均直径(4.18±0.24)cm;肿瘤位置:位于胃底的12例,位于胃体的18例,位于胃窦的5例,位于胃小弯的6例;手术方式:胃楔形切除32例,近端胃大部切除6例,远端胃大部切除3例。两组患者一般资料对比差异无统计学意义(P>0.05)。本次研究已经上报牡丹江医学院附属红旗医院医学伦理委员会并已取得批准,所有患者签署了关于本次研究的知情同意书。
1.2 纳入与排除标准
纳入标准:①所有研究对象术前均经胃镜、超声内镜以及强化CT等方式进行检查并诊断为胃间质瘤[7];②所有研究对象在接受手术治疗前均未出现远端转移的情况;
③术后病理检验结果证实为胃间质瘤;④肿瘤直径均低于5 cm。
排除标准:①术前接受过甲磺酸伊马替尼治疗的患者;②既往有过恶性肿瘤病史者;③上腹部既往有过手术史,腹腔有粘连者;④心、肝、肺、肾、脑等重要脏器严重损伤者;⑤精神疾病患者。
1.3 方法
两组患者术前均接受常规围术期管理,即行术前血常规以及生化全套检验,行凝血酶及D-二聚体等相关血液检验,行常规心电图、腹部超声、上腹部增强CT扫描等影像学检查,术前告知患者手术方案及术中注意事项等。对照组患者采取传统开腹手术治疗,即根据胃镜确定肿瘤位置,随后行开腹手术,并根据肿瘤位置不同以及瘤体大小不同对肿瘤进行切除,同时将肿瘤组织样本送至病理科进行检验。研究组患者接受超声胃镜联合腹腔镜手术切除治疗,患者取仰卧位并将超声胃镜置于患者头部左侧,在脐上10 mm的位置利用Trocar建立人工气腹并将此孔作为观察孔,再依次在中线的左右两侧分别建立2个操作孔,在超声胃镜的引导下在肿瘤的黏膜及其周围注射美兰以明确肿瘤的位置和边界。根据检查结果采取相应的切除方式,若肿瘤位于胃底部、胃体、胃体大弯、胃窦近端,或者虽然位于胃体小弯但是其直径较小时则可以采取胃楔形切除术;若为腔内型生长的肿瘤则需要先将胃壁切开再将肿瘤切除;若肿瘤位于近幽门或是近贲门位置时则需采取远端或近端胃大部切除术。术毕将标本袋经腹正中小切口取出并送病理科检验。本次研究均由同一组外科医师以及内镜医师共同完成。术后两组患者均采取相同的围术期处置方案,且均进行病理及免疫组化相关检验。对于中、高危患者则需要口服甲磺酸伊马替尼(生产厂家:江苏豪森药业集团有限公司,国药准字H20133200,规格:0.1 g/片)持续治疗,出院后定期回门诊进行复查并定期对患者进行电话随访。如果为极低和低危险患者,每间隔6个月进行一次腹部增强CT检查即可,持续时间为24个月;如果此期间没有发生转移,以后每12个月复查一次即可。如果为高、中危患者则每间隔3个月进行一次腹部增强CT检查,持续时间为36个月,此后每间隔6个月复查一次,持续36个月;此后没有发生转移,以后每间隔12个月复查一次即可。
1.4 观察指标
比较两组患者手术时间、术中出血量、腹腔引流量、术后首次排气时间、止痛剂使用时间以及住院时间,比较其术后并发症(胃排空障碍、吻合口出血、切口感染)发生情况,术后并发症发生率=(胃排空障碍+吻合口出血+切口感染)例数/总例数×100%。
1.5 评价指标
比较两组患者病理结果,病理结果评价指标主要有细胞表面分化抗原(CD)117以及DOG-1。胃间质瘤Fletcher风险度评分标准如下:病灶大小不足2 cm且核分裂象[/50高倍镜视野(HPF)]低于5为极低风险;病灶大小2~5 cm、核分裂象(/50HPF)低于5为低度风险;病灶大小2~5 cm、核分裂象(/50HPF)5~10 cm为中度风险;病灶大小超过5 cm,核分裂象(/50HPF)超过10为高度风险。观察两组患者术后随访情况。
1.6 统计学分析
利用SPSS 24.0统计学软件进行数据处理;计数资料用
[n(%)]表示,其比较采用χ2检验,计量资料用(x±s)表示,其比较采用独立样本t检验。以P<0.05表示差异具有统计学意义。
2 结果
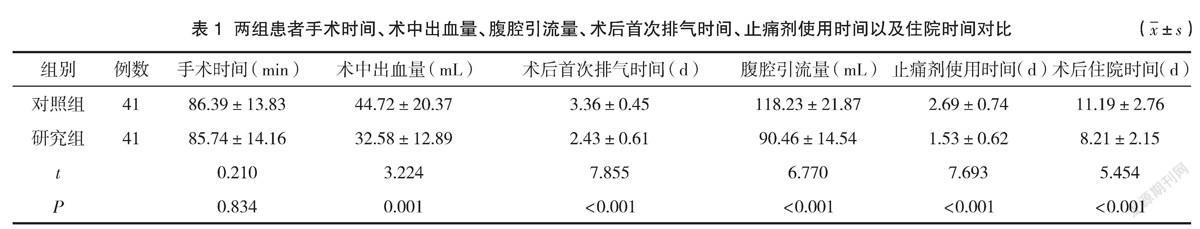
2.1 两组患者手术时间、术中出血量、腹腔引流量、术后首次排气时间、止痛剂使用时间以及住院时间对比
两组患者手术用时对比差异无统计学意义(P>0.05),研究组患者术中出血量及腹腔引流量明显比对照组少,术后排气时间、止痛剂使用时间以及住院时间明显比对照组短,差异均有统计学意义(P<0.05),见表1。
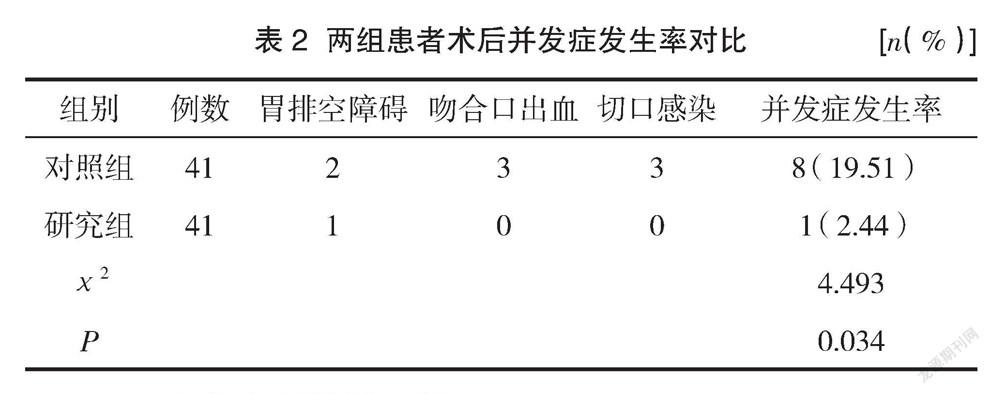
2.2 两组患者术后并发症发生率对比
研究组患者术后并发症发生率为2.44%,明显比对照组患者19.51%的并发症发生率要低(P<0.05),但是经过积极的治疗后,两组患者均未经二次手术,康复出院。见表2。
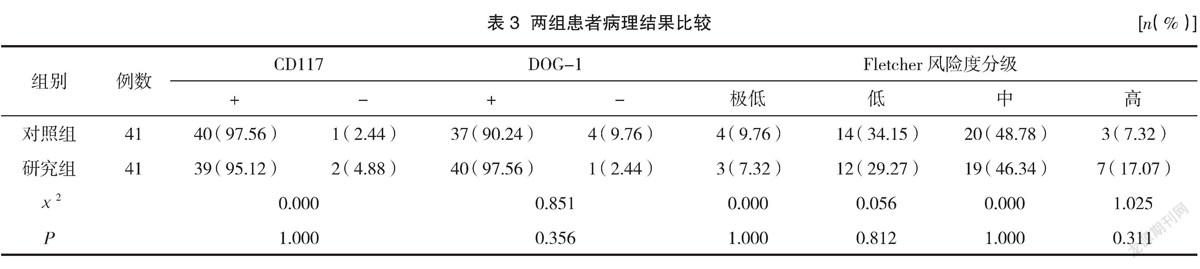
2.3 两组患者病理结果比较
病理结果提示两组患者切缘均为阴性,达到了R0切除的标准,其Fletcher风险度以及病理检验结果对比均差异无统计学意义(P>0.05),見表3。
2.4 两组患者随访情况
两组患者出院后均接受了电话随访或是通过定期门诊复诊进行随访,随访时间为6~57个月,中位随访时间为30个月。研究组患者中有1例患者在术后28个月时因急性心肌梗死而死亡,死亡前未出现肿瘤转移的情况,还有1例患者(高危型)在术后16个月时出现了肝脏转移,截至目前仍生存;对照组患者中有1例患者于术后19个月出现了肝脏转移(已死亡),还有1例患者在术后21个月时出现了腹腔转移,截至目前仍生存。
3 讨论
截至目前,对于原发性胃间质瘤(GIST)患者而言,手术切除治疗仍是其最有可能治愈的治疗方案,随着近几年微创技术的不断发展和微创手术器械的不断改良,通过腹腔镜将GIST进行切除已经在临床上得到了普遍的认可[8]。该术式的优点在于手术创口小,术中出血量低,对机体造成的创伤程度低,术后并发症少且康复速度较快,与传统开腹手术在长远疗效方面对比几乎无明显差异[9]。但是相关学者对于GIST腹腔镜切除术的适用证目前仍存在较大的争议,尤其是在瘤体大小方面争议较大[10]。美国国立综合癌症网络(NCCN)指南及相关研究均认为对胃部GIST患者可推荐由具有丰富临床经验的医师通过腹腔镜切除手术进行治疗,尤其是对于直径低于5 cm的肿瘤,腹腔镜切除具有一定的优势[11]。但是腹腔镜手术也有其不足,例如,对于瘤体较小的肿瘤在定位方面具有一定的局限性,尤其是对于腔内型肿瘤且肿瘤没有浸透到浆膜层的患者而言,其胃体的外壁与正常胃体对比无明显异常,因此在术中无法对切缘进行准确定位,而且术后对胃腔内的情况也无法准确判断[12]。又如,普通的胃镜只能发现胃腔隆起性改变,对于没有累及黏膜的肿瘤则无法发现[13]。本次研究则采取超声胃镜与腹腔镜相结合,有效避免了单一技术存在的不足之处,不但对肿瘤的定位更为精准,而且对肿瘤累及的层次以及肿瘤的浸润情况也能够详细掌握,能够在最大程度保留正常组织的前提下将肿瘤完整地进行切除,降低了因瘤体破损而导致的种植转移,同时也减少了因腹腔镜视野不良而引发的一系列并发症发生的风险。从本次研究结果可见,研究组患者在采取该术式进行治疗后其术中出血量、腹腔引流量、并发症发生率均明显比对照组低,术后首次排气时间、止痛剂使用时间以及住院时间也均比对照组短(P<0.05)。
间质性肿瘤细胞突变后类型在预后效果方面起到相当重要的作用,在临床治疗方面也具有确定性作用,在所有胃间质瘤中CD117活性突变的发生率为60%~70%。据相关研究结果显示,CD117阳性表达占全部胃间质瘤患者的85%,尚有15%的患者CD117表达为阴性,还有3%~5%的患者仅表现为局灶性阴性或阳性表达[14]。DOG-1是一种存在于肿瘤表面的CD117/PDGFRA基因突变所表达的抗体蛋白质,DOG-1阳性可进一步明确诊断胃间质瘤[15]。胃间质瘤Fletcher分级由美国国立卫生研究院提出,在评价胃间质瘤的危险度方面具有操作方便且准确的优势。本次研究结果提示两组患者在病理结果方面对比差异无统计学意义(P>0.05)。
综上所述,超声胃镜联合腹腔镜在胃间质瘤手术中可有效降低患者术后并发症发生风险,提高手术安全性,具有较高应用价值。
参考文献
[1]董俊锋,赵伟.开腹术与双镜切除术治疗不同部位胃间质瘤的疗效对比[J].实用癌症杂志,2018,33(12):120-123.
[2]郭磊,郑坚江,刘跃全,等.腹腔镜联合胃镜治疗胃间质瘤的疗效分析[J].腹腔镜外科杂志,2018,23(4):286-289.
[3]韩刚,龚航军,王以东,等.腹腔镜联合胃镜治疗早期胃间质瘤的疗效观察[J].中国中西医结合外科杂志,2018,24(3):263-266.
[4]高玉海,严强,许洪宝,等.双镜联合与开腹手术治疗胃间质瘤疗效与安全性比较的Meta分析[J].浙江醫学,2017,24(39):50-54.
[5]刘维庚,孙学军,田德福.不同微创术治疗胃间质瘤的临床效果[J].实用癌症杂志,2019,34(10):1680-1682.
[6]徐东楚,郭云虎,杨位轩,等.双镜联合切除胃间质瘤的手术效果分析[J].腹腔镜外科杂志,2017,22(1):63-65.
[7]Miettinen M,Lasota J.Gastrointestinal stromal tumors-defintion,clinical,histological,immunohistochemical,and molecular genetic features and differential diagnosis [J].Virchows Arch,2001,438(1):1-12.
[8]张震,李永翔,周玉良.双镜联合技术在胃间质瘤中的应用效果[J].安徽医学,2018,39(7):778-781.
[9]马春涛、张海玲、王永栋.胃镜联合腹腔镜治疗胃间质瘤的效果观察[J].海南医学院学报,2020,26(18):1424-1427.
[10]潘晟,黄林飞,夏甘霖,等.超声胃镜联合腹腔镜在胃间质瘤手术中的应用分析[J].局解手术学杂志,2020,29(5):417-419.
[11]汪明,曹晖.NCCN(软组织肉瘤临床实践指南(2017年第2版)》胃肠间质瘤内容介绍与更新解读[J].中国实用外科杂志,2017,37(6):644-648.
[12]肖惠,吴艳烈.腹腔镜,胃镜联合手术在胃间质瘤临床治疗中的应用[J].临床外科杂志,2017,25(12):902-904.
[13]王金申,李宾,赵淑磊,等.双镜联合微创技术在胃间质瘤治疗中的临床效果评价[J].中国现代普通外科进展,2020,23(5):376-378.
[14]房群,刘海燕.胃镜联合腹腔镜微创治疗胃间质瘤的疗效初步评估[J].中国医药导刊,2017,19(7):659-660.
[15]金鹏飞,王卫军,邵春法,等.腹腔镜联合胃镜在胃间质瘤手术治疗中的临床价值[J].中国医师进修杂志,2017,40(1):27-30.
作者简介:董理(1987.9-),男,汉族,籍贯:黑龙江省哈尔滨市,硕士,主治医师,研究方向:普外科疾病的诊治。
通讯作者:于伟光,E-mail:yuweiguang00@163.com。
