12-磷钼酸基超分子化合物[Ag(H3L)(H2X)(PMo12O40)]·3H2O的合成、结构及性能研究
2022-06-18邹琴琴赵婕史振雨
邹琴琴 赵婕 史振雨
(兴义民族师范学院 生物与化学学院, 贵州 兴义 562400)
多金属氧盐是氧原子连接前过渡金属离子形成的金属氧簇化合物,具有大体积、稳定的结构和突出的光、电、磁、催化等性能,因此在催化、磁学、生物化学、材料科学等领域有广泛的应用[1-3]。作为关键的无机建筑单元,多酸可与有机配体或金属有机配体络合片段以分子间作用力或配位共价键作用相连,构筑新的有机-无机杂化化合物[4,5]。Keggin型多酸阴离子[PMo12O40]3-同时具备酸性和氧化性,可作为双功能催化材料,它是由杂原子P和配原子Mo通过氧原子配位桥连组成的多氧簇金属配合物[6]。在当前多酸化学研究中,选择引入特定的过渡金属离子和优良的有机配体来装饰Keggin型多酸,合成具有新颖结构特征和物理化学性质的杂化化合物已经成为一个重要的研究对象[7-8]。
由于不同的金属离子,电子层构造、半径的大小和电荷也不同,这些都会导致金属离子的配位能力和配位数发生变化。本文选择过渡金属Ag+,是基于以下原因:(1)Ag+作为d10金属离子,有广泛的几何配位能力,可以在共价复合材料中提供2到7个配位数,导致配合物的几何构型有着相当大的变化,可以与有机配体连接形成扩展结构;(2)银-有机配体络合物片段,具有特殊的光物理和光化学性质[9]。类似地,配体空间结构、配位点的分布等性质可以有效地调整化合物的拓扑结构。含氮羧酸配体,因丰富的配位点和羧基较强的配位能力,被广泛用于合成和制备多酸基配合物[10]。
综上,我们以1-氢-[3-(4-吡啶基)吡唑]-丙酸作为有机配体,选择过渡金属Ag+(AgNO3),来修饰多酸阴离子[PMo12O40]3-,制备出了化学式为[Ag(H3L)2(PMo12O40)]·H2O的新的磷钼十二酸基的三维超分子化合物,该化合物结构利用X-射线单晶衍射进行了表征,同时探究了该化合物的电化学功能、光催化功能。
一、实验部分
(一)仪器与试剂
德国Bruker D8 QUEST单晶衍射仪;RST 5200F电化学工作站;T6新世纪紫外可见分分光光度计。
使用纯度为98%的配体H2L,采购于济南恒化科技有限公司;水是二次蒸馏水;其余所用试剂为分析纯,来自国药集团化学试剂有限公司。
(二)单晶的合成
用电子天平分别称取硝酸银(0.0425g,0.25 mmol)、磷钼十二酸(0.0639g,0.035mmol)、H2L(0.0109g,0.05mmol)和HX(0.0145g,0.1mmo)倒入25mL小烧杯,并加入8mL纯净水混合,在室温下将装有混合液的烧杯放在磁力搅拌器上搅拌20min左右,混合溶液的pH值使用1mol/L硝酸和1mol/L氢氧化钾溶液调节,测试大约为2.5。然后将所有混合液转入聚四氟乙烯高压反应釜中(25mL),并在160℃的烘箱中恒温反应96小时后,将反应后的溶液冷却至室温,用清水将生成物冲洗干后自然风干,得到浅黄色块状晶体。化合物的元素分析的结果显示,化学式为C19H26AgMO12N6O45P(Mr=2348.54),理论数据(%):C9.72,H1.11,N3.58;测试数据(%):C9.81,H1.04,N3.51。
(三)晶体结构测定
选择形状规则和质量较好,且透明的浅黄色块状晶体,密封在毛细玻璃管中,该化合物的单晶X-射线衍射分析数据在Bruker Smart Apex CCD衍射仪上以Mo-Kα(λ=0.71069A。)在293(2)K温度下获得。通过直接法利用SHELXTL软件以F2的全矩阵最小二乘法精修解析该化合物的结构。氢原子的特定位置则选用理论加氢的方法来测量。所测物[Ag(H3L)(H2X)(PMO12O40)]·3H2O的CCDC编号为2114327。晶体学数据参照表1。

表1 标题化合物的晶体学数据

β(o)121.451(12)γ(o)90.000(0)Volume/A。3 5218(3)Z,Calculated density/Mg/m34,2.978 Absorption coefficient/mm-13.295 F(000)4396 Theta range for data collection2.62 to 25.00 deg Limiting indices-15〈=h〈=15,-23〈=k〈=22,-29〈=l〈=29 Reflections collected33492/5344[R(int)=0.0353]Refinement methodFull-matrix least-squares on F2 Data/restraints/parameters5344/0/752 Goodness-of-fit on F21.124 Final R indices[I〉2sigma(I)]R1=0.0410,wR2=0.1220 R indices(all data)R1=0.0500,wR2=0.1262
(四)碳糊电极的制备
用电子天平称取50mg石墨粉、10mg标题化合物,在玛瑙研钵中将其混合物研磨成粉末状,使混合物混合均匀后加入液体石蜡(0.3mL),再搅拌均匀,可以看到最终的状态为碳糊状后,再转移到聚四氟乙烯管中,该管内径为2mm,长度为4 cm,且保证物质在管里面填充紧密、无间隙,然后用细铜棒从另一端轻轻插入到玻璃管中的物质里,将所制得的碳糊电极,记作1-CPE,室温放置48小时晾干,在使用之前将电极表面在称量纸上擦平滑均匀。
二、结果与讨论
(一)化合物的晶体结构
通过单晶X射线衍射分析了实验所得的化合物[Ag(H3L)(H2X)(PMo12O40)]·3H2O,该物质属于低级晶族的单斜晶系。目标化合物的基本结构单元由一个晶体学独立的,两个被质子化的有机配体H2L和HX,三个水分子,一个Keggin型杂多阴离子[PMo12O40]3-构成(如图1所示)。其中简单结构是采用“T”型配位模式,以银(I)为枢纽,两个H3L+和H2X+有机配体中的两个氮原子(分别为N1和N2)在银的直线两端配位,及另外的垂直端[PMo12O40]3-多阴离子中的桥氧原子(O38)配位而成,其中Ag+离子相关的键长和键角如下:Ag(1)-N(1)键长为2.108(8)A。,Ag(1)-N(2)键长2.115(9)A。,N(2)-Ag(1)-N(1)键角为169.4(4)A。。为了满足电荷守恒,有机配体H2L和HX被质子化。该化合物价键计算可知,Ag(I)阳离子氧化态为+1,P处于+5氧化态,所有的Mo原子都为+6氧化态。

图1 化合物[Ag(H3L)(H2X)(PMo12O40)]·3H2O球棍图Figure1 Ball-and-stick view of the compound[Ag(H3L)(H2X)(PMo12O40)]·3H2O
如图2所示,1D超分子链状结构是由配合物中相邻的基本结构单元沿着c轴扩展而成,其中杂多酸阴离子[PMo12O40]3-上的桥氧O32,O2W(来自游离的水分子)和N4(来自机配体H2L)彼此之间通过在氢键连接。(N4…O2W,2.759A。;O32…O2W,2.910A。)。3D超分子结构是由多酸阴离子的桥氧,有机配体上的羧基上的氧原子以及水分子彼此通过氢键的作用形成1D链状结构,然后将相邻的1D链状结构连接延展而产生的,如图3所示。主要氢键情况如下:N3…O42,2.757A。;O3W…O41,2.522A。;O3W…O34,2.912A。;O1W…N5,2.700A。;O1W…O3,2.961A。;O26…N5,3.024A。。
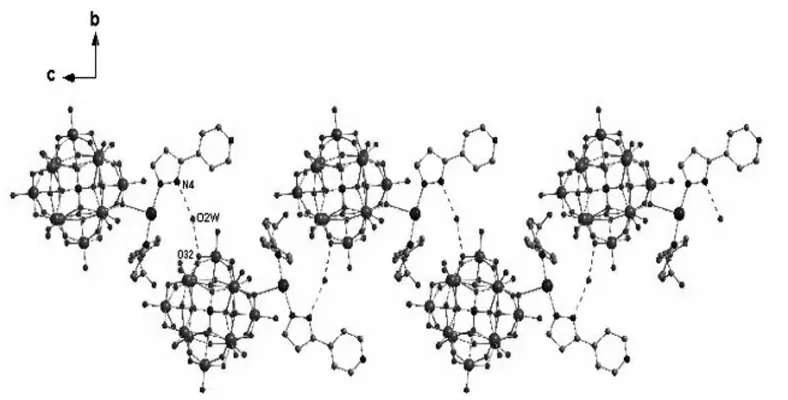
图2 化合物[Ag(H3L)(H2X)(PMo12O40)]·3H2O沿着c轴拓展形成1D超分子链结构Figure 2 The 1D supramolecular structure of the compound[Ag(H3L)(H2X)(PMo12O40)]·3H2O along the C axis

图3 化合物[Ag(H3L)(H2X)(PMo12O40)]·3H2O三维超分子图Figure3 The 3D supramolecular structure of the compound[Ag(H3L)(H2X)(PMo12O40)]·3H2O
(二)化合物的电化学性质
如图4所示,循环伏安曲线是在1mol/L H2SO4溶液下不同扫描速率进行下的,可以看到化合物有三对可逆氧化还原峰I-I',II-II',III-III',其范围是在-150~+600mV电位之间。在扫速为50mV/s时,这三对氧化还原峰的电位分别是I-I'(Epred=-105.76mV,Epox=36.84mV)、II-II'(Epred=133.73mV,Epox=258.96mV)和III-III'(Epred=301.73 mV,Epox=422.57mV),根据平均峰值电位公式E1/2=(Epc+Epa)/2得到半坡电位分别是I-I'(-34.46 mV)、II-II'(196.35mV)和III-III'(362.15mV)。

图4 1-CPE在1mol/LH2SO4中不同扫速循环伏安图(扫描速率:50,100,150,200,250,300,350,400mV/s)Figure4 CV of 1-CPE in different sweep speeds under 1 mol·L-1 H2SO4solution(scanning rate:50,100,150,200,250,300,350,400mV·s-1)
(三)化合物的光降解性质
多金属氧酸盐的最高能级占有轨道(HOMO)和最低空轨道(LOMO)之间能带间隙可有效地分离光激发载流子,所以多酸可以将有机染料进行有效地降解。本实验在紫外灯照射对亚甲基蓝(MB)光催化降解效能做了测试。其测试步骤如下:用电子天平称量10mg晶体,随后加入石英小烧杯里,烧杯里再加入30mL的亚甲基蓝(10mg/L),在黑暗环境下搅拌30min,之后置于黑暗中搁放1天(以确保化合物和亚甲基蓝溶液之间达到吸附平衡)。之后在300W紫外Xe灯照射的氛围中将混合液进行搅拌,然后每次取出5mL(间隔时间为10min)左右已搅拌的溶液去离心并取出上层清夜在T6新世纪紫外可见分光光度计进行测量(测量液应倒回原石英烧杯中继续光照、整个过程尽量避免见到光)。亚甲基蓝在UV-vis特征吸收峰为664nm左右,本文选用特征吸收峰作为判断依据,并计算其降解率。
如图5所示,在同等的实验条件下,我们能够看出,没有放入晶体的亚甲基蓝(10mg/L20mL)和加了晶体(10mg)的亚甲基蓝的降解率是明显不同的。如图6所示,时间每隔10min抽一次数据,直到1h后,结果表明,亚甲基蓝溶液的降解率分别为16.4%和87.1%,前者是没有加入晶体的,而后者是加有晶体(10mg)的亚甲基蓝溶液(10mg/L30 mL),经过对比前后两种实验结果,说明了本实验化合物对亚甲基蓝的降解表现出的优良的光催化活性。

图5 标题化合物催化降解MB溶液的紫外-可见光谱图Figure 5 The UV-Visspectra of MB solution degradation catalyzed by the title compound

图6 无标题化合物与加入标题化合物后MB溶液浓度随反应时间的变化图Figure 6 The change of MB solution concentration chart of Blank experiment and after adding the title compound with reaction time
三、结论
本文利用水热合成法,选用多氮唑配体1氢-[3-(4-吡啶基)吡唑]-丙酸(H2L)和4-(1H-吡唑)-吡啶(HX))、硝酸银(AgNO3)和磷钼十二酸(H3PMo12O40)为原材料,通过调控反应的条件,我们制备出了一种新的Keggin型的无机-有机杂化化合物[Ag(H3L)(H2X)(PMo12O40)]·3H2O。用X-射线单晶衍射测试其结构,最终呈现由[PMo12O40]3-与金属有机络合物片段[Ag(H3L)(H2X)]3+在氢键的作用下形成的3D超分子结构。在对标题化合物进行催化性质研究发现,其对亚甲基蓝的光降解有一定的催化作用。
