绝对稳定固定对骨量减少长骨骨折愈合影响的实验研究*
2022-06-18张俊卫琰厉国定尹伟忠王健
张俊 卫琰 厉国定 尹伟忠 王健
股骨远端骨折是老年人常见的骨折之一,主要由低能量损伤引起,多为简单骨折[1-2]。对于老年股骨远端骨折,采用锁定钢板联合微创接骨术(minimally invasive plate osteosynthesis,MIPO)治疗是目前的主流选择[3]。MIPO的最佳适应证是干骺端粉碎性骨折及骨质疏松骨折[4]。一般认为,老年股骨远端骨折多为骨质疏松骨折[5],但随着生活水平的提高,临床发现多为骨量减少的简单骨折[6]。有较多文献报道,运用MIPO治疗有时很难纠正简单骨折[7-9]。由于锁定钢板强度较大,如果骨折端间隙过大,同时没有合适的钢板工作长度,很难有足够的应变力诱导产生骨痂,易引起相关的并发症[10-12]。近年来,通过拉力螺钉技术复位骨折端,结合锁定钢板固定老年股骨远端骨折开展得越来越多,生物力学及临床疗效满意[6,13-14]。为此,笔者以新西兰大白兔为实验对象,制备骨量减少模型,通过建立股骨骨折来模拟老年长骨骨折,探讨骨折端加压螺钉结合锁定钢板固定对骨折愈合的影响,以期为临床治疗的选择提供理论依据。
1 材料与方法
1.1 材料
选用5月龄发育成熟的雌性新西兰大白兔36只,体重2.3~2.7 kg,上海斯莱克实验动物有限责任公司提供[伦理:prylz2020-078,动物使用许可证:SYXK(沪)2017-0002]。主要实验药物和试剂:甲泼尼龙琥珀酸钠(methylprednisolone sodium succinate,MPS)(比利时辉瑞公司),Ⅰ型前胶原氨基端肽(procollagen type 1 N-terminal propeptide,P1NP)及Ⅰ型胶原羧基末端肽(cross-linked C-telopeptide of type 1 collagen,CTX)试剂盒(上海江莱生物科技有限公司),TRAP染色试剂盒(美国Sigma公司),BMP-2检测试剂盒(英国Abcam公司)。主要实验仪器和材料:双能X线骨密度测定仪(美国GE公司),Micro-CT(比利时SkyScan 1172型),微型接骨板系统(山东威高骨科材料股份有限公司)。
1.2 方法
1.2.1 骨量减少模型制备
用信封法随机选取30只新西兰兔构建骨量减少模型(包括模型组6只),另外6只为对照组。模型组肌注MPS,剂量1 mg/(kg·d),持续4周,对照组肌注等量生理盐水。模型组和对照组进行骨密度(bone mineral density,BMD)、血清骨转换指标(P1NP、CTX)及Micro-CT检测。
1.2.2 骨折内固定模型制备
骨量减少模型制备成功后,余下24只大白兔用信封法随机分为S1组(单纯钉板系统,4周)、L1组(骨折端加压螺钉结合锁定钢板,4周)、S2组(单纯钉板系统,8周)和L2组(骨折端加压螺钉结合锁定钢板,8周),每组6只。10%水合氯醛1 mL/kg开始从耳缘静脉麻醉,沿右股骨外侧做纵形切口,从肌间隙进入暴露股骨,用摆锯由外上向内下斜形锯断股骨,建立45°左右股骨中段骨折模型。复位骨折端并用克氏针临时固定,置入6孔微型加压锁定板(2.4系统),便于骨折端拉力螺钉的置入。S1、S2组:骨折近端及远端分别植入2枚锁定螺钉,在臀部肌注青霉素40万U抗感染,每天1次,连续3 d。L1、L2组:先用拉力螺钉实现骨折端的坚强加压,余处理同S1、S2组。术后即刻予以患肢管型石膏保护性固定4周。
1.3 观察指标
1.3.1 BMD测定
MPS肌注前后均采用双能X线吸收法(dual energy X-ray absorptiometry,DXA)检测L3-L4椎体及左侧股骨近端BMD。
1.3.2 血清骨转换指标检测
腹主动脉取血,离心并收集上层血清,用ELISA法检测血清骨转换指标(P1NP,CTX)的表达水平。
1.3.3 Micro-CT检测
将大白兔处死,取出L5椎体,行Micro-CT扫描,检测三维骨密度(BMD)、骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)与结构模型指数(SMI)等。
1.3.4 骨折术后影像学检测
骨折术后4周S1、L1组兔X线摄片,随后处死行Micro-CT扫描,观察骨痂的生长情况。骨折术后8周,S2、L2组兔同样处理。
1.3.5 三点弯曲力学测试
将股骨标本放置于生物力学机上,承载点的间距为20 mm,加载速度为2 mm/min直至发生骨折,记录载荷位移曲线并计算生物力学指标。
1.3.6 组织病理学及免疫组织化学染色
骨折术后4、8周,骨痂标本脱钙、脱水、石蜡包埋,切片行HE、Masson、番红固绿及TRAP染色,行免疫组化观察骨形态发生蛋白(BMP-2)的表达变化。
1.4 统计学方法
采用SPSS 19.0软件进行统计学分析。数据以均数±标准差表示,组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 体重变化
模型组与对照组体重在肌注前比较差异无统计学意义(P>0.05),具有可比性。肌注2周后,模型组体重出现较大幅度下降;肌注4周后,模型组体重回归基线水平,对照组体重较基线上升明显,各时间段两组比较,差异均无统计学意义(P>0.05),见表1。
表1 两组实验兔体重变化(±s)
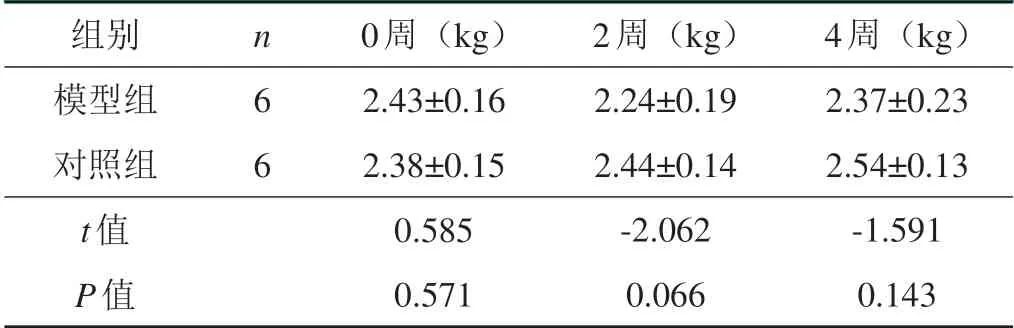
表1 两组实验兔体重变化(±s)
组别模型组对照组t值P值n 6 6 0周(kg)2.43±0.16 2.38±0.15 0.585 0.571 2周(kg)2.24±0.19 2.44±0.14-2.062 0.066 4周(kg)2.37±0.23 2.54±0.13-1.591 0.143
2.2 BMD检测
模型组与对照组BMD在肌注前比较差异无统计学意义(P>0.05),具有可比性。肌注4周后,模型组腰椎及股骨近端BMD较基线出现明显下降,对照组无显著变化,两组比较差异有统计学意义(P<0.05),模型组腰椎BMD是对照组均值减去1.7 SD,股骨近端BMD是对照组均值减去1.6 SD,见表2。
表2 两组实验兔肌注前后腰椎及股骨近端BMD的比较(±s)

表2 两组实验兔肌注前后腰椎及股骨近端BMD的比较(±s)
组别模型组对照组t值P值n 6 6腰椎(mg/cm2)0周 4周252±24 216±21 249±25 251±21 0.226 -2.844 0.826 0.017股骨近端(mg/cm2)0周 4周281±35 237±30 277±29 281±28 0.208 -2.622 0.840 0.026
2.3 血清骨转换指标分析
与对照组比较,模型组血清学指标(P1NP、CTX)肌注4周后都有所升高,组间比较差异有统计学意义(P<0.05),见表3。
表3 两组实验兔肌注4周后P1NP及CTX水平变化的比较(±s)

表3 两组实验兔肌注4周后P1NP及CTX水平变化的比较(±s)
组别模型组对照组t值P值n 6 6 P1NP(ng/mL)6.83±0.65 5.79±0.46 3.215 0.009 CTX(ng/mL)7.19±0.34 6.55±0.44 2.862 0.017
2.4 Micro-CT检测
肌注4周后,模型组与对照组腰椎三维BMD比较,差异有统计学意义(P<0.05),模型组腰椎三维BMD是对照组均值减去1.7 SD。模型组的骨微结构参数BV/TV、Tb.Th、Tb.N较对照组下降,Tb.Sp、SMI较对照组上升,差异有统计学意义(P<0.05)。
表4 两组实验兔肌注4周后L5椎体骨微结构参数的比较(±s)
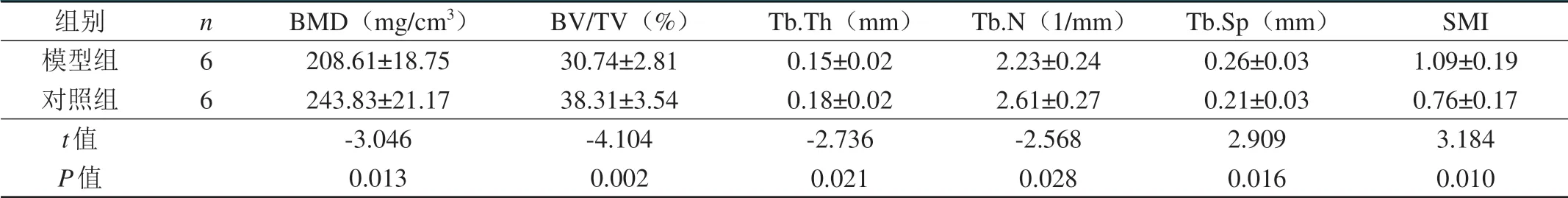
表4 两组实验兔肌注4周后L5椎体骨微结构参数的比较(±s)
组别模型组对照组t值P值n66 BMD(mg/cm3)208.61±18.75 243.83±21.17-3.046 0.013 BV/TV(%)30.74±2.81 38.31±3.54-4.104 0.002 Tb.Th(mm)0.15±0.02 0.18±0.02-2.736 0.021 Tb.N(1/mm)2.23±0.24 2.61±0.27-2.568 0.028 Tb.Sp(mm)0.26±0.03 0.21±0.03 2.909 0.016 SMI 1.09±0.19 0.76±0.17 3.184 0.010
2.5 骨折术后X线片
S1组骨折线模糊,但尚未完全愈合;L1组骨折线基本消失。S2组骨折基本愈合,但有1例骨折端从模糊状向清晰状转变,出现延迟愈合现象(见图1C);L2组已完全愈合。

图1 骨折术后X线片:A.S1组;B.L1组;C.S2组;D.L2组
2.6 骨痂Micro-CT检测
与S1组相比,L1组BV/TV更高,骨小梁厚度明显、数量较多、分离度更低,差异有统计学意义(P<0.05),见表5;S2、L2组BV/TV、Tb.Th、Tb.N及Tb.Sp比较差异无统计学意义(P>0.05),见表6。
表5 两组实验兔骨折术后4周骨痂骨微结构参数的比较(±s)

表5 两组实验兔骨折术后4周骨痂骨微结构参数的比较(±s)
组别S1组L1组t值P值n 66 BV/TV(%)31.62±3.08 36.02±2.22-2.842 0.017 Tb.Th(mm)0.14±0.03 0.18±0.04-2.387 0.038 Tb.N(1/mm)4.24±1.35 6.14±0.94-2.828 0.018 Tb.Sp(mm)0.21±0.03 0.17±0.03 2.314 0.043
表6 两组实验兔骨折术后8周骨痂骨微结构参数的比较(±s)

表6 两组实验兔骨折术后8周骨痂骨微结构参数的比较(±s)
组别S2组L2组t值P值n 66 BV/TV(%)43.40±3.16 45.09±3.93-0.817 0.433 Tb.Th(mm)0.19±0.04 0.20±0.03-0.771 0.459 Tb.N(1/mm)6.54±1.46 6.99±1.72-0.487 0.636 Tb.Sp(mm)0.17±0.04 0.16±0.03 0.799 0.443
2.7 生物力学研究分析
术后4周,两组最大载荷及弹性模量比较差异有统计学意义(P<0.05),见表7。术后8周,两组最大载荷及弹性模量比较差异无统计学意义(P>0.05),见表8。
表7 两组实验兔骨折术后4周生物力学结果(±s)

表7 两组实验兔骨折术后4周生物力学结果(±s)
组别S1组L1组t值P值n66最大载荷(N)248.33±10.15 269.83±14.03-3.040 0.012弹性模量(GPa)0.28±0.03 0.35±0.05-3.028 0.013
表8 两组实验兔骨折术后8周生物力学结果(±s)

表8 两组实验兔骨折术后8周生物力学结果(±s)
组别S2组L2组t值P值n66最大载荷(N)323.67±50.21 370.33±23.92-2.055 0.067弹性模量(GPa)0.34±0.04 0.38±0.03-2.098 0.062
2.8 组织学观察
HE染色:S1组为典型的纤维骨痂及软骨骨痂,纤维骨痂较明显;L1组以明显的软骨骨痂为主。S2组有大量硬骨痂出现,骨小梁粗细不均;L2组的硬骨痂体积大,骨小梁粗细均匀(见图2)。
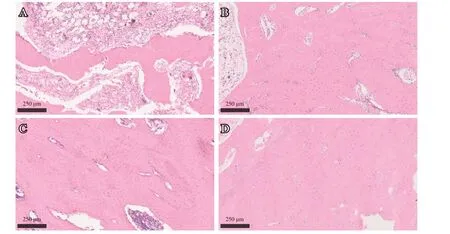
图2 骨折术后HE染色(×100):A.S1组;B.L1组;C.S2组;D.L2组
Masson染色:S1组大部分由淡红色的组织构成,蓝染的纤维软骨相对明显;L1组主要由淡红色的组织构成,蓝染的纤维软骨较少。S2组红染的组织逐渐增多;L2组骨组织成熟度较高(见图3)。
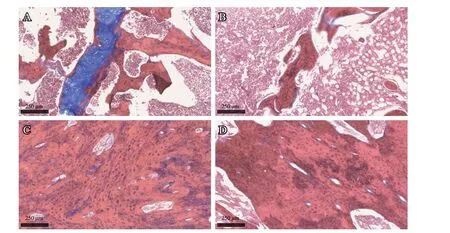
图3 骨折术后Masson染色(×100):A.S1组;B.L1组;C.S2组;D.L2组
番红固绿染色:S1组有部分纤维软骨(淡红色),周围有较多骨性组织(蓝色);L1组主要由大量骨性组织为主(蓝色)。S2组出现大量的绿色骨性组织;L2组由大量绿色骨性组织构成,排列整齐(见图4)。

图4 骨折术后番红固绿染色(×100):A.S1组;B.L1组;C.S2组;D.L2组
TRAP染色:S1组破骨细胞数量为(9.7±2.7),L1组为(6.3±1.9),两组比较差异有统计学意义(t=2.469,P=0.033)。S2组(5.5±2.4),L2组(3.3±1.6),两组比较差异无统计学意义(t=1.813,P=0.100)(见图5)。


图5 骨折术后TRAP染色(×100):A.S1组;B.L1组;C.S2组;D.L2组
2.9 免疫组化分析
BMP-2表达:S1组(10.3±2.2),L1组(12.5±2.7),两组比较差异无统计学意义(t=-1.522,P=0.159)。S2组(5.8±1.5),L2组(4.8±1.8),两组比较差异无统计学意义(t=1.041,P=0.322)(见图6)。
图6 骨折术后骨痂BMP-2表达(×100):A.S1组;B.L1组;C.S2组;D.L2组
3 讨论
随着人口老龄化趋势的加剧,低能量损伤引起的老年股骨远端骨折逐年增加,其中有一大部分为骨量减少性骨折,骨折类型主要为A1、A2、C1型简单骨折[2]。闭合复位、运用MIPO微创插板治疗具有创伤小、可避免对软组织广泛剥离的优点,因此是治疗该类骨折的首选方法[3]。然而,许多学者通过研究发现,股骨远端骨折中A1、A2、C1型简单骨折采用MIPO治疗有时很难获得满意复位,尤其是螺旋形骨折,容易导致骨折延迟愈合等一系列并发症的发生[10-12]。Märdian等[14]通过生物力学研究发现,在A1型老年股骨远端骨折中运用骨折端加压螺钉结合锁定钢板固定后,骨折端剪切微动出现明显降低,有利于骨折愈合[15]。Chung等[6]对A1、A2、C1型老年股骨远端骨折进行临床分析,发现骨折端使用螺钉固定后骨折愈合时间提早,术后1年愈合率更高,同时并发症更少,效果优于传统MIPO治疗方式。
在上述研究背景下,本研究首先对雌兔采用肌注MPS的方法诱导骨量减少模型来模拟骨量减少的老年患者。兔与人类有相似的哈佛氏系统,骨骼转化快,适合作为激素性骨量减少模型的研究[16];兔的骨骼较大、价格低廉、便于长期动态观察,因此在开放性骨折模型中有着广泛的应用。本实验笔者选择新西兰大白兔作为实验动物,以1mg/(kg·d)的剂量MPS肌注4周,肌注2周后模型组体重出现较大幅度下降,肌注4周后模型组体重回归基线水平,对照组体重较基线平稳升高,与既往文献报道一致[17]。与对照组相比,模型组腰椎、股骨近端BMD及腰椎三维BMD降低幅度达到均值减去1.0 SD以上到2.5 SD之间,参考WHO的判定标准[18],可以判定为骨量减少。与对照组相比,模型组P1NP和CTX在MPS肌注4周后都有所升高(P<0.05),P1NP和CTX明显提高可以在一定程度上反映患者存在骨质疏松[19],本研究结果提示骨组织的高转化状态,预示模型组向骨量减少方向进展。
Micro-CT能对骨的形态结构行三维角度评估,有助于了解骨质疏松的病理结构改变[20]。本研究Micro-CT扫描结果发现,模型组实验兔MPS肌注4周后L5椎体骨微结构参数BV/TV、Tb.Th、Tb.N较对照组下降,同时Tb.Sp、SMI较对照组上升。BV/TV代表骨小梁组织骨量含量的多寡,Tb.Th、Tb.N、Tb.Sp是评价骨小梁形态结构的指标,SMI代表组织骨小梁板状结构与杆状结构一定比例的参数,数值增大代表骨小梁结构从板状结构向杆状结构转变[21],松质骨结构出现退变。本实验模型组BV/TV、Tb.Th、Tb.N降低,Tb.Sp、SMI增加,代表分解代谢占优势,与其他文献[22]报道一致,结合BMD及血清骨转化指标,可以认为MPS肌注4周后成功建立兔骨量减少模型。
Baofeng等[23]通过甲基泼尼松龙诱导法,以1 mg/(kg·d)的剂量对雌兔肌注8周,发现腰椎BMD和骨量均出现下降。龚健等[17]通过肌注甲强龙1.5 mg/(kg·d),持续28 d,之后将剂量改为0.35 mg/kg以维持骨量持续丢失,每周3次,持续8周,成功构建骨质疏松兔模型。上述研究构建的是骨质疏松模型,本实验以1 mg/(kg·d)的剂量MPS肌注4周构建骨量减少模型,激素剂量或持续时间较上述研究短,但研究方法相似,并成功建立了模型。
X线片是最常用的观察骨折生长情况的方式,通过X线片可以直观反映骨折端骨痂生长愈合的程度。本研究X线片发现,S1组骨折线模糊,L1组骨折线基本消失,S2组骨折基本愈合,L2组已完全愈合,研究说明骨折端使用加压螺钉有利于骨折的早期愈合,同时发现S2组有1例出现骨折延迟愈合现象,与临床工作中发现的问题类似[6],简单骨折采用桥接钢板固定的方式达到相对稳定可能会延长骨折愈合时间,甚至出现骨不连。骨折端Micro-CT扫描及三维重建可以清晰地显示骨痂内部的细节情况。本研究Micro-CT扫描发现,L1组BV/TV、Tb.Th、Tb.N较S1组上升,同时Tb.Sp较S1组下降(P<0.05)。Plecko等[24]动物实验研究与本研究结果类似,发现使用骨折端加压螺钉结合锁定钢板后,术后6周骨内膜骨痂形成量最多,骨折端加压螺钉固定有利于早期形成骨痂。本实验S1组最大载荷为(248.33±10.15)N,L1组为(269.83±14.03)N(P<0.05),生物力学结果证实骨折端加压螺钉固定后在骨折愈合早期有更佳的力学稳定性;S2与L2组骨痂骨微结构参数及生物力学均无明显差异,表明骨折愈合后期两种固定方式效果相当,与Plecko等[24]报道一致。
本研究通过HE、Masson及番红固绿染色形象地展示了不同成熟度的骨痂及骨小梁结构,发现L1、L2组骨痂相对更为成熟;TRAP染色及免疫组化揭示破骨细胞及成骨细胞在愈合中的分布,发现S1组破骨细胞数量明显多于L1组(P<0.05),虽然L1组BMP-2含量稍高,但差异无统计学意义。研究表明骨折端加压螺钉固定能够有利于骨痂组织的早期形成,有利于骨小梁的早期改造与重塑,能够在骨组织愈合时抑制破骨细胞的活动,与既往文献报道一致[24]。
综上所述,在治疗骨量减少性长骨骨折时,骨折端加压螺钉结合锁定钢板固定有助于早期形成骨痂以及骨折的快速愈合。骨折端无拉力螺钉固定时,有发生骨折延迟愈合或骨折不愈合的风险。
