聚乳酸/矿化胶原复合人工骨修复材料在兔股骨髁松质骨缺损中的应用研究*
2022-06-18何志敏宋天喜胡刚吴晶晶仇志烨
何志敏 宋天喜 胡刚 吴晶晶 仇志烨
自体骨被认为是植骨的“金标准”,尽管优势突出,但其供骨部位的并发症却不容忽视。同种异体骨移植是治疗骨缺损的另一个选择,但也有疾病传播和免疫排斥等并发症[1-2]。因此,一些人工骨替代材料应运而生。磷酸钙陶瓷与骨有着相似的化学组成,但其溶解性影响破骨细胞的活性[3],高分子聚合物具有生物活性但机械强度低[4],传统人工骨替代材料的缺点限制了其在骨缺损修复中的应用。从我国已获批准上市的骨修复材料产品种类及注册证数量看,人工合成材料产品在各细分领域多于异体骨和异种骨产品,体现了我国人工合成骨修复材料良好的发展态势[5],然而聚乳酸和矿化胶原复合的人工骨材料目前国内还没有取得注册证的上市产品。
人体细胞外骨基质含有无机矿物成分、胶原纤维和水,骨材料中使用的羟基磷灰石(hydroxyapatite,HAp)在结构上类似于骨基质的无机矿物成分[6]。本研究利用胶原/羟基磷灰石(collagen/hydroxyapatite,COL/HAp)研发了新一代仿生骨替代材料矿化胶原,其成分和结构与天然骨组织相似,具有很好的生物相容性和成骨活性,并逐渐应用于临床[7-8]。经临床反馈,需要对材料的生物相容性、生物力学性能和生物降解性进行优化,使其达到最佳的生物适配效果,以提高骨缺损修复的临床愈合率。虽然聚乳酸(polylactic acid,PLA)疏水性较强,细胞黏附能力和诱导成骨能力较差[9],但其可降解,且有着优异的生物相容性和机械性能,使其在生物医用材料中应用广泛[10]。针对以上材料特点,本研究在矿化胶原人工骨修复材料的基础上,引入聚乳酸制备复合支架材料,开发了聚乳酸/矿化胶原复合人工骨修复材料。
本研究使用聚乳酸和矿化胶原为原料,制备了聚乳酸/矿化胶原复合人工骨修复材料。虽然聚乳酸/矿化胶原复合材料有大量的研究,但是目前国内并无已上市产品,也未有用于临床应用的产品。本研究的目的是采用自有专利技术制备材料,研究考察本材料在兔股骨髁松质骨缺损模型上的骨修复情况,并对其安全性和有效性进行评价,为下一步聚乳酸/矿化胶原复合人工骨修复材料的临床试验及研究应用提供依据与参考。
1 材料与方法
1.1 实验材料
聚乳酸/矿化胶原复合人工骨修复材料(NBG),奥精医疗科技股份有限公司自主研发及生产,室温保存。
聚乳酸/矿化胶原复合人工骨修复材料中矿化胶原与聚乳酸的质量比为45∶55~60∶40,其中,矿化胶原中Ⅰ型胶原与羟基磷灰石的质量比为10∶90~20∶80。此人工骨材料先以牛跟腱为原材料制备胶原蛋白,再进行体外矿化制备矿化胶原骨粉,然后将聚乳酸和矿化胶原通过特殊工艺共混,进行冻干造孔制备而成。材料的力学强度≥1.0 MPa,且具有多孔网状结构,孔隙率≥70%,孔隙大小主要分布在25~600μm。
人工骨与兔自体髂骨(autologous graft bone,AGB)的混合比例为2∶1(即2 g人工骨修复材料使用1 g自体骨)。
1.2 实验动物
4~5月龄普通级雄性新西兰大白兔60只,平均(2.5±0.5)kg,由北京隆安实验动物养殖中心提供,动物生产许可证号:SCXK(京)2014-0003。
1.3 仪器设备
CT机(GE Lightspeed Ultra 16,美国);X光机(SIEMENS AG,德国);硬组织切片机(德国Leica公司);光学显微镜(Olympus x71,日本);万能力学试验机(AG-IC 100kN SHIMADZU,日本岛津)。
1.4 实验分组
将60只新西兰大白兔,随机分成5组,每组12只。实验分为空白(Blank)组、人工骨(NBG)组、人工骨混骨髓(NBG+ABM)组、人工骨混自体骨(NBG+AGB)组、自体骨(AGB)组。实验部位为股骨髁松质骨区域。分别在4周、8周、12周对各组进行组织学、影像学评价,12周进行生物力学的评价。
1.5 实验方法
速眠新耳缘静脉麻醉后,无菌条件下取兔一侧膝关节外侧切口,显露股骨外髁,切去骨膜。用直径6 mm电钻由外髁最宽大处中点为进点向内髁方向制作约直径6 mm、深度10 mm的松质骨骨缺损,以探针探测穿通深度及是否穿透对侧皮质骨,骨缺损处植入对应材料,填塞、压实,关闭切口,同法进行对侧股骨髁缺损填充。见图1。

图1 植入实验的操作照片:A.电钻制作骨缺损模型;B.确定缺损模型尺寸;C.缺损模型制作完成;D.植入材料
植入材料后不固定肢体,允许自由活动,连续3天肌肉注射青霉素G钠预防感染。
1.6 实验观察与测试
1.6.1 影像学观察
4.1.5 严格落实专间的相关卫生制度,并符合下列要求:专间内的工用具等所有设施设备必须专间专用,严格清洗消毒,防止出现物流交叉引起的污染;专间内必须设置专人操作,不得在操作期间随意进出专间,造成人流交叉引起的污染;确保操作时专间温度在25℃以下;使用紫外消毒等方法每次使用前进行空气消毒;使用专间二次更衣室进入专间,进入人员要穿戴专用工作衣、帽,清洗消毒手部。
分别于术后4周、8周、12周采用过量麻醉剂处死各实验点兔子,完全剔除软组织、肌肉。拍摄CT、X线片,X线片测试条件为距离100 cm、60 kVp及300 mA,曝光0.03 s,检测骨缺损的修复情况。利用IPP6.0软件对缺损区域灰度值进行定量,总共5个组别,n=3。
1.6.2 组织学观察
切取股骨髁骨标本,将标本于4%的多聚甲醛中固定24 h。从股骨髁上1 cm左右去掉股骨干部分,将股骨髁沿着矢状面使用硬组织切片机切成3~4 mm薄片。标本薄片采用70%、90%、100%梯度乙醇脱水,10%EDTA脱钙液脱钙,树脂包埋,分层切片后HE染色,光学显微镜100倍镜下,沿着缺损4个垂直交叉方向视野随机拍取图片,观察新生骨形成及骨缺损修复情况。
1.6.3 生物力学测试
植入后12周,取每组各3只兔股骨髁,修整成上下面平整的柱状样本(直径10 mm×长度15 mm),取材时用生理盐水持续冲洗,保持样本湿润与冷却,-20℃冰箱保存。
样本室温解冻后,置于万能力学试验机载物台缓慢加载(0.5 mm/min),直至组织出现破裂。记录此时载荷大小、修复组织的应变位移,计算载荷/应变比值,将结果进行比较。
2 结果
2.1 影像学观察
X线图片观察显示:第4周,空白组可见清晰缺损边界,灰度值偏低,自体骨组、人工骨混自体骨组、人工骨混骨髓组、人工骨组缺损部位灰度较高,缺损边界较空白组模糊。第8周,空白组与第4周时相比骨缺损灰度值无明显升高,缺损面积无缩减,而自体骨组、人工骨混自体骨组、人工骨混骨髓组、人工骨组与第4周相比灰度值明显升高,缺损面积明显缩小。第12周,自体骨组缺损边缘明显模糊、消失,人工骨混自体骨组缺损区域也出现高密度骨组织修复影像表现,缺损边缘消失,人工骨混骨髓组、人工骨组缺损边缘较之前明显缩小。具体见图2。

图2 骨缺损修复第4、8、12周的X线图片
X线灰度值统计显示:自体骨组与空白组,以及自体骨组与前一个时间点自身灰度值相比,差异具有统计学意义(P<0.01)。第4周和第8周,5组X线灰度值进行组内比较,差异具有统计学意义(P<0.01)。在第4、8、12周每组间,人工骨组与自体骨组、人工骨混骨髓组、人工骨混自体骨组比较,差异无统计学意义(P>0.05)。具体见图3。
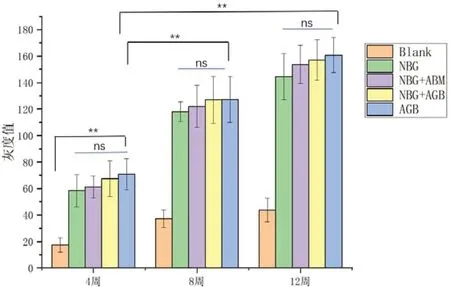
图3 第4、8、12周5组的X线灰度值统计计算
CT三维重建图显示:第4周,自体骨修复效果较为明显,人工骨混自体骨组、人工骨混骨髓组、人工骨组相对于空白组缺损区域明显缩小;第8周,人工骨混自体骨组、人工骨混骨髓组、人工骨组相对于4周时缺损面积明显缩小,自体骨缺损面积修复最明显,仅剩缺损中央小块部分被次高密度影覆盖;第12周,人工骨混自体骨组、人工骨混骨髓组、人工骨组的缺损接近完全修复,修复效果明显优于空白对照组,自体骨组则完全修复。具体见图4。
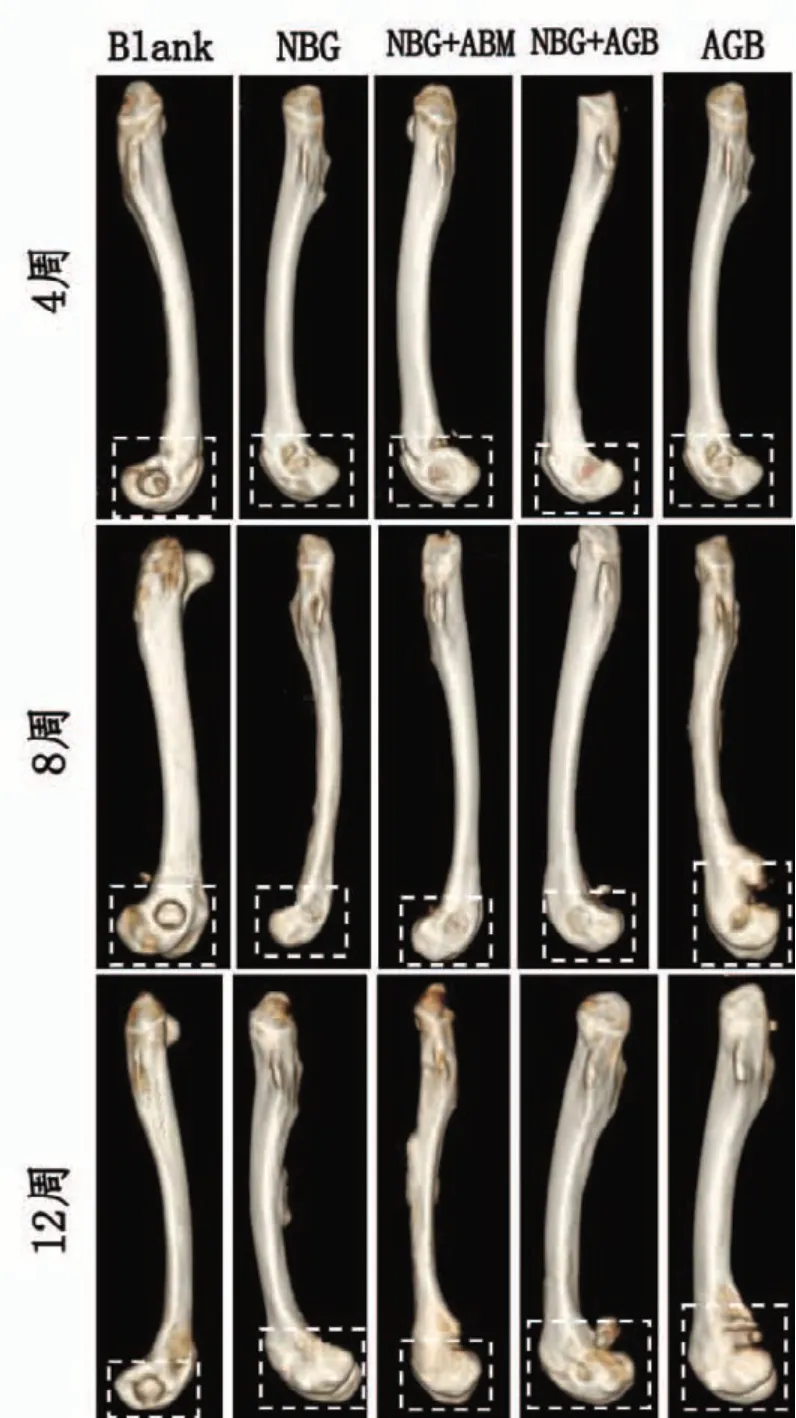
图4 骨缺损修复第4、8、12周时的CT三维重建图
2.2 组织学观察
如图5所示为5组材料在植入第4、8、12周后股骨髁的HE染色(×40)组织学观察照片。第4周,人工骨组在缺损中央仍可见未降解的材料,材料空隙间有大量类骨质和胶原结缔组织填充,少量新生骨从缺损边缘长入。空白组缺损边缘清晰可见,缺损中央以炎性组织为主,稍有结缔组织。第8周,人工骨组材料缺损处降解产物少见,主要被大片状成熟骨和类骨质及结缔组织等填充,与自体骨骨修复效果相仿,无明显差异。而人工骨混自体骨、人工骨混骨髓组材料部分降解,代替是大片新生骨修复填充。空白组则是主要以大片胶原结缔组织填充,有小块新生骨形成。第12周,人工骨组、自体骨组、人工骨混自体骨、人工骨混骨髓组缺损区域出现大面积成熟板层骨覆盖,材料几乎完全降解,缺损边缘界限消失,缺损边缘新生骨与缺损处既有骨紧密结合在一起,组间从新生骨面积、血管密度方面观察无明显差异。空白组缺损边缘也出现新生骨,但缺损边缘仍可见。

图5 植入4、8、12周后股骨髁的组织学观察(HE染色,×40)
2.3 生物力学测试
第12周,从实验组和对照组股骨髁生物力学测试结果可见,人工骨组、人工骨混骨髓组、人工骨混自体骨组、自体骨组股骨髁最大压力载荷较空白组高,差异具有统计学意义(P<0.05)。人工骨组与自体骨组、人工骨混自体骨组、人工骨混骨髓组分别比较,差异无统计学意义(P>0.05)。具体数据见表1。

表1 第12周股骨髁生物力学测试样本的最大载荷
3 讨论
聚乳酸/矿化胶原复合人工骨修复材料结合了聚乳酸和矿化胶原的优点。复合材料中的胶原能促进成纤维细胞、成骨细胞和内皮细胞等在材料表面的生长、扩散和增殖[11],羟基磷灰石则增加了对成骨细胞的调节能力[12]。聚乳酸/矿化胶原复合人工骨修复材料不仅具有良好的机械强度、骨传导性和生物相容性,还具有相互连接的多孔空间,有利于成骨细胞、营养物质和代谢废物的运输[13]。人的骨基质围绕血管在空间里呈网状排列,形成很多相互连接的孔隙[14]。人骨小梁的孔隙率为40%~95%,且当支架孔隙直径在100~500μm时有利于骨整合[15-16]。本研究制备的人工骨复合材料具有多孔网状结构,孔隙率≥70%,有利于成骨细胞和血管向内生长,能满足临床骨修复需求。
本实验表明,除空白组骨缺损部位有少量骨质瘢痕出现外,其余4组均能在术后12周内实现骨质愈合。实验组的新生骨和周围骨质彼此结合,X光和CT三维重建显示,自体骨(AGB)组、人工骨混自体骨(NBG+AGB)组、人工骨混骨髓(NBG+ABM)组、人工骨(NBG)组的修复效果依次降低,但都接近完全修复。组织学切片观察显示,除空白组外,其余组材料已完全降解。生物力学测试表明,自体骨组机械强度最高,但其余实验组的机械强度接近自体骨组。实验期间,5组动物无明显临床异常,也无动物死亡。于各考察时间点解剖动物,手术部位无可见形态变化,病理组织学检查未见感染性炎症反应。
植入后4周、8周、12周,缺损区表面观察及与股骨髁间线垂直剖面切开观察骨缺损修复情况。结合切开骨缺损部分直接观察及专业医生的手触,实验组均表现了良好的骨愈合,新生骨与周围骨质彼此结合,与周围骨质界限变模糊;自体骨组难以区分新生骨与周围骨质界限,彼此之间结合牢固;空白组骨愈合效果较差。
矿化胶原在组成和层次结构上与自然骨高度相似而备受关注,它能为骨细胞成骨过程提供良好的微环境,有利于引导骨组织再生。矿化胶原复合材料在提供成骨微环境的同时,也能促进人骨髓间充质干细胞的增殖和成骨分化。生物材料移植物在体内的炎症反应,是植入物能否发挥作用的关键因素。过重的炎症可导致纤维黏连、瘢痕形成和“材料-骨”结合失败,而适度炎症产生的趋化因子和生长因子有助于诱导成骨分化和新生血管形成,矿化胶原复合材料具有降低支架炎症反应的优点,在与机体免疫系统的相互作用中能取得很好的平衡[17]。聚乳酸/矿化胶原复合人工骨修复材料的原料之一聚乳酸(PLA),是被FDA批准用于生物医学的合成聚合物之一[18-19]。PLA虽具有很好的生物相容性和生物降解性,但会产生酸性降解产物,骨的一些成分可能会因此溶解[20]。研究表明,在PLA基质中添加COL/HAp,可以缓冲PLA降解产物引起的局部pH下降,调节其降解速率,进而提高细胞黏附性、力学性能[21-22]。
本实验采用兔股骨髁松质骨模型,观察期限适中,样本含量合理,通过不同的结果测试,证明了聚乳酸/矿化胶原复合人工骨修复材料优良的生物相容性,生物降解性和骨传导性,并具有一定的力学性能,可以取得很好的骨修复效果。人工骨复合材料可以通过生物安全的原材料合成制备,没有供应不足的问题,并且材料具有一定的孔隙率和力学强度,解决了自体骨来源有限的问题。
尽管如此,对于聚乳酸/矿化胶原复合人工骨修复材料性能的解释必须谨慎,还应考虑到本实验的一些限制。首先,实验动物均选用雄性,可能会造成一定的误差。松质骨的孔隙度和性别具有相关性[23]。雌激素对骨修复的影响,以及对材料降解的作用机制有待阐明。其次,可以考虑增加第4周和第8周的生物力学测试。当人体在植入支架进行骨缺损修复的过程中,需要一定的主动或被动运动来避免肌肉萎缩,同时加快血液循环。若能测试骨修复不同阶段材料的机械强度,有助于指导患者的康复训练,为负荷强度提供参考价值。
总之,在新西兰兔标准尺寸股骨髁缺陷缺损模型的动物实验数据分析得出,制备的聚乳酸/矿化胶原复合人工骨修复材料在临床上可单独使用,也可以混合自体骨髓植入,或者混合自体骨植入,可以促进骨修复和骨再生,可有效地代替单纯自体骨移植引起的并发症。本动物试验研究证明了材料的安全性和有效性,为后续临床试验和应用提供了有效证据。
