PirB通过突触可塑性介导学习记忆的调控作用
2022-06-18鲁秀敏陈兴栋王海燕王永堂
鲁秀敏,黄 华,冯 爽,陈兴栋,王海燕,王永堂
(1.重庆理工大学 药学与生物工程学院, 重庆 400054;2.陆军军医大学 大坪医院 创伤烧伤与复合伤国家重点实验室, 重庆 400042)
0 引言
髓鞘相关抑制因子(myelin-associated inhibitors,MAIs) 在中枢微环境中对轴突再生和突触可塑性具有抑制作用,通过其受体介导的抑制信号导致哺乳动物中枢神经系统(central nervous system,CNS)受损后难以恢复。Nogo受体(Nogo-66 receptor,NgR)是最早被发现的MAIs受体,与MAIs结合后向下游通路传导抑制信号,然而敲除NgR,并不能有效促进神经突起的生长[1]。随后,人们在免疫系统中发现了成对免疫球蛋白样受体B(paired immunoglobulin-like receptor B,PirB)。作为主要组织相容性复合体I(class I major histocompatibility complex,MHCI)的受体,它参与了多种免疫调节反应。与此同时,PirB被发现可在中枢神经中表达,并证实是MAIs的另一个共同受体[2]。此后,大量研究表明,下调PirB的表达不仅可有效促进体外或体内神经突起的生长,还可增强突触可塑性[2-5],在CNS受损后促进其功能的恢复。突触可塑性是指突触为维持其相对稳定随外部环境改变而发生适应性变化的特性,与学习记忆紧密相关。因此,研究PirB的结构、功能及作用机制对CNS损伤后的康复及相关认知与精神障碍类疾病的防治具有重要意义。
1 PirB的配体
PirB早期发现其可作为MHCI受体在免疫系统中发挥重要作用。最近研究发现除免疫系统外,PirB在中枢神经系统中还可作为MAIs及MHCI的受体,参与中枢神经损伤后神经再生的抑制效应及突触可塑性调节。因此,PirB的配体有MAIs及MHCI,均通过PirB在免疫系统和中枢神经系统发挥重要的生物学功能。
1.1 MAIs
影响成年哺乳动物CNS损伤后恢复的MAIs包括Nogo、髓鞘相关糖蛋白(myelin-associated glycoprotein,MAG)和少突细胞髓鞘糖蛋白(oligodendrocyte myelin glycoprotein,OMgp)。Nogo是一种形成内质网小管的膜蛋白,主要由包括Nogo-66和Δ20的胞外抑制性结构域组成,参与神经内分泌或神经内分泌细胞的膜转运。Nogo通过不同的剪接方式形成A、B和C 3种亚型,其中Nogo-A在CNS的少突胶质细胞和神经元中表达,对CNS损伤后轴突再生具有抑制作用[6-7],抗体中和Nogo-A能促进小脑颗粒神经元的轴突生长和存活[7]。Nogo-A的下调也能增强神经元突触可塑性,提高小鼠的空间学习能力[8]。MAG是一种膜性糖蛋白,由外周神经系统(peripheral nervous system,PNS)的雪旺细胞和CNS的少突胶质细胞产生[9-10],选择性地在轴突表面附近的髓鞘中表达,阻断MAG对轴突生长的抑制作用[11],并能治疗多发性神经疾病[12]。OMgp是由CNS中神经元和少突胶质细胞表达的一种糖基磷脂酰肌醇锚定蛋白,对CNS的轴突再生具有抑制作用[10]。体内与体外实验证实,3种MAIs均可通过其受体NgR或PirB抑制轴突再生或突触可塑性[5,11,13-16],中和MAIs的治疗方法能在一定程度上修复中枢神经系统的损伤[17]。综上所述,MAIs及其受体可能是治疗CNS损伤后的重要靶点。
1.2 MHCI
主要组织相容性复合体(major histocompatibility complex,MHC)是一组编码动物主要组织相容性抗原的基因群的统称。MHC又被称为人源白细胞抗原(human leukocyte antigen,HLA)或鼠源H-2,分别位于人的6号染色体短臂上或小鼠的17号染色体上。根据基因的位置和功能,MHC分为Ⅰ、Ⅱ、Ⅲ类,其中MHCI位于一般细胞表面上,在免疫应答过程中参与抗原识别。经典的MHCI是一种三聚体蛋白,由无膜重链、与重链凹槽结合的肽和β2微球蛋白(β2-microglobulin,β2m)轻链组成[18]。尽管MHCI分子在调节机体免疫中的作用已广为人知,但近几年发现其在CNS中同样发挥重要作用[19-20]。在小鼠中,MHCI表达于小胶质细胞和神经元,其组分H2-K1、H2-D1和β2m及其受体PirB在海马体、小脑、脑干和视网膜的表达谱明显不同,且雌性小鼠在CNS的表达程度要高于雄性小鼠[21]。在星形胶质细胞中,MHCI过表达可影响小胶质细胞的增殖、神经元数量和树突棘密度,从而导致小鼠的认知和学习障碍[22-23]。在神经元中,MHCI聚集在特定部位,与肌动蛋白的细胞骨架重叠,参与到发育中的海马神经元的形成过程[24],且在培养的神经元中敲除MHCI会增加树突总长度和树突棘数量,重新诱导MHCI的表达则可消除这些影响[25]。此外,家族性肌萎缩侧索硬化症小鼠的轴突结构和功能也与MHCI紧密相关[26-27]。因此,MHCI不仅参与免疫调节,还可通过PirB影响突触的形成和功能。
2 PirB的分子结构及生物学功能
PirB及其人源白细胞免疫球蛋白样受体B3(leukocyte immunoglobulin-like receptor B3,LILRB3)是在免疫系统及神经系统广泛表达的抑制性受体,在小鼠中,PirB基因位于7号染色体上,分子量约为130 kDa[28]。PirB蛋白是一种I型跨膜糖蛋白,除了细胞膜上,还包括细胞膜外的6种免疫球蛋白样结构域(D1-D6),跨膜区的疏水片段和细胞内的4种含有免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif,ITIM)样结构的多肽(图1)。为明确PirB与其配体相互作用的结构信息,Vlieg等[28]报道了PirB的6个Ig样胞外结构域呈锐角排列,与白细胞免疫球蛋白样受体和杀伤细胞免疫球蛋白样受体有相似的结构,可能也存在相似的功能。
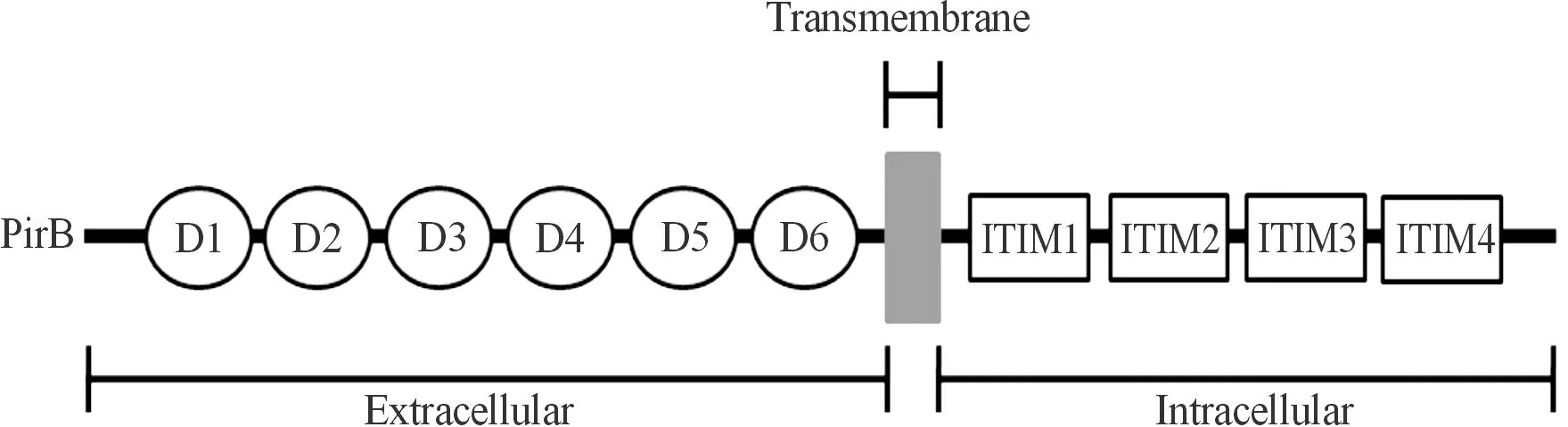
图1 PirB的分子结构
PirB生物学功能广泛,具有调节免疫应答、调控造血系统及通过神经再生抑制效应调节突触可塑性等多种生物学功能。在免疫系统中,PirB主要分布在B细胞、巨噬细胞和树突细胞中,具有抑制免疫排斥、调节巨噬细胞吞噬、抗炎等生物学功能,进而维持免疫应答及内环境的平衡[29-30]。PirB在造血系统可表达于不同类型的造血细胞,参与下调造血细胞的激活和分化,还可通过与分泌的血管生成素样蛋白相互作用,下调血小板的激活,发挥抗血栓的作用[31]。此外,近年来PirB在神经系统研究广泛,主要表达于大脑皮层、海马及嗅球等脑组织中[16,32-33]。在缺血性脑卒中、创伤性脑损伤和脊髓损伤等多种神经损伤性疾病中,PirB蛋白水平显著上调,可负向调控海马和损伤区域神经元的存活与轴突再生[16,34-36];同时,细胞实验也证实PirB过表达会加速早期神经细胞的凋亡[37]。因此,PirB的过表达对CNS损伤后突触可塑性的调节与自我修复是不利的,如果阻断PirB的表达则可以促进轴突再生,对神经元的可塑性和存活率有改善作用,有利于相关的神经功能恢复[2,4-5]。可见,PirB在不同疾病模型中的差异性表达提示其在CNS损伤及修复过程中可能发挥重要作用。
3 PirB通过突触可塑性介导学习记忆的调控作用
PirB作为MAIs及MHCI的共同受体,不仅参与中枢神经损伤后神经再生的抑制效应,还可通过调节突触可塑性,介导学习记忆功能的调控过程。
3.1 PirB与突触可塑性
突触可塑性是指突触为维持其相对稳定随外部环境改变而发生适应性变化的特性。突触可塑性与前折叠蛋白、淀粉样前体蛋白、生长相关蛋白、突触素、突触后致密蛋白、微管蛋白和微管结合蛋白的结构与功能密切相关[38-39],此外,PirB通过MAIs及MHCI信号通路也可介导突触可塑性的改变过程。
研究发现,CNS损伤后,PirB表达显著上调,并通过与Nogo-A的相互作用有效抑制视觉、感觉运动皮质和海马的可塑性[3,40]。PirB不仅介导阿尔茨海默病模型小鼠幼年时视觉皮层突触可塑性的丧失[41],而且能自主特异性调节视觉皮层2或3层锥体细胞的突触密度[42]。阻断PirB能够促进新突触的形成,改变突触后蛋白水平,从而改善结构可塑性,恢复突触棘密度和单眼剥夺后的视力,促进视觉皮质可塑性和弱视康复[3]。
PirB蛋白在海马神经元CA1和齿状回(dentate gyrus,DG)中的表达均随着年龄的增加而升高[43]。在中脑动脉栓塞和坐骨神经损伤模型中,损伤区域PirB蛋白表达上调[37,44]。然而,敲除PirB,则可显著减轻海马神经元受损,减小脑梗死体积,促进皮质脊髓束重塑和神经功能的恢复[44]。同时,PirB作为MHCI的受体,可通过介导MHCI信号的传导影响海马不对称性的形成[45]。内源性MHCI还通过抑制N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)功能,并控制NMDAR诱导的α-氨基羟甲基噁唑丙酸(α-amino-3-hydroxy-5-methylisoxazole- 4-propionate,AMPA)受体的下游转运,从而影响突触可塑性[46-47]。此外,阻断PirB分子信号通路或敲除神经元中MHCI基因还可能通过降低LIMK和cofilin的磷酸化,从而增加树突的总长度和突起的数目[25]。上述研究表明,CNS损伤后,PirB及MHCI的存在可以抑制其突触可塑性。
3.2 PirB通过突触可塑性调节学习记忆
众所周知,突触可塑性是学习记忆的基础。在阿尔兹海默症转基因小鼠模型中,可溶性β-淀粉样蛋白寡聚物通过PirB对海马的长时程增强产生不利影响,PirB也介导了幼年小鼠视觉皮层突触可塑性的丧失和成年小鼠的记忆缺陷[42]。研究发现,脂多糖诱导了海马和皮质中星形胶质细胞的活化,并上调PirB的表达,降低突触素蛋白水平,减少海马区树突长度及树突棘密度,从而抑制学习记忆功能[35]。而在神经元中敲除PirB后,其树突棘密度显著升高,且微小兴奋性突触后电流频率也增加,表明它们接收了更多的突触信号输入[42]。阻断PirB后,脑卒中模型小鼠的梗死灶面积减小,运动皮质的脊髓投射增强,运动功能恢复明显[44,48],且PirB敲除小鼠的学习和记忆能力也明显优于野生型小鼠[32]。另有研究表明,转录激活子-PirB胞外肽融合蛋白(transactivator of transcription-PirB extracellular peptide,TAT-PEP)可以促进双侧颈总动脉闭塞小鼠早期脑缺血区域神经元的存活,改善空间学习和空间记忆能力,使小鼠神经功能在缺血后期有所恢复[4,49]。由此可见,PirB蛋白水平在CNS损伤后表达上调,通过抑制CNS突触可塑性,从而使空间学习和记忆功能受损,而阻断PirB信号的传递则有一定的改善作用。此外,研究还发现MHCI作为PirB的配体在大脑发育过程中与突触可塑性密切相关[27]。体外下调神经元表面MHCI可提高谷氨酸能和γ-氨基丁酸能突触密度[50],而过度表达MHCI则产生相反的变化趋势。在体内,β2m缺陷小鼠的整个发育过程表现出相对较高的突触密度,而且,MHCI还负向调节兴奋性突触的强度,参与维持皮层神经元兴奋和抑制效应的平衡过程[51]。因此,推测PirB可能也参与了MHCI的突触可塑性调节过程,随后得到进一步证实[25]。
3.3 PirB调节学习记忆的信号机制
上述研究表明MAIs/MHCI通过PirB介导突触可塑性参与了学习记忆的调节。但PirB与Nogo结合的亲和力高于MHCI,MHCI与PirB的结合只发生在其N端结构域上,而Nogo与PirB的结合发生在其N端或C端的胞外域上。更重要的是,动力学测试结果表明:Nogo和MHCI是竞争性地与PirB结合[52]。尽管MHCI/PirB信号通路尚不明确,但有关PirB介导的MAIs信号通路比较清楚(图2)。MAIs通过分别与NgR1/p75NTR/Lingo1受体复合体及PirB结合介导神经元突触可塑性的调节过程。NgR/PirB介导的MAIs调节CNS结构可塑性的机制是通过其下游RhoA-ROCK信号的改变来实现的。一方面,NgR1活化的RhoA-ROCK信号通过改变RhoA蛋白的磷酸化水平来调控坍塌反应介质蛋白-2(collapsing response mediator protein-2,CRMP-2)和肌球蛋白轻链2(myosin light chain 2,MLC2)的活性,进而抑制微管组装和肌动球蛋白的收缩,调节海马突触结构和形态,同时又可通过活化LIMK及Cofilin,最终导致肌动蛋白分解。另一方面,SHP-1/2是非受体型蛋白酪氨酸磷酸酶,其活性依赖于与突触紧密相关的NMDAR,也是AMPA受体活性所必需的成分。MAIs通过与PirB结合,导致后者细胞质中的免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motifs,ITIMs)磷酸化,磷酸化的ITIMs能够募集SHP-1/2。其中一条路径作用于支架蛋白POSH,经过LZK/MKK/JNK[53]级联反应作用于肌球蛋白IIA(Myosin IIA);另一条路径作用于Shroom3,经过ROCK/LIMK级联反应作用于纤连蛋白Cofilin,最终2条路径都能导致肌动蛋白解聚,破坏突触的稳定性,影响突触可塑性而降低学习和记忆的能力。因此,NgR1和PirB介导的MAIs信号既独立又相互交汇,在突触的调节过程中发挥重要作用,二者通过突触可塑性共同参与学习记忆的调节。尽管MHCI/PirB信号通路尚不明确,但最近有研究表明,MHCI/PirB介导的突触可塑性调节过程可能也是通过活化LIMK及Cofilin实现的[25],然而相关中间的介导分子目前尚不清楚,需要进行深入的探讨。
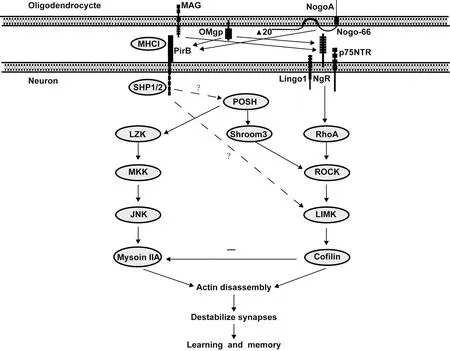
图2 PirB介导突触可塑性调控学习记忆的信号通路
4 结论
PirB作为MAIs及MHCI的受体,可通过抑制CNS的可塑性,削弱学习和记忆的能力。以PirB为靶点,通过基因敲除、抗体中和及选择性阻断剂等方法,促进突触可塑性,有效提高学习记忆能力。因此,明确PirB通过突触可塑性调节学习记忆的机制,为神经损伤及神经退行性疾病引起的认知及精神障碍的预防与治疗提供了新思路。但由于MHCI/PirB信号机制尚不明确,且MAIs相关信号通路涉及的受体及下游信号分子较为复杂,除PirB外,还需结合其他受体,如NgR、p75NTR等,多靶点治疗,才有助于突触可塑性相关认知与学习记忆障碍性疾病的治疗。
