电化学条件下苄醇到芳香醛的选择性氧化
2022-06-17张金凤段荣琛苏玉洁孟令国
张金凤,蒋 越,段荣琛,苏玉洁,孟令国
(淮北师范大学 化学与材料科学学院,安徽 淮北 235000)
0 引言
醛作为众多药物、精细化学品、维生素和香料等材料的制备合成中间体,已然成为日常生活和工业生产中不可或缺的化学原料.经典的有机化学反应中,醇到醛的氧化方法较多[1-2],但多数需要过渡金属以及催化剂的协助(图1)[3-5],比较经典的方法是利用沙瑞特(Sarrett)试剂来实现醇到醛的选择性氧化[6].但过渡金属使用对环境产生的污染不可忽略,这不符合绿色化学和可持续发展的理念[7-8].因此探索一种在无催化剂参与的条件下,使用绿色环保、操作简单的合成策略,实现醇到醛的选择性氧化具有一定的研究意义.
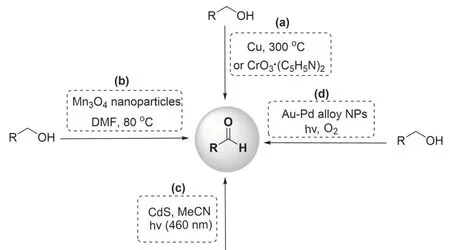
图1 醇到醛选择性氧化的代表性合成方法
电催化合成策略已逐步发展成为一种重要的有机合成方法[9-14],具有易操控、反应条件温和和绿色环保等优点,反应过程是通过电极电势来控制电子转移的能力与速率,实现反应底物在电极处的预氧化或预还原过程.从电氧化反应本质上来看,一般是在阳极失去单电子发生氧化,实现避免氧化剂的 使用.
本实验利用苄醇作为反应底物,以四丁基醋酸铵为电解质,以乙醇为溶剂,在电化学环境下(正极为石墨电极,负极为Pt电极),选择性的氧化苄醇,得到芳香醛类化合物(见图2).电氧化反应整个过程,无需过渡金属试剂和额外氧化剂的协助,实现在环境友好、条件温和的条件下成功氧化苄醇到芳香醛.另一发面该电化学氧化实验反映有机合成化学前沿发展动态,以及绿色合成和可持续发展理念,适宜作为实验教学内容,培养学生实验技能,拓宽专业知识视野,并引导在掌握基础实验知识的基础上,对电化学新型合成方法和策略有所了解.
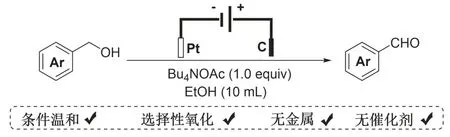
图2 电化学选择性氧化醇到醛
1 实验部分
1.1 实验原理
在非分割电解池环境中(正极为石墨电极,负极为Pt电极),以苄醇作为底物,四丁基醋酸铵作为电解质,在空气氛围中8 mA 的电流强度下,室温反应5 h,得到芳香醛类化合物.该反应可能机理如下(图3):反应底物1a在阳极通过单电子转移形成中间体A,A失去一个H+转变成中间体B,中间体B通过H+转移并在阳极再经过单电子氧化过程形成中间体C,随后中间体C脱去一个H+,最终转化为选择性氧化产物2a,苄醇底物氧化过程脱除下来的H+,在阴极通过还原反应转变为H2释放出去.
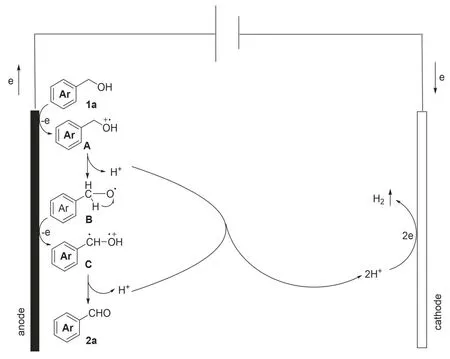
图3 可能的反应机理
1.2 实验仪器与药品
1.2.1 实验仪器
电子天平,恒定电位仪,旋转蒸发仪,核磁共振仪,熔点仪,三用紫外分析仪等;
1.2.2 实验药品
4-溴苄醇,4-氯苄醇,4-甲基苄醇,无水乙醇,四丁基醋酸铵,石油醚,乙酸乙酯等
1.3 实验步骤
1.3.1 条件筛选
为寻找最佳反应条件,选择苄醇为模板反应底物.当以乙腈为溶剂,以四丁基醋酸铵为电解质,在8 mA的恒定电流下室温反应5 h,以47%的收率得到氧化产物苯甲醛(表1,序号1);筛选溶剂发现以乙醇为溶剂,收率可增加到54%(表1,序号2~4);通过增大或减小给予的恒定电流,反应产率不能被进一步的提高(表1,序号5~6);当用四丁基六氟硼酸铵作为电解质,得到41%的收率,但以碘化钾或高氯酸锂为电解质时,仅能发现痕量产物的生成(表1,序号7~9).
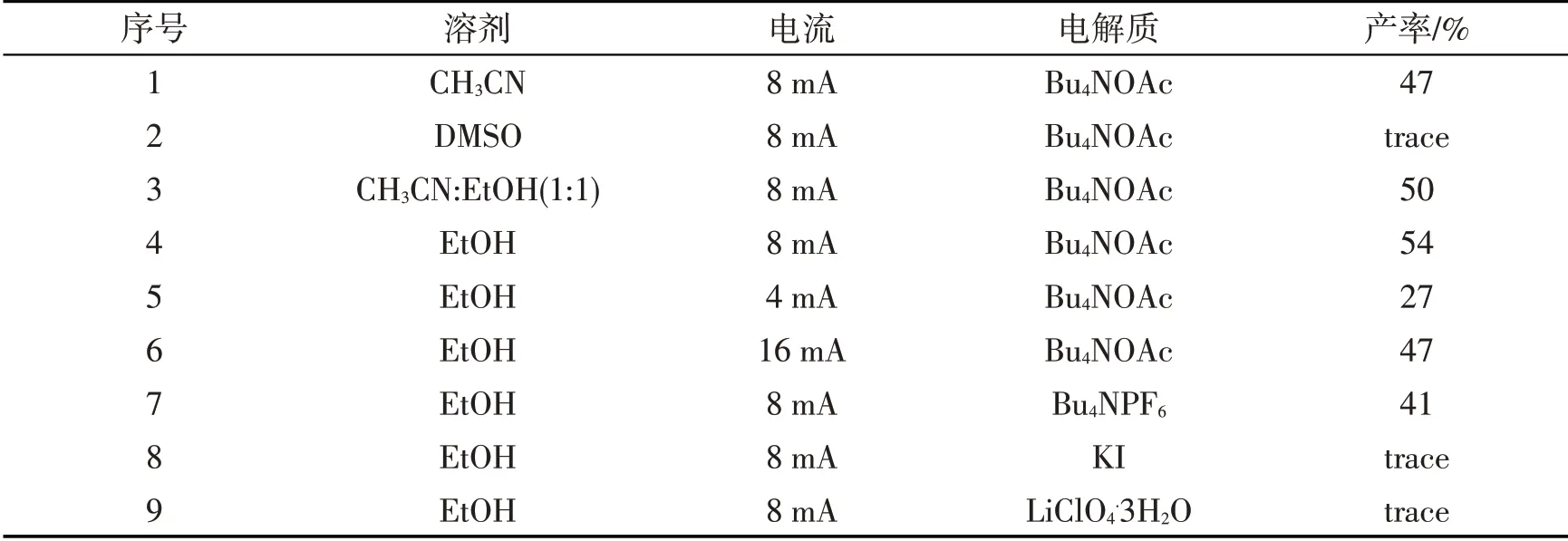
表1 条件优化
1.3.2 对照实验
实验人员首先分为3组.第一、二小组分别向含有EtOH(10 mL)的反应管中,加入4-溴苄醇 (0.5 mmol,94.5 mg)和四丁基醋酸铵(0.5 mmol,93.5 mg);第三小组只加4-溴苄醇,不加电解质四丁基醋酸铵,最后加装有电极(石墨电极和Pt电极)的橡胶塞.
1.3.3 底物拓展实验
实验人员分为四、五、六3个小组.第四小组向装有磁子的反应管中加入4-氯苄醇(0.5 mmol,71.3 mg)和四丁基醋酸铵(0.5 mmol,93.5 mg);第五小组向装有磁子的反应管中加入4-甲基苄醇 (0.5 mmol,61.1 mg)和四丁基醋酸铵(0.5 mmol,93.5 mg),第六小组向装有磁子的反应管中加入肉桂醇(0.5 mmol,67 mg)和四丁基醋酸铵(0.5 mmol,93.5 mg),最后均加入10 mL的EtOH.
将以上6组实验分别用铁架台固定,置于磁力搅拌器上方.将每组实验的正负电极与恒定电位仪电极线正确连接,第一、三、四、五、六组实验都在30.00 V稳压、8 mA的恒定电流下室温反应5 h,第二组实验则在不通电流的条件下反应5 h.1~6组实验结果如表2所示.前3组实验结果表明,该反应需要在恒定电流及电解质的存在条件下才能发生;第四、五2组结果表明对于含有不同取代基的苄醇,也能在优化反应条件下转化为目标产物,但第六组实验结果表明,虽然在优化反应条件下肉桂醇消失,但未发现相应目标产物生成.
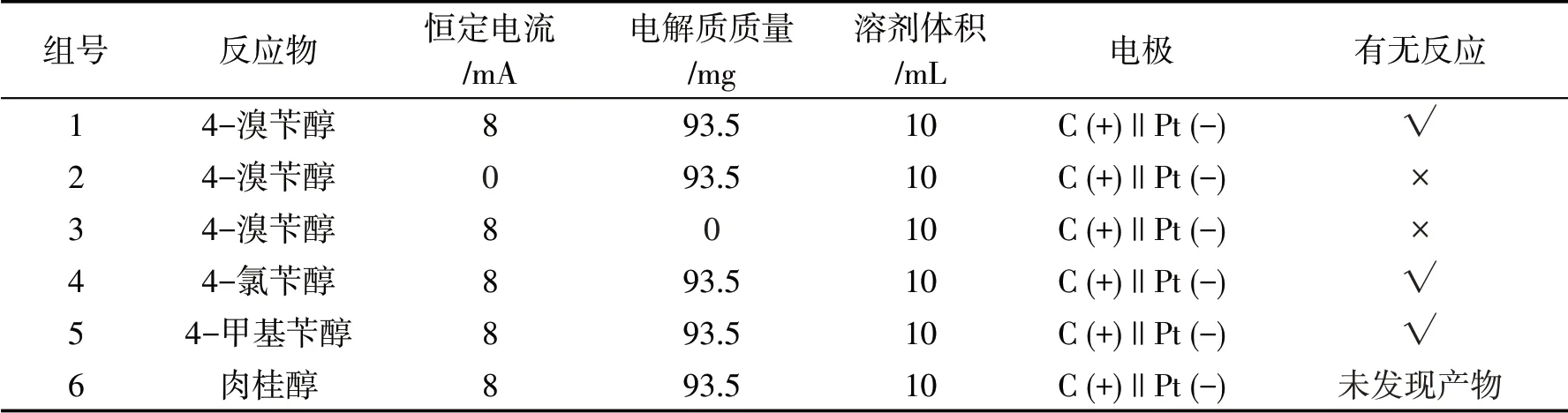
表2 1~6组实验结果对比
1.3.4 反应后处理方法
反应结束后,通过薄层色谱分析,得知第一、四、五小组得到相应产物,分别转移相应反应母液至50 mL茄形瓶内,加入适量粗硅胶,利用旋转蒸发仪蒸除溶剂得到柱分析母样.母样经过柱层析分离(洗脱剂:石油醚/乙酸乙酯=10:1)得到相应产物,然后利用洗脱剂(石油醚/乙酸乙酯=5:1)分离出未参与反应的原料[15].具体实验结果如表3所示.
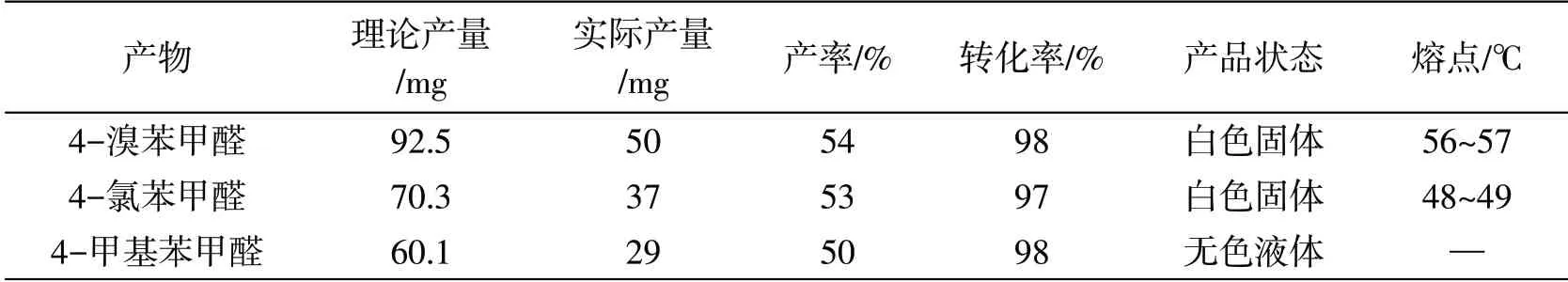
表3 实验记录表
2 结果与讨论
由1~3组实验可知,只有第一组得到目标产物;第二和第三组由于缺少恒定电流或电解质,无法实现选择性氧化得到相应的目标产物;第四、五和六组底物拓展实验显示,当对氯苄醇或对甲基苄醇代替对溴苄醇,也能以中等收率得到相应目标产物,底物广谱性良好,但该电化学氧化反应条件不适应于肉桂醇底物.产物核磁测试数据如下:
4-溴苯甲醛:mp 56~57°C;1H NMR(600 MHz,CDCl3):δ(ppm)9.97(s,1H),7.75~7.73(m,2H),7.68~7.67(m,2H);13C NMR(CDCl3,150 MHz):δ(ppm)191.0,135.0,132.4,130.9,129.7.
4-氯苯甲醛:mp 48~49 °C;1H NMR(600 MHz,CDCl3):δ(ppm)9.98(s,1H),7.83(d,J=7.2 Hz,2H),7.52(d,J=7.8 Hz,2H).13C NMR(CDCl3,100 MHz):δ(ppm)190.8,140.9,134.7,130.9,129.4.
4-甲基苯甲醛:1H NMR(600 MHz,CDCl3):δ(ppm)9.96(s,1H),7.78(d,J=7.2 Hz,2H),7.33(d,J=7.8 Hz,2H),2.43(s,3H).13C NMR(CDCl3,150 MHz):δ(ppm)192.0,145.5,134.2,129.8,129.7,21.8.
3 实验创新性
1)操作简单、条件温和、反应选择性良好.
2)避免过渡金属、氧化剂的使用,符合绿色环保要求.
3)设计的电促进合成醛的化学反应,可用于有机化学教学实验.
4 总结
本实验在电化学条件下,以四丁基醋酸铵为电解质,以乙醇为反应溶剂,成功实现苄醇到醛的氧化.实验创新点是设计的电化学有机合成策略可用于苄醇到醛的选择性氧化,且化学反应选择性良好,另外选用的恒定电流强度较小,实验安全可控,可引入有机化学实验教学,提升学生实验技能,培养学生有机化学实验的兴趣,了解有机合成前沿发展动态.
