磷酸铵镁对羊肾小管上皮细胞的损伤作用
2022-06-17刘若楠邹东敏刘茂军马玉忠
刘若楠,邹东敏,刘茂军,马玉忠*
(1.河北农业大学 动物医学学院,河北 保定 071000;2.山西农业大学 动物医学学院,山西 太谷 030620;3.江苏省农业科学院 兽医研究所,江苏 南京 210014)
羊尿结石是育肥羊一种常发的代谢病,近年来该病的发生呈上升趋势。尿结石可致肾脏功能障碍,肾小管结构受损,而肾小管上皮细胞(RTECs)损伤在结石形成中起着关键的作用,晶体能在受损的RTECs上黏附、聚集[1]。RTECs是肾脏摄取和排泄的主要部位,已被广泛用于肾脏相关疾病的研究[2]。磷酸铵镁(MAP)结石是羊常见的结石类型[3]。研究表明,增加饮食中镁的含量可促进MAP结石的形成,并引起肾损伤[4]。本研究通过检测MAP对羊RTECs的损伤作用,以期为临床防治羊尿路结石提供启示和依据。
1 材料与方法
1.1 实验动物健康小尾寒羊,雄性,3~4月龄,来自河北农业大学实验动物中心;结石病羊来自唐县试验基地,病羊经DR检查确诊。
1.2 试剂磷酸铵镁(上海伊卡);细胞角蛋白18抗体(Abcam公司);山羊抗小鼠IgG-FITC、5%BSA、DAPI、4%多聚甲醛、Triton X-100、CCK-8试剂盒(Solarbio公司);DMEM/F12、胶原酶Ⅰ (Gibco公司) ;胎牛血清 (杭州四季青) ;LDH试剂盒、肌酐、尿素氮、磷、镁测试盒(南京建成);IL-6、TNF-α(DG公司);NBT/BCIP试剂盒、p65 NF-κB、p-NF-κB p65、Caspase-3、Bax、Bcl-2(Bioss公司);山羊抗兔IgG-AP(北京中杉金桥)IκBα、p-IκBα(碧云天)。
1.3 临床症状观察及实验室检查
1.3.1尿沉渣镜检 观察尿结石羊症状,取20份结石羊尿沉渣,置于离心管内,1 500 r/min离心10 min,取沉淀于载玻片上,显微镜观察尿沉渣的形态,将尿沉渣瑞氏染色后镜检。
1.3.2生化指标检测 采集病羊尿液和血液进行实验室检验,观察血液和尿液中的磷、肌酐、尿素氮、镁、尿pH值等指标的变化。
1.4 病理组织观察在河北省唐县试验基地,取结石羊肾脏,固定于10%甲醛溶液中,经脱水、包埋、切片(5 μm)等制作肾组织石蜡切片,HE染色,在显微镜下观察肾组织病理变化。
1.5 细胞培养、鉴定取健康小尾寒羊肾脏,PBS清洗,剥离被膜,取肾皮质,切成约1 mm3的小块,加1 g/L胶原酶Ⅰ,37℃水浴消化2 h。将消化液1 000 r/min离心5 min,弃上清,获取的细胞于37℃、5% CO2条件下培养。取对数期肾小管上皮细胞铺于放有盖玻片的培养板中,待细胞生长至80%~90%时取出盖玻片,PBS清洗3次,4%多聚甲醛固定15 min,0.2% Triton X-100孵育18 min,PBS洗3次;1% BSA封闭40 min,加Cytokeratin-18抗体,37℃反应1 h,PBS洗片3次,滴加FITC标记的羊抗小鼠IgG,37℃避光孵育30 min,PBS洗片3次,DAPI避光孵育5 min,PBS洗5 min×3次,甘油封片,于荧光显微镜下观察。
1.6 CCK-8法检测细胞活力细胞以1×104/孔接种于96孔板中,每组6个重复,分别用0,1,3,5,10和15 g/L MAP处理12,24和48 h后,每孔加入10 μL CCK-8,37℃培养2 h,测定450 nm处的吸光度。细胞存活率(%)=(D试验组-D空白)/(D对照组-D空白)×100%
1.7 ELISA法检测细胞上清液中TNF-α、IL-6含量细胞接种于24孔板中,细胞分组与处理同1.2.4,收集细胞上清液,检测TNF-α、IL-6的含量。
1.8 微板法检测LDH含量细胞接种于24孔板中,细胞分组与处理同1.6,收集细胞上清液,检测LDH的含量。
1.9 Western blot检测蛋白表达细胞接种于6孔板,细胞分组与处理同1.6,弃旧培养基,PBS洗2遍,加RIPA裂解液100 μL,反复吹打,4℃,12 000 r/min离心10 min,BCA法测定蛋白浓度后,进行SDS-PAGE凝胶电泳,转膜,封闭,NF-κB p65、p-NF-κB p65、IκBα、p-IκBα、Caspase-3、Bax、Bcl-2一抗4℃过夜。次日,二抗室温1 h,洗膜,NBT/BCIP试剂盒显色。
1.10 统计分析数据采用SPSS 19.0软件进行分析。采用单因素方差分析(ANOVA),P<0.05表示差异显著,P<0.01差异极显著。
2 结果
2.1 临床症状观察发病羊精神沉郁,食欲减退,不断呻吟咩叫,站立不稳,不断作排尿姿势(图1),但只能排出少量尿液或尿液呈点滴状排出,有时出现血尿。龟头处可触摸到沙粒样结石,排尿痛苦且排尿时间长。后期出现尿淋漓或无尿排出,腹部、包皮或阴囊周围水肿。
2.2 生化检查由表1,2可知,2组羊尿液pH值均偏碱性,但尿结石羊尿液pH明显高于健康组(P<0.01),尿结石羊血液镁离子和磷离子明显升高,与健康羊相比差异极显著(P<0.01),而尿液镁离子和磷离子出现降低,且镁离子与健康组相比差异极显著(P<0.01),血清肌酐和尿素氮也极显著高于健康组(P<0.01)。
2.3 尿液镜检对20份结石羊尿液进行镜检,发现结石羊尿沉渣增多,其中14份尿液可发现磷酸铵镁晶体(图2A)。染色后发现肾上皮细胞和炎性细胞(图2B)。同时在尿液中观察到了精子,可能是由于尿石沉积,堵塞尿道,出现精子逆行进入膀胱的现象(图2C)。
2.4 细胞形态观察胶原酶Ⅰ消化的肾组织能获得较多且完整的肾小管节段(图3A),3 d后有细胞爬出,12 d左右即可铺满瓶底。HE染色,细胞核呈蓝紫色,细胞质呈粉红色,单个细胞形状不规则,呈三角形或长梭形(图3B)。纯化后的羊RTECs经过免疫荧光鉴定,细胞核被染为蓝色(图3D),95%以上细胞胞浆均出现绿色荧光(图3C),说明细胞角蛋白18抗体反应阳性(图3E),证实纯化得到的细胞为肾小管上皮细胞。
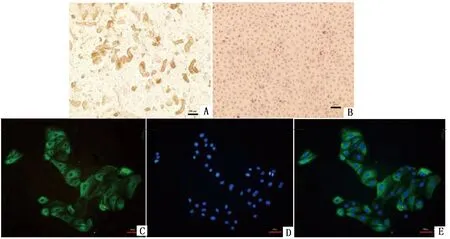
1.消化2 h获得的肾小管节段;B.羊RTECs HE染色;C.细胞角蛋白18的分布;D.DAPI核染;E.C与D合成图
2.5 肾脏HE染色健康羊肾组织结构完整,肾小球、肾小管排列有序,形态清晰(图4A)。结石羊肾脏结构破坏,并伴有出血、淤血。肾小管扩张,管腔内有脱落的上皮细胞和白细胞(图4B);肾小球肿胀,肾小管上皮细胞变性脱落,毛细血管扩张(图4C);肾间质充血出血,肾小管上皮细胞水泡变性(图4D)。

1.健康肾脏;B~D.结石羊肾脏
2.6 细胞活力由图5可知,随着时间和MAP质量浓度的增加,细胞活力呈逐渐下降趋势。5,10和15 g/L MAP对羊RTECs活力抑制作用最明显(P<0.05,P<0.01)。

图5 MAP对羊RTECs活力的影响
2.7 炎性因子检测结果显示,MAP可诱导IL-6和TNF-α的表达 (图6)。5,10和15 g/L MAP对羊RTECs IL-6和TNF-α表达水平与对照组相比有显著性升高(P<0.05,P<0.01)。

图6 MAP对羊RTECs IL-6(左)、TNF-α(右)表达水平的影响
2.8 LDH含量测定由图7可知,随着MAP浓度的增加,细胞上清LDH含量上升趋势(P<0.01),说明细胞出现了损伤。

图7 MAP对羊RTECs LDH表达的影响
2.9 NF-κB信号通路变化由图8可知,羊RTECs在MAP处理不同时间后,p-IκBα和p-NF-κB p65蛋白的相对表达量增加,表明MAP可激活羊RTECs NF-κB炎性通路。
2.10 Western blot检测Caspase-3、Bcl-2和Bax蛋白表达Western blot结果显示,经MAP处理后,羊RTECs中Caspase-3的表达水平极显著性升高(P<0.01),Bcl-2表达水平逐渐降低,Bax水平明显升高,Bcl-2/Bax比值明显降低(P<0.05,P<0.01)。

A.12 h蛋白条带;B,C.图A灰度值分析;D.24 h蛋白条带;E,F.图D灰度值分析;G.48 h蛋白条带;H,I.图G灰度值分析
3 讨 论
羊尿结石作为一种常发的代谢疾病,受多种因素影响和调控,治疗效果不甚理想,给养羊业带来不少损失,因此合理的防控成为预防该病发生的重要手段。迄今为止,其确切机制尚不明确。大量研究表明,结石形成过程中均与氧化应激及肾小管上皮细胞损伤相关,并在结石形成过程中发挥着重要作用[5]。肾小管上皮细胞损伤可以促进细胞与晶体的相互作用,从而导致肾小管上皮细胞的损伤,进而促进结石的形成[6]。本研究结合临床上羊常发的尿结石类型,从细胞水平上探索结石的形成机制,为羊尿结石的防控提供了新思路。

A.12 h蛋白条带;B,C.图A相对定量分析;D.24 h蛋白条带;E,F.图D相对定量分析;G.48 h蛋白条带;H,I.图G相对定量分析
尿结石的形成与体内磷、镁、钙等多种离子代谢相关,他们主要是通过促进或抑制晶体的生长或聚集;或通过影响体内离子环境调控结石的形成;或影响肾滤过功能改变尿液理化性质等方式直接或间接参与结石的形成[7]。本研究结果显示,尿结石羊血液镁离子和磷离子均显著高于健康羊,而尿液中镁离子和磷离子却低于健康羊,可能是由于羊采食过多含磷的谷物,或饲喂过多精料,导致血液中磷的含量增加,而尿液中镁和磷离子形成尿沉渣或参与结石的形成引起含量降低。血液肌酐和尿素氮水平可作为衡量肾小球滤过功能的重要指标。当肾小球滤过功能下降时,血清尿素氮含量明显升高[8]。本研究结果显示,血清肌酐和尿素氮也明显高于健康羊,提示尿结石羊肾脏出现一定的损伤,与闫鸿[9]报道一致。
NF-κB是一种重要的细胞核转录调节因子,调控着细胞的存活、增殖、凋亡等一系列过程。正常情况下,NF-κB p65处于非活性状态,一旦激活后就调节下游基因的表达,促进氧化炎症反应以及细胞凋亡[10]。NF-κB信号通路激活产生炎性因子,导致细胞基底膜暴露供晶体附着[11]。在多种肾脏疾病中,也检测到了NF-κB通路的过表达,在草酸钙处理细胞时,也观察到了NF-κB通路激活,进而促进结石相关蛋白的表达[12]。本研究观察了p-NF-κB p65和p-IκBα的表达情况,结果显示,MAP组中p-NF-κB p65、p-IκBα蛋白表达水平较对照组均有不同程度上调,说明MAP对羊RTECs的损伤作用与NF-κB通路的激活有关,通过激活NF-κB通路促进炎性因子表达,进而在结石形成中发挥作用。TNF-α和IL-6是常用的氧化应激炎症监控指标,主要参与炎症反应。本研究中,MAP组IL-6、TNF-α和LDH水平明显均高于对照组,说明MAP可以促进羊RTECs的炎症反应和细胞损伤,而细胞损伤又为结石形成提供了条件。
Bax和Bcl-2是Bcl-2家族的成员,是细胞凋亡的重要调节因子。Bcl-2是抑制细胞凋亡的关键蛋白。与Bcl-2相反,Bax是一种重要的促凋亡蛋白,Bcl-2与Bax比值的改变对判断细胞是否发生凋亡具有重要意义[13]。Caspase-3是半胱氨酸蛋白酶家族的一员,对细胞凋亡至关重要,其激活被认为是细胞凋亡中的“执行者”[14]。肾小管细胞凋亡被认为是尿路梗阻疾病肾组织损害的重要原因,尿路梗阻使肾小管细胞凋亡水平明显增高[15]。本研究结果显示,MAP增加Caspase-3和Bax的表达,降低Bcl-2水平,促进细胞凋亡,降低Bcl-2/Bax的比值,说明高浓度MAP能促进RTECs凋亡,导致肾脏损害,从而促进晶体在肾脏的黏附聚集。
综上所述,尿结石羊尿沉渣主要为磷酸铵镁晶体,血液和尿液镁离子和磷离子变化显著,并伴有肾脏功能受损,可能与长期饲喂高精料日粮有关。细胞试验表明,MAP能抑制羊RTECs的细胞活力、诱导炎症反应和细胞损伤,激活NF-κB通路,诱导细胞凋亡。
