胞内劳森菌TaqMan实时荧光定量PCR检测方法的建立及应用
2022-06-17刘昌锦魏黄思梧胡换仪刘小兰边彦超邓舜洲
刘昌锦,魏黄思梧,胡换仪,肖 童,林 敏,刘小兰,边彦超,罗 峰,邓舜洲*
(1.江西农业大学 动物科学技术学院,江西 南昌 330045;2.江西金伊博生物科技有限公司,江西 南昌 330013)
猪增生性肠炎(porcine proliferative enteropathy,PPE)又称猪回肠炎,是由专性胞内劳森菌(Lawsoniaintracellularis,L.intracellularis)引起的猪的接触性传染病,以回肠和结肠隐窝内未成熟的肠细胞发生根瘤样增生为特征[1]。PPE首次报道于1931年,目前在全球主要养猪国家均有流行[2]。患有PPE的猪只呈两种临床表现,慢性感染引起猪小肠腺瘤病(porcine intestinal adenomatosis,PIA)临床表现间歇性下痢,精神沉郁,日增重降低,致死率较低,通常发生于4月龄以下猪只;急性感染也称增生性出血性肠病(proliferate haemorrhage enteritis,PHE),以出血性下痢和急性发病死亡为特征,多见于4月龄以上的成年猪[3]。PPE产生的经济影响受地区和临床表现不同而存在差异,但无可争议的是,高L.intracellularis感染率会显著影响猪群的生长发育状况和降低饲料利用率,导致严重的经济损失[4]。
L.intracellularis是脱硫弧菌科(Desulfovibrionaceae)劳森菌属(Lawsonia)的唯一成员,抗酸染色显红色,呈直杆状或弧形,菌长1.25~1.75 μm,宽0.25~0.45 μm,是典型的具有3层外膜的革兰阴性菌,无纤毛和孢子,在细胞培养分离的某些菌群中观察到单独的一根长的极性鞭毛,与菌体在共培养细胞外运动相关。由于其严苛的微需氧生长环境和专性的胞内寄生特性,常规细菌病原鉴定的金标准——分离培养并不适用于临床诊断。L.intracellularis多数情况下呈亚临床感染,即使表现症状,也需要同猪痢疾短螺旋体、沙门菌和猪圆环2型感染之间做出鉴别[5]。组织化学、免疫荧光和免疫组织化学等方法可以确认组织中是否存在菌体抗原,但只能应用于动物死后剖检[5]。目前,国内外广泛应用于活体检测L.intracellularis的方法包括ELISA及粪便PCR,特异性血清抗体通常在感染2周后可以检出。但对ELISA结果的解读更为复杂,母源抗体的干扰、活疫苗的使用和康复后长时间的抗体存在,使抗体阳性率远高于当前猪群实际的感染率。对PPE的病例复制结果表明,受感染的猪在1周后即可在粪便中检出病原菌,具有活性病灶的感染猪在感染后数周都能排出病菌[6-7],因而可以通过粪便PCR的方式对PPE做出临床确诊和早期诊断。
荧光定量PCR较常规PCR灵敏度更高,且全程采用封闭式反应,无需核酸电泳等后续验证,降低了污染风险,推进了早期诊断的时间。本研究针对L.intracellularis的多个阅读框,设计特异性引物和探针组合。首先通过染料法荧光定量PCR验证上、下游引物的特异性,筛选出灵敏度最高的引物合成相应的探针,建立了基于TaqMan 探针的L.intracellularis荧光定量PCR方法,本方法特异性强、灵敏度高且重复性好。将其应用于检测江西地区部分猪场的粪便样品,为PPE的临床防控和地区流行情况调查提供参考。
1 材料与方法
1.1 菌株及阴性核酸L.intracellularis活疫苗购自德国勃林格殷格翰(上海)动物保健品有限公司;经商品化荧光定量PCR试剂盒VetMAXTML.intracellularisKit检测提取自粪便及肠道组织的L.intracellularis阴性核酸,由本实验室保存。
1.2 试剂和仪器粪便DNA提取试剂盒Stool DNA Kit D4015购自Omega Bio-Tek公司;染料法荧光定量PCR预混液ChamQTMUniversal SYBR qPCR Master Mix和探针法荧光定量PCR预混液AceQ®Universal U+Probe Master Mix V2均自南京诺唯赞生物科技有限公司;高纯度质粒小提试剂盒(DP104)购自天根生化科技(北京)有限公司;ABI7500型荧光定量PCR仪购自Applied Biosystems公司。
1.3 引物的设计与合成根据L.intracellularisPHE/MN1-00(AM180252.1)基因组序列,使用Primer 3.0引物设计软件设计50对引物和TaqMan探针组合。使用NCBI的Primer BLAST在线软件进行引物的特异性和保守性比较分析,上、下游引物由金斯瑞生物科技有限公司合成。
1.4 特异性引物的筛选分别以LI阳性活疫苗核酸、LI阴性核酸和ddH2O作为模板,应用SYBR Green Ⅰ染料法荧光定量PCR做上、下游引物的筛选,通过分析比较扩增产物的熔解曲线,选择特异性引物对,对应的探针由金斯瑞生物科技有限公司合成,并以FAM标记探针5′端,TAMRA标记探针3′端,引物及探针见表1。

表1 筛选出用于检测的引物与探针信息
1.5 标准品质粒根据1.4中的筛选结果,参考LI PHE/MN1-00(AM180252.1)的基因序列,扩增靶标段基因由金斯生物科技有限公司合成,质粒命名为pUC57-LI0662。将收到的含标准品质粒的甘油菌进行复苏,按高纯度质粒小提试剂盒提取标准品质粒。用Nanodrop 2000测定质粒浓度,根据公式计算拷贝数:拷贝数(拷贝/μL)=6.02×1023拷贝/mol×标准品质量浓度(mg/L)×10-9/标准品质粒相对分子质量。
1.6 反应条件的优化使用1.4中筛选的引物及探针,参考AceQ©Universal U+Probe Master Mix V2推荐的20 μL体系,将提取的标准品质粒进行10-7稀释后作为条件优化使用的模板,分别对引物及探针浓度(0.2~30 μmol/L)进行优化;反应程序:37℃ 2 min,95℃预变性5 min,95℃变性15 s,60℃退火/延伸30 s,共40个循环。以优化后的反应体系,再针对引物的理论温度值进行上下各2℃的退火温度(58,60,62℃)优化。
1.7 建立标准曲线将pUC57-LI0662C标准品质粒从起始浓度为2.95×107拷贝 /μL,依次10倍比梯度稀释至2.95×101拷贝 /μL ,作为建立标准曲线的反应模板。用优化的PCR体系和程序进行扩增,利用实时荧光定量PCR仪系统软件进行数据采集和分析,绘制标准曲线。
1.8 敏感性试验调整标准品质粒浓度,依次稀释18个浓度梯度至理论拷贝数为1 拷贝/μL,对各梯度样品做3次重复,以样品重复检出结果一致的最低浓度为本方法的检测灵敏度。
1.9 重复性试验重复性试验包括组内重复和组间重复。在组内重复性试验中,对稀释的浓度为2.95×106~2.95×102拷贝 /μL 的标准品质粒作为模板,各进行3次重复,分析产生的Ct值结果并分别计算出CV来验证检测体系的可重复性。
1.10 临床样品的检测同时采用普通PCR[11]和本研究建立的L.intracellularisTaqMan荧光定量检测方法对373份临床样品进行检测,比较两者的检出率。样品为采集自江西地区各地市,共计9个猪场的无临床表现的猪只的新鲜粪便,该9猪场均未使用猪回肠炎疫苗。根据粪样的干湿程度使用灭菌PBS对粪样进行稀释处理,4℃ 3 000 r/min离心5 min,收集上层悬液,按粪便DNA提取试剂盒说明提取核酸。
2 结果
2.1 特异性引物筛选结果分析比较不同引物扩增L.intracellularis阳性疫苗核酸和L.intracellularis阴性粪便及肠组织核酸及ddH2O对照的熔解曲线,结果表明,使用相同软件参数及经过NCBI Primer BLAST验证的引物,在实际应用中存在较大差异,其中扩增得目的峰(37/50)、含疑似引物二聚体峰(42/50)和含非特异性峰(14/50)。选择在扩增中只含目的峰,且Ct值最低的引物对(图1),合成相应的探针。

图1 引物LI-0662qPCR-F1/R1扩增产物的熔解曲线
2.2 反应体系的优化结果引物及探针浓度的优化结果显示,本方法的最佳反应体系为:2×AceQ®Universal U+Probe Master Mix V2 10 μL,上、下游引物(5 μmol/L)各0.4 μL,探针(8 μmol/L)0.2 μL,模板2 μL和ddH2O 7 μL,总体积20 μL。退火温度(表4)在60℃时条件最优,最佳反应程序为:95℃预变性5 min,95℃变性15 s,60℃退火,延伸30 s,共40个循环。
2.3 标准曲线的建立将标准品质粒倍比稀释成2.95×107~2.95×101拷贝/μL 的7个浓度梯度,以ddH2O为阴性对照,进行TaqMan荧光定量PCR扩增,获得了标准曲线和线性回归方程:y=-3.408 5x+39.671(x:log拷贝数,y:Ct值)。结果如图2所示,方程斜率为-3.408 5,截距为39.671,相关系数R2为0.998 1,扩增效率为 96.51%。表明本研究所建立的TaqMan荧光定量PCR方法有理想的扩增效率,在该区间Ct值与拷贝数间存在良好的线性关系,可以用于定量分析。
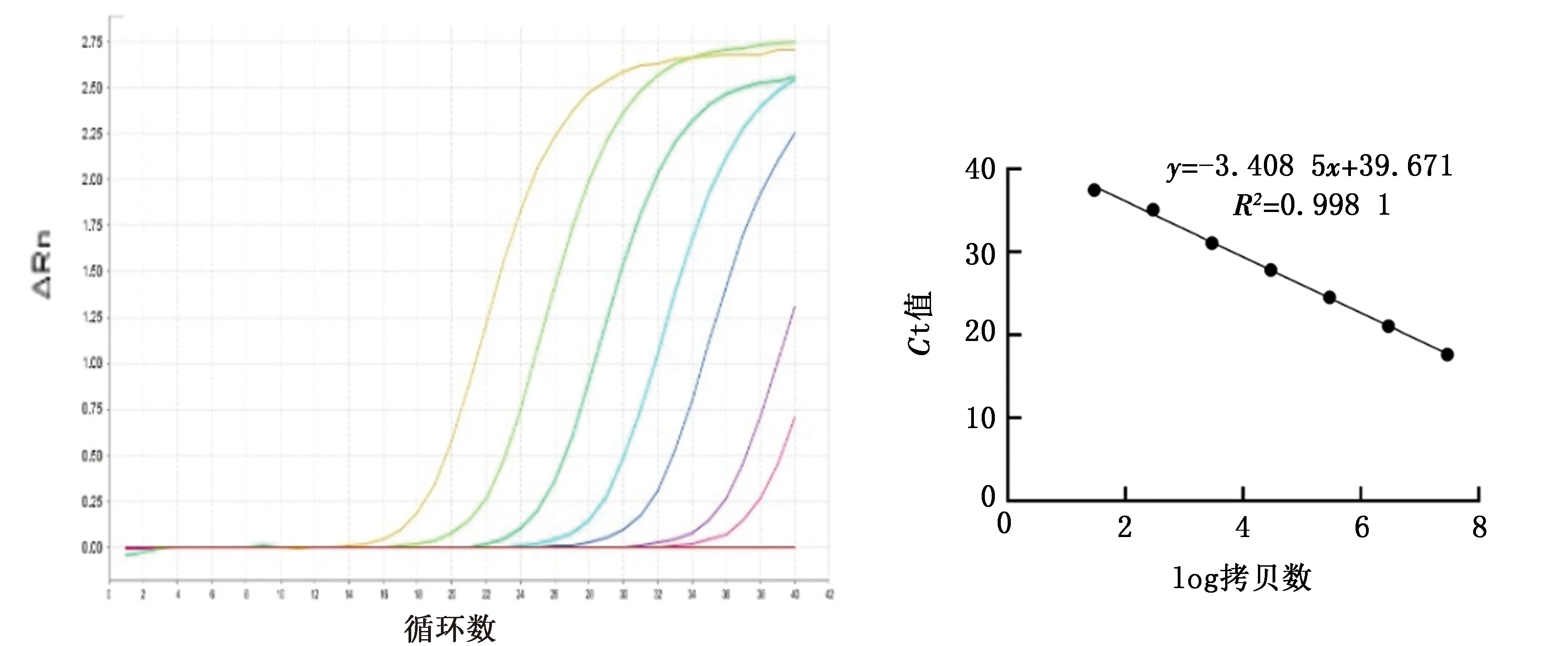
图2 标准品质粒扩增曲线及线性方程
2.4 敏感性试验稀释多个低拷贝数浓度梯度的样品用于敏感性检测,结果见表2,表明所建立的方法检测病毒的最低浓度为5 拷贝/μL,灵敏度较高。

表2 Taq Man 荧光定量 PCR 的敏感性试验
2.5 重复性试验以不同拷贝数的标准品进行组间和组内重复试验,并采用统计学方法分析结果(表3)。本研究所建立的方法,组间CV均小于1%,组内CV均小于2%,表明本方法具有较好的重复性,可以进行稳定、可靠的检测。
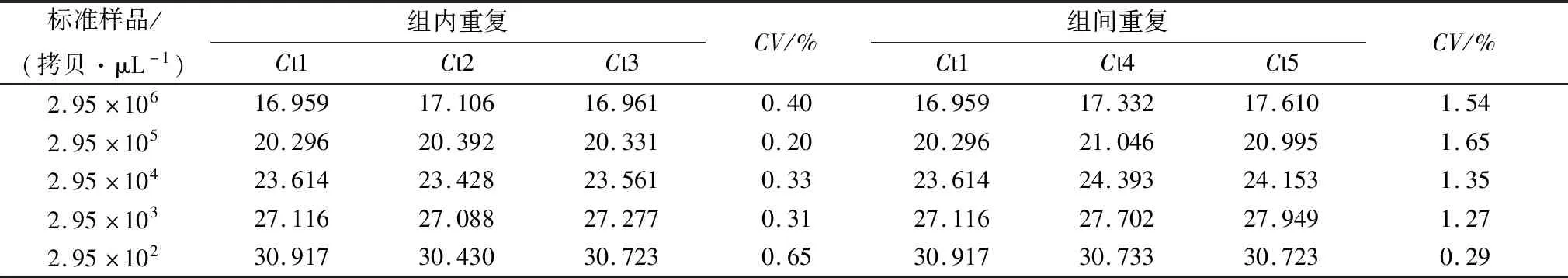
表3 组内及组间重复试验
2.6 临床样品检测结果共检测猪群9个(表4),对比普通PCR和荧光定量PCR检出阳性猪场率分别为77.8%(7/9)和88.9%(8/9);检测粪便样品373份,阳性率分别为21.4%(80/373)和27.6%(103/373)。江西省9个猪群L.intracellularis阳性检出率区间分别为0%~32%和0%~40%。通过对江西不同地区9个猪群在个体水平上的PPE感染情况进行分析,9个猪场PPE感染情况差异很大。

表4 江西地区9个猪场L.intracellularis检出率
将检测的样品来源按照猪的生产阶段分为5类:保育猪、育肥猪、后备猪、经产母猪,结果见表5。
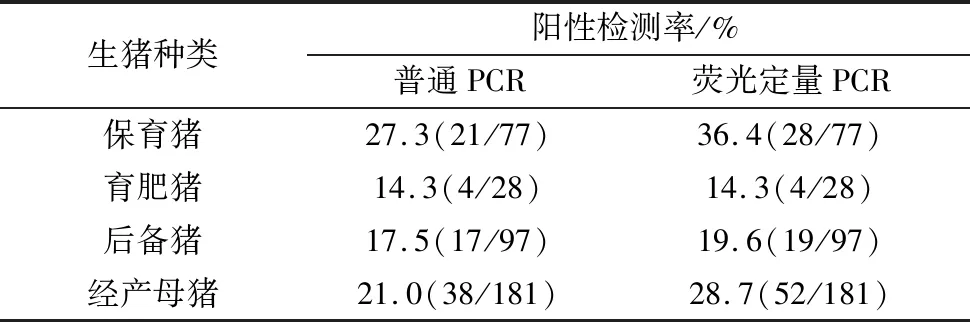
表5 不同阶段猪L.intracellularis检出率
3 讨论
了解PPE的致病过程和宿主的免疫应答机制有助于建立特异性的实验室诊断方法,OBRADOVIC等[8]综述了当前猪对于L.intracellularis感染的免疫应答的研究现状,展望了其在诊断上的潜在应用。当前常用于PPE临床检测的方法包括ELISA和PCR方法[9-10]。在体液免疫应答方面,特异性的IgG和IgM在感染后2周可以检出,抗体水平在3~4周达到峰值,并持续存在达13周。自然感染猪的血清、肠黏膜、粪便和口腔液中均含有中和抗体,可开发多种检测应用场景,但自然感染和疫苗免疫产生的抗体是一致的,目前无法做出鉴别[5]。
试验猪在口服感染1周后可在粪便中检测到病原菌的排出,并可能在长达10周的时间内间歇性地排菌。因而将粪便样品、直肠拭子或肠道样品应用分子生物学方法诊断,可以特异性、快速地检测样品中是否存在L.intracellularis核酸,从而实现确诊[5]。常规PCR、实时荧光定量PCR、环介导等温扩增技术(LAMP)、实时荧光重组酶聚合酶扩增(real-time RPA)等方法被用于L.intracellularis的检测[5,11-14]。
猪肠道微生物环境复杂,以粪便核酸为检测对象需要有高效的核酸提取方法和强特异性、高灵敏度的PCR方法。当前常用于PCR检测的靶标基因为16S rDNA、aspA和dnaA等,由于不同地区和物种来源的菌株在基因组核酸序列上高度保守性[15],实际上可应用于PCR扩增的靶标基因可以有广泛的选择。为建立适用于粪便样品筛查的TaqMan荧光定量检测方法,本研究针对L.intracellularis基因组中的36个保守区共设计了50对不同的荧光定量引物。相比于传统的使用核酸电泳的方法鉴定PCR引物特异性,本研究采用SYBR GreenⅠ染料法的熔解曲线分析进行引物的筛选,对扩增产物中微量的非特异性产物更敏感,且有效降低高拷贝PCR产物开放操作导致气溶胶污染的概率。本研究筛选的特异性引物扩增的靶标基因为LI0662,该基因在L.intracellularis基因组中为单拷贝存在。经敏感性验证,最低检出限度为5 拷贝/μL,与研究报道建立的方法为敏感性相近[16-18],组内CV均小于1%,组间CV均小于2%,重复性良好。
应用普通PCR方法与本研究建立的荧光定量PCR方法对采集自江西地区猪场的373份随机粪便样品进行检测对比,结果显示荧光定量PCR敏感性更高,其中检测场阳性率分别为77.8%(7/9)和88.9%(8/9),总阳性检测出率为21.4%(80/373)和27.6%(103/373),与ARNOLD等[10]对欧洲地区的流调结果,场阳性率90.3%(79.2%~100%)和粪便阳性率26.2%(15.9%~41.5%)接近,说明L.intracellularis在不同地区广泛流行。当前阴性群体数量极少,预示着净化和根除L.intracellularis非常困难,因此减少群内传播和病原循环更为重要[19]。DORS等[20]对70个猪场的9~24周龄育肥猪粪便抽样检测,并将猪场规模和生产方式作为影响因素做生物学统计,其育肥群粪便阳性检出率达34.7%,相关性分析显示全进全出式生产影响L.intracellularis的流行,可显著降低感染率。对本次采样的粪便样品按生产阶段划分,结果显示经产母猪和保育猪群有较高阳性率,分别为28.7%(52/181)和36.4%(28/77),母猪群体的持续排菌增加了L.intracellularis场内循环的风险,保育群的感染与仔猪断奶重、猪场生产方式和环境条件相关[19],基于检测结果可调整合理的生产方式,结合适时的药物保健和疫苗免疫的方式进行干预,以降低感染率提高生产效益。
综上所述,本研究建立的L.intracellularisTaqMan实时荧光定量PCR检测方法可以应用于实验室检测,为疾病确诊和指导临床生产提供依据。同时该方法是有效的流行病学调查工具,可以用作监测地区PPE的流行。
