鸽新城疫病毒Ⅵ-HZ株的分离鉴定及其遗传进化分析
2022-06-17周红波王永山
钱 晶,刘 雪,王 玮,周红波,王永山*
(1.江苏省农业科学院 兽医研究所 农业部兽用生物制品工程技术重点实验室,江苏 南京 210014;2.仲恺农业工程学院 动物科技学院 岭南现代农业科学与技术广东省实验室,广东 广州 510225;3.华中农业大学 动物医学院 农业微生物学国家重点实验室,湖北 武汉 430070)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)强毒株引起禽的一种急性、热性、高度接触性传染病,给养禽业造成巨大经济损失。世界动物卫生组织(Office International Des Epizooties,OIE)将其列为法定报告的动物疫病,我国将其列为一类动物疫病[1-2]。NDV属于副黏病毒科(Paramyxoviridae)、正禽腮腺炎病毒属(Orthoavulavirus),为单链负股、不分节段、有囊膜的RNA病毒,直径大小为100~400 nm,其基因组共编码6个结构蛋白和2个非结构蛋白,基因排列方式为3′-NP-P/V/W-M-HN-F-L-5′[3]。根据F基因的遗传序列分析,可将NDV分为ClassⅠ和ClassⅡ两类,每类又可进一步分为多种基因型或基因亚型,其中ClassⅡ类至少包括20个基因型[4]。近年来,鸽ND零星散发,病死率居高不下,从病死鸽中分离的NDV多为ClassⅡ类的基因Ⅵ型毒株[5-10],该基因型毒株与商品疫苗株(基因Ⅱ型和基因Ⅶ型等毒株)存在明显抗原性差异,防控难度较大。
为了解江苏地区鸽NDV的分子流行病学情况,本研究从江苏某鸽场疑似ND病鸽中分离并纯化NDV,测定其致病性指标,通过获取病毒全基因组序列,分析核苷酸同源性和主要结构蛋白分子特征,绘制F基因系统发育进化树,分析其遗传进化情况,为本地区的鸽源NDV的分子流行病学调查提供研究依据。
1 材料与方法
1.1 病料、细胞、动物与主要试剂病料样品来源于2017年江苏省淮安市洪泽区某鸽场疑似ND病鸽;鸡胚成纤维细胞系(DF-1)由本实验室保存;9日龄SPF鸡胚购自兆丰华生物科技(南京)有限公司;30日龄非免(NDV抗体阴性)草鸽购自山东高翔肉鸽养殖场;病毒核酸提取试剂RNAiso Plus(Code No.9108)、反转录试剂PrimeScriptTMⅥ 1st strand cDNA Synthesis Mix(Code No.6215A)、Premix TaqTM(Code No.R004A)、TB Green®Fast qPCR Mix(Code No.RR420Q)、感受态细胞DH5α(Code No.9057)、pMDTM19-T载体(Code No.6013)购自宝日医生物技术(北京)有限公司;NDV血凝抑制试验抗原/阳性血清、禽流感病毒H5、H7和H9亚型血凝抑制试验抗原/阳性血清购自哈尔滨国生生物科技股份有限公司。
1.2 病毒的分离培养与鉴定将病料研磨后用无菌PBS重悬,8 000 r/min离心5 min,取上清经0.45 μm 过滤后按常规方法接种9日龄SPF鸡胚,每日观察鸡胚死亡情况,弃24 h内死亡胚,未死亡的鸡胚于接种5 d后无菌收集鸡胚尿囊液,对其进行血凝(HA)试验和血凝抑制(HI)试验,样品HA和HI效价高于或等于4 log2,且不与禽流感病毒血凝抑制试验抗体反应,视为NDV阳性。将病毒接种至DF-1细胞单层,进行3轮空斑纯化,纯化的病毒在9日龄SPF鸡胚上连续传3代,直至HA效价稳定,保存-70℃备用。
1.3 病毒的毒力指标测定与致病性分析根据OIE标准测定病毒的MDT(鸡胚平均致死时间)、ICPI(1日龄雏鸡脑内接种致病指数)以及EID50(鸡胚半数感染量)。30只试验鸽随机分为3组(试验组、同居组、对照组),每组10只,每只均标有脚标,试验组以肌注方式接种0.1 mL 105EID50的病毒量,同居组不接种病毒但与试验组同居饲养,对照组以肌注方式接种0.1 mL灭菌生理盐水,每天记录鸽临床表现,绘制存活率曲线;攻毒后在第3,5,7,10和14天分别取泄殖腔棉拭子,采用荧光定量PCR法检测其排毒情况;对病死鸽进行解剖,采用HE染色法对鸽主要脏器进行处理,分析脏器病理组织学变化。
1.4 病毒全基因组测序与F基因序列分析参考多株鸽NDV序列,设计11对引物(表1),按照试剂盒说明书提取病毒基因组并反转录成cDNA,利用PCR法分段扩增,将产物连接至pMDTM19-T载体并转化DH5α感受态细胞,挑取阳性克隆,引物合成与测序均由通用生物系统(安徽)有限公司完成。使用DNAStar lasergene 8.0和SnapGene 2.3.2软件对全基因组序列进行拼接并将其上传至GenBank数据库。选取20株参考株序列,利用MEGA 7.0软件分析全基因组核苷酸同源性,基于F基因全长序列,通过最大似然算法(Maximum Likelihood,ML),使用GTR+I+R参数模型,Bootstrap值设定为500次重复绘制系统进化树。

表1 病毒全基因组测序用引物
2 结果
2.1 病毒的鉴定与毒力测定病料样品接种鸡胚后收集的鸡胚尿囊液具有凝集鸡红细胞活性,其HA效价为6 log2,该样品能与NDV血凝抑制试验阳性血清发生反应,不与禽流感病毒H5、H7和H9亚型血凝抑制试验阳性血清发生反应;通过空斑纯化后,获得HA效价为8 log2的NDV,命名为NDV Ⅵ-HZ株。该毒株MDT为80 h,ICPI为1.2,EID50为107.0/0.1 mL,属于中等毒力型NDV。
2.2 病毒对鸽致病性分析将Ⅵ-HZ株人工感染试验鸽,观察鸽群精神状态、采食量与病死情况,连续观察14 d。试验组鸽群第5天采食量下降、第7天出现明显流泪、扭头、排水样黄绿稀粪,死亡率为60%(6/10)(图1);同居组鸽群第10天出现明显腹泻和神经症状,死亡率50%(5/10)(图1);对照组鸽群采食正常、无临床症状。病死鸽剖检可见脑膜充血、水肿及肠道出血。病理切片结果显示,试验组病死鸽脑组织水肿,气管纤毛脱落、黏膜下层出血,肺脏部分区域有大量炎症细胞聚集,胃黏膜层正常、无病变,肝脏内有明显的脂肪变性、淤血及灶状的炎症反应,小肠绒毛上皮细胞脱落坏死、黏膜固有层有炎症反应,脾脏内有少量巨噬细胞聚集;同居组病死鸽脑组织水肿,气管黏膜下水肿,肺脏内有炎性细胞浸润及出血现象,胃黏膜层正常、无病变,肝脏内有少量淤血及灶状的炎症反应,小肠绒毛上皮细胞脱落坏死、黏膜固有层有炎症反应,脾小体增生、动脉淋巴鞘增厚(图2);对照组鸽脑组织正常,气管完整、黏膜层无明显变化,肺脏正常,胃黏膜上皮结构完整,肝脏组织正常,小肠结构完整、无病变,脾脏正常(图2);这表明Ⅵ-HZ株能对鸽脑、肠造成损伤最为严重,其次为气管、肺、肝脏和脾脏。试验组鸽群泄殖腔棉拭子在第3天检测到NDV核酸阳性,排毒高峰在第7天;同居组鸽群泄殖腔棉拭子在第7天检测到NDV核酸阳性;对照组鸽群泄殖腔棉拭子并未检测到NDV核酸(表2)。综上表明,Ⅵ-HZ株对鸽具有较强致病性和传播能力。

图1 Ⅵ-HZ株感染鸽的存活曲线

图2 Ⅵ-HZ株感染鸽的病理组织学观察

表2 试验鸽染毒后不同时间泄殖腔排毒检测
2.3 病毒全基因组测序与分析通过分段PCR扩增得到11段1 200~1 700 bp的条带,3′端leader和5′端trailer序列长度分别为55和114 nt,利用软件拼接获得Ⅵ-HZ株基因组(MW412840),全长15 192 nt,排列方式为3′-NP-P/V/W-M-F-HN-L-5′,6个结构蛋白(NP、P、M、F、HN、L)基因开放阅读框(ORF)序列长度分别为1 470,1 188,1 095,1 662,1 716 和6 615 bp,对应编码氨基酸数分别为489,395,364,553,571和2 204个;由P基因通过“RNA”编辑产生2个非结构蛋白(V、W)基因ORF序列长度分别为720和684 bp,对应编码氨基酸数分别为239和227个;Ⅵ-HZ株F蛋白裂解位点氨基酸序列为112KRQKRF117,具有NDV强毒的分子特征。
2.4 同源性和进化树分析通过病毒全基因组序列核苷酸同源性分析,Ⅵ-HZ株与国内外鸽源分离株(国内鸽源分离株MW147626_Pigeon/BJ2018和国外鸽源分离株JN986839.1_Pigeon/IE/806/04)的同源性较高,分别为91.0%和92.8%,但与我国经典强毒F48E8株、英国经典强毒Herts33株、水禽源强毒NA-1株以及疫苗V4株、LaSota株、Mukteswar株同源性较低(83.6%~87.4%)(表3)。基于F基因系统发育进化树可见,Ⅵ-HZ株位于ClassⅡ类基因Ⅵ型分支中,与Ⅵ.2.2.2型毒株亲缘关系最近(图3)。
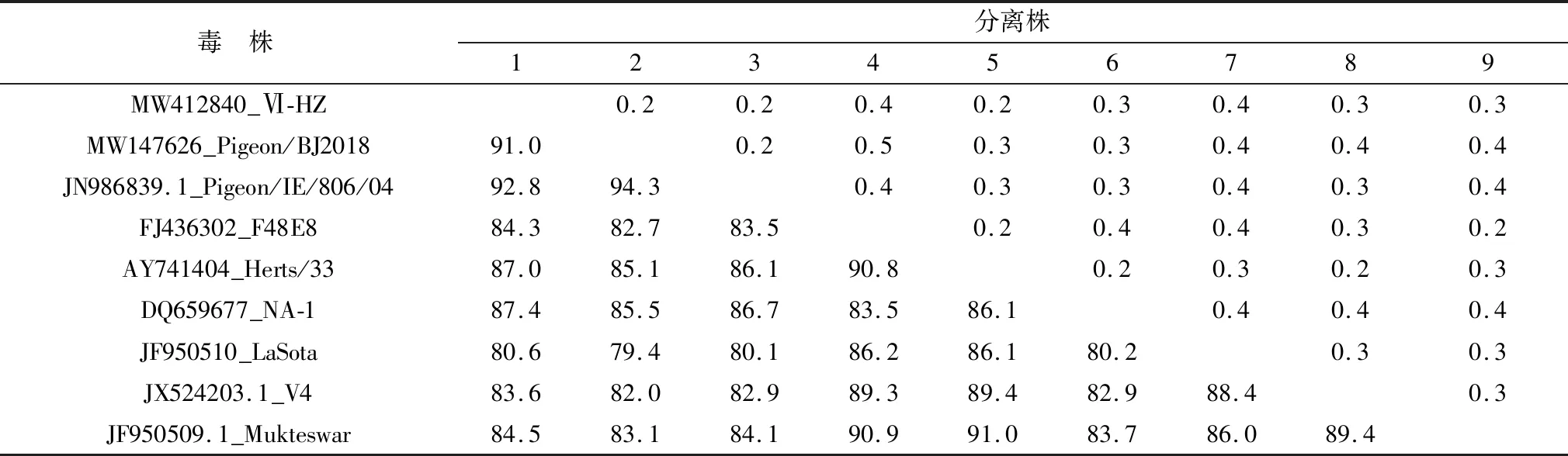
表3 分离株与参考株核苷酸同源性分析

图3 基于F基因核苷酸序列的系统进化树
3 讨论
鸽ND主要以腹泻和神经症状为特征,对各品种鸽和各段龄鸽均易感,严重危害养鸽业健康发展。自1926年ND首次发现以来,世界上曾经历过4次ND大流行,其中鸽源NDV被认为是第2,3次ND大流行的主要病因[1,3-4]。然而,由于缺少鸽专用ND疫苗,通常采用鸡ND疫苗来预防,对鸽源NDV的保护效果不佳[11-12],使得鸽ND疫情在我国部分地区(北京、天津、广东、山东、江苏等)经常发生[5-10,13-14]。
本研究于2017年从江苏某鸽场分离到1株鸽源NDV(Ⅵ-HZ株),根据OIE推荐的毒力判定标准,该毒株属于中等毒力型,这与大多数鸽源NDV分离株的毒力相当[5-9,13-14]。然而,Ⅵ-HZ株F蛋白裂解位点却表现为强毒分子特征(112KRQKRF117),表明F蛋白裂解位点并非是适用于评价鸽源NDV毒力。动物回归试验结果表明,Ⅵ-HZ株可致鸽群出现典型腹泻和神经症状,对鸽脑、肠造成损伤最为严重,其次为气管、肺、肝脏和脾脏,与鸽场病死鸽的临床症状相符;同居组也在随后几天出现排毒和临床症状,表明Ⅵ-HZ株具有较强致病性和传播能力。病毒排毒在感染第3天即可检测到,而此时鸽群的临床症状并未完全表现,提示在发现疑似或确诊病例时及早进行干预,因此加强鸽NDV的日常监测对防控鸽ND尤为重要。
NDV只有一种血清型,DIEL等[15]基于F基因47~420 bp高变区进行遗传进化分析,将ClassⅡ类中的基因Ⅵ型NDV划分为Ⅵa、Ⅵb、Ⅵe、Ⅵf、Ⅵh、Ⅵj、Ⅵk、Ⅵn等多个亚型,我国主要流行Ⅵb亚型毒株。依据最新的NDV分类规则,ClassⅡ类基因Ⅵ型毒株可进一步划分为至少7个基因亚型(Ⅵ.1、Ⅵ.2.1.1、Ⅵ.2.1.1.2.1、Ⅵ.2.1.1.2.2、Ⅵ.2.1.2、Ⅵ.2.2.1、Ⅵ.2.2.2)[4],本研究分离的Ⅵ-HZ株属基因Ⅵ.2.2.2亚型毒株,该亚型即为之前报道的Ⅵe亚型,与Ⅵb亚型(新分类为Ⅵ.1亚型)毒株有一定的遗传距离,提示鸽源Ⅵ亚型毒株适应性进化以及多样性需引起重视,摸清鸽源NDV分子流行病学情况十分必要。
综上所述,本研究从江苏地区病鸽中分离到1株鸽源NDV,与当前国内鸽源NDV流行株之间具有较高的同源性,该病毒对鸽具有较强致病性。同时,研究结果有助了解本地区鸽源NDV的遗传进化情况,为后续开展鸽专用ND疫苗和生物防治产品研制奠定基础。
