基于药物转运体的小白菊内酯衍生物ACT001的跨膜转运机制和耐药性研究
2022-06-17孙英辉尚海花慈小燕武卫党闫凤英伊秀林
孙英辉 ,尚海花,慈小燕, ,武卫党 , ,王 泽,崔 涛 , ,曾 勇, ,闫凤英 , ,伊秀林 ,
1.天津药物研究院有限公司 生物技术中心,天津 300301
2.中国医学科学院 药物代谢新技术创新单元,天津 300301
3.北京协和医学院&中国医学科学院放射医学研究所,天津市放射医学与分子核医学重点实验室,天津 300192
4.天津和创生物技术有限公司,天津 300301
5.天津药物研究院有限公司 释药技术与药代动力学国家重点实验室,天津 300301
6.天津中医药大学研究生院,天津 301617
银胶菊属银胶菊Parthenium hysterophorusL.是一年生草本,具主根,径直立,叶变化多样,头状花序小,放射状。民间多用银胶菊治疗偏头痛、风湿病等。银胶菊的乙醇提取物经萃取分离得到小白菊内酯。小白菊内酯(图1-A)是一种倍半萜烯内酯类(sesquiterpene lactones,SLs)化合物[1]。研究表明,小白菊内酯具有明显的抗肿瘤作用,对恶性胶质瘤、急性髓细胞白血病 、前列腺癌等多种癌症具有治疗作用[2-4]。然而,小白菊内酯水溶性较差,限制了其临床研究和应用。小白菊内酯衍生物ACT001(图1-B)为11βH,13-二甲基氨基含笑内酯的富马酸盐,母核为愈创木烷型倍半萜烯内酯。ACT001是一个抗肿瘤高活性化合物,现作为抗脑胶质瘤I类新药正在进行临床研究阶段[5-7]。脑胶质瘤是胶质瘤的最恶性变体,约占所有固有脑瘤的一半。当前的治疗方案为切除、放射治疗合并化学治疗[8-11]。但是,胶质瘤是浸润式生长的,手术很难完全切除,迫切需要一种安全有效的药物来治疗脑胶质瘤。因此,ACT001作为抗脑胶质瘤I类新药具有明显的临床价值和广阔的应用前景。

图1 小白菊内酯 (A) 和ACT001 (B) 的化学结构Fig.1 Chemical structures of parthenolide (A) and ACT001 (B)
药物转运体是一类存在于细胞膜上对药物跨膜转运起重要作用的膜蛋白,可分为摄入型转运体和外排型转运体。摄入型转运体主要包括有机阳离子转运体(organic cation transporters,OCTs)、有机阴离子转运体(organic anion transporters,OATs)、有机阴离子转运多肽(organic anion transport peptides,OATPs)等;外排型转运体以P糖蛋白(P-glycoprotein,Pgp,又名MDR1)和乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)为代表[12-13]。外排转运体在血脑屏障、肠上皮细胞壁膜、肝和肾小管细胞中高表达,可调节药物的吸收、分布和排泄等药动学过程[14-15],且与抗肿瘤药物的耐药性密切相关。
小白菊内酯衍生物ACT001作为抗脑胶质瘤I类新药,目前尚未报道其与药物转运体作用的关系。本研究应用人药物转运体基因转染细胞/囊泡、人结肠腺癌细胞(Caco-2、LS-180),较为全面地研究了ACT001对药物转运体的抑制作用、底物亲和性和诱导作用,从药物转运体角度阐明了ACT001的跨膜转运及可能发生的药物-药物相互作用和耐药性。
1 材料
1.1 药品与试剂
ACT001(批号20120704,质量分数>99%)购自尚德药缘科技有限公司;14C-氨基马尿酸(批号1558673)、3H-硫酸雌酮(批号140331)、3H-地高辛(批号160624)、14C-溴化四乙胺(批号130311)、3H-牛磺胆酸(批号140403)购自美国ARC公司;UTIMA Gold闪烁液(批号77-15481)购自美国PerkinElmer公司;奎尼丁(批号10138583,质量分数≥98%)购自美国Sigma公司;丙磺舒(批号15327,质量分数>99%)、利福平(批号11246,质量分数>98%)、维拉帕米(批号18578,质量分数>99%)、BCRP抑制剂Ko143(质量分数>99%)购自美国MCE公司;异甘草素(质量分数>98%)购自国家药品和生物制品控制研究所;DMEM培养基(批号8117283)、胎牛血清(批号1912660C)、0.25%胰酶-EDTA(批号1919590)购自美国Gibco公司;100×青链霉素混合液(批号20180624)、PBS缓冲液(批号P1010)、二甲基亚砜(dimethyl sulfoxide,DMSO,批号520C032)、DEPC水购自北京索莱宝科技有限公司;Transwell®12孔聚碳酸酯膜转运板(批号20917020)购自美国Corning公司;P-gp抗体、BCRP抗体购自ABclonal Technology公司;β-actin抗体购自英国Abcam公司;山羊抗兔IgG抗体购自Abkkine公司;TRNzol Reagent购自北京天根生化科技有限公司;逆转录试剂盒、实时定量试剂盒购自Roche公司;MTS细胞增殖检测试剂盒购自天津厚普生物技术开发有限公司。
1.2 仪器
CKX53型倒置显微镜(日本Olympus公司);BS124S型分析天平(德国Sartorius公司);CO2培养箱、台式高速冷冻离心机、Varioskan Flash酶标仪(美国Thermo Fisher Scientific公司);Tri-Carb 2910 TR型放射性液体闪烁仪(美国PerkinElmer公司);FLE712AA型多孔滤器(日本Advantec公司);Millcell ERS-2型跨上皮电阻仪(美国Millipore公司);ZHWY型上海智诚恒温振荡器(北京华威兴业科技有限公司);LCMS-8060型三重四极杆液质联用仪(日本岛津公司);Life ECO PCR基因扩增仪(杭州博日科技有限公司);Mastercycler ep Realplex2qRT-PCR仪(德国Eppendorf公司)。
1.3 细胞株
药物转运体过表达单克隆细胞株MDCKOAT1、S2-OAT3、HEK293-OATP1B1、HEK293-OATP1B3、S2-OCT1、S2-OCT2、MDCK-MDR1及空白载体转染细胞(MDCK-Mock、S2-Mock、HEK293-Mock)均由日本富士生物医药研究所赠予;BCRP/胆盐输出泵(bile salt export pump,BSEP)/mock基因表达 inside-out vesicles购自日本GenoMembrane公司;Caco-2细胞及LS-180细胞购自国家实验细胞资源共享平台。
2 方法
2.1 细胞培养
所有细胞系均于培养皿内,用含10%胎牛血清、1%青链霉素的DMEM培养基,于37 ℃(S2细胞在33 ℃)、5% CO2和相对湿度90%的培养箱内培养,当细胞融合度为80%~90%时,用胰酶消化成细胞悬液。本实验所用的Caco-2细胞为35~38代,LS-180细胞为26~30代,MDCK-MDR1细胞为25~28代、MDCK-BCRP细胞为26~29代,转运体细胞为26~35代。
2.2 MTS测试
将MDCK细胞(2.5×104/mL)、HEK293细胞(8×104/mL)、S2细胞(8×104/mL)、Caco-2细胞(5×104/mL)、LS-180细胞(5×104/mL)分别接种于96孔板中培养24 h后,加入新鲜培养基配制系列浓度为1~100 μmol/L的ACT001的含药培养基孵育48 h。随后加入MTS溶液孵育,每隔一定时间取出,采用多功能酶标仪测定每孔在492 nm处的吸光度(A)值。每个浓度设置6个复孔。半数抑制浓度(half inhibitory concentration,IC50)使用GraphPad Prism软件计算。
2.3 ACT001对转运体的抑制作用
2.3.1 摄入转运体 将细胞悬液用培养基稀释至1.5×105/mL接种至24孔板(OATP1B1、OATP1B3基因表达细胞接种于D-聚赖氨酸包被的24孔板)培养至各孔细胞长满。将24孔板置于37 ℃水浴中移去培养液,添加37 ℃缓冲液孵育10 min后移去缓冲液,添加含放射性标记的探针底物和各浓度ACT001(0.3~100 μmol/L)的混合溶液,在设定时间移去探针底物溶液,加入1 mL冰浴缓冲液终止反应。各转运体的放标底物及浓度、阳性抑制剂及浓度和给药时间见表1,每个浓度设置3个复孔。每孔添加0.1 mmol/L NaOH裂解细胞,将细胞裂解液转移至EP管中,加入闪烁液,用闪烁仪测定样品中的放射性强度。

表1 各转运体给药实验条件Table 1 Test conditions for each transporter administration
2.3.2 外排转运体P-gp 取MDCK-MDR1细胞悬液调整密度至1×105/mL,接种于Transwell 12孔板中,在细胞层顶端(AP)每孔加0.5 mL细胞悬液,基底端(BL)每孔加1.5 mL新鲜培养基。培养6 d,得到完全分化的细胞单层。弃去Transwell小室两端的培养基,在两侧均按比例加入37 ℃预热的HBSS溶液,置于37 ℃细胞培养箱中平衡20 min;弃去HBSS,在BL加入1.5 mL预热的添加含3H-地高辛和各浓度ACT001(0.3~100 μmol/L)的HBSS溶液,在AP加入预热的0.5 mL空白HBSS溶液;置于37 ℃振荡器孵育15 min;取100 μL细胞AP的转运液加入闪烁液,充分混匀后测定转运液中的3H-地高辛浓度。
2.3.3 外排转运体BCRP、BSEP ACT001对2种转运体的抑制作用通过囊泡实验测定。分别配制2种转运体所用缓冲液和反应体系后,将inside-out vesicle放置于37 ℃水浴孵育5 min,加入混合液反应5 min后加终止液终止反应。将反应液和终止液混合置于滤膜上滤掉液体并用冰缓冲液清洗后取下滤膜,转移至EP管中,加入闪烁液,用闪烁仪测定样品中的放射性强度。放射性标记底物、阳性抑制剂、给药时间见表1。
计算抑制率,以抑制率代表抑制作用强度。使用Prism 5.0软件计算ACT001抑制各转运体转运活性的IC50。各数值间的差异性分析采用t检验。
抑制率=(U-U0)/(Uc-U0)Uc表示对照组的DPM(每分钟衰变数)值,U0表示Mock细胞的DPM值,U表示各给药组的DPM值
2.4 LC-MS/MS检测
2.4.1 色谱条件 Acquity UPLC®BEH C8色谱柱(50 mm×2.1 mm,1.7 μm);流动相A为甲醇-乙腈(1∶1),流动相B为5 mmol/L甲酸胺-10%甲醇水溶液,梯度洗脱:0~3 min,90% B;3~4 min,90%~10% B;4~5 min,10%~90% B;1.5~2.8 min切入质谱仪。体积流量为0.3 mL/min;进样量2 μL;柱温40 ℃;内标(IS)为吲达帕胺。
2.4.2 质谱条件 ESI离子源,正离子模式;雾化气体积流量为3 L/min;加热气体积流量为10 L/min;接口温度为300 ℃;去溶剂气温度为250 ℃;热块温度为400 ℃;干燥气体积流量为10 L/min;扫描方式为多反应监测(multiple reaction monitoring,MRM)。
2.4.3 样品处理 配制梯度标曲及质控样品,线性范围为0.5~25 μmol/L(用50%甲醇溶液配制)。取50 μL 50% Hanks液,分别加入50 μL甲醇和50 μL内标溶液(含1 μg/mL吲达帕胺的甲醇溶液),再加入50 μL标液/样品,涡旋1 min;取出50 μL溶液,分别加入450 μL 50%甲醇稀释,涡旋混匀,4 ℃、12 000 r/min离心10 min;再取100 μL溶液于内插管中,4 ℃、12 000 r/min离心10 min,取上清液,进样2 μL,进行LC-MS/MS定量分析。
2.4.4 方法学验证 ACT001的LC-MS/MS定量分析方法经过了完整的方法学验证,在该分析方法下,细胞中的其余物质不会干扰待测物和内标的测定,ACT001的线性范围为0.5~25.0 μmol/L,ACT001保留时间为2.13 min。配制低、中、高浓度(0.5、10、50 μmol/L)的ACT001溶液,分别测定化合物的稳定性、方法的准确度和精密度。结果显示,ACT001稳定性的RSD<15%,精密度的RSD为4.9%,准确度的RSD为5.7%。
2.5 底物研究
取Caco-2细胞悬液调整密度至2×105/mL接种于Transwell 12孔板中。连续培养21 d,得到完全分化的细胞单层。弃去Transwell旧培养基,加入37 ℃预热的HBSS溶液平衡20 min;取出板子后,在细胞AP加入0.5 mL预热的含有ACT001的HBSS溶液,BL加入1.5 mL预热的HBSS,以此检测细胞AP到BL的转运;在细胞AP加入0.5 mL预热的HBSS,BL加入1.5 mL预热的含有ACT001的HBSS溶液检测BL到AP的转运。37 ℃恒温振荡器孵育15 min后吸取转运液,测定其中ACT001浓度。在检测外排转运蛋白BCRP抑制剂Ko143(5 μmol/L)对ACT001在MDCK-BCRP/Caco-2细胞单层上转运的影响和P-gp抑制剂维拉帕米(30 μmol/L)对ACT001在MDCK-MDR1/Caco-2细胞单层上转运的影响时,用同时含有抑制剂和药物的给药液代替只含药物的给药液即可。ACT001的给药浓度为3、30 μmol/L。每个浓度重复3次。用LCMS/MS测定ACT001在转运液中的浓度。
以表观渗透系数(apparent permeation coefficient,Papp)的大小反映药物透过单层细胞的能力以及药物吸收的速度。
Papp=V×(dC/dt)×1/A×1/C0
V表示接收室的溶液体积(AP端为0.5 cm3、BL端为1.5 cm3),A表示膜的面积(1.13 cm2),C0表示药物的起始浓度,dC/dt表示接收室在单位时间获得的药物浓度,即接收室的最终浓度除以转运时间
以外排率(efflux ratio,RE)代表药物外排能力的大小,通过RE可以预测药物在肠吸收是否存在药物转运蛋白介导的外排或摄入。
RE=Papp(B-A)/Papp(A-B)
A-B代表AP→BL,B-A代表BL→AP,当所测药物的RE≥2时,表示药物可能为肠道外排转运蛋白的底物,当所测药物的RE≤0.5时,表示该药物可能为肠道摄入转运蛋白的底物
2.6 诱导研究
LS-180细胞以1.5×105/mL接种于24孔板中,于37 ℃、5% CO2的培养箱中培养24 h,每孔加入1 mL含诱导剂和待测药的培养基。其中分为空白组:含0.1% DMSO的培养基;阳性药组:分别为含10 μmol/L利福平、1 μmol/L异甘草素的培养基;给药组:含3、10、20 μmol/L ACT001的培养基;每组设置3个复孔。每24小时更换1次相同的培养基,设置不同诱导时间组,细胞与诱导剂作用时间分别为48、72、96 h。诱导完成后用TRNzol总RNA提取试剂处理细胞,提取RNA并逆转录为cDNA,用qRT-PCR进行扩增检测。
以逆转录的cDNA为模板,qRT-PCR反应体系为Fast Start Universal SYBR Green Master(Rox)12.5 μL、上游引物(10 μmol/L)0.75 μL、下游引物(10 μmol/L)0.75 μL、水9 μL、cDNA模板2 μL,总体积25 μL。反应条件为95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,40个循环,60~95 ℃熔解曲线分析。引物序列见表2。采用2−ΔΔCt法,测定样品中P-gp、BCRP目的基因和β-actin内参基因的Ct值,计算给药组细胞基因与空白组细胞基因相比较的表达倍数。
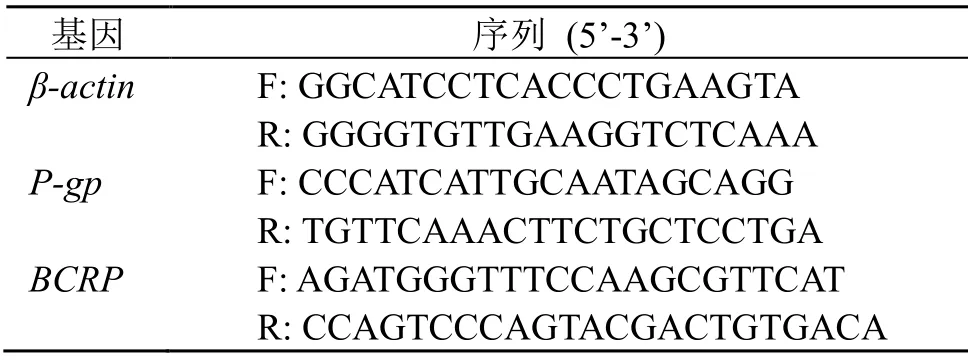
表2 引物序列Table 2 Primer sequences
另取诱导完成后的样品用RIPA试剂处理提取总蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶分离蛋白后进行Western blotting检测。使用Gel-Pro Analyzer 4软件对结果进行灰度分析;使用GraphPad Prism 5软件对结果进行绘制柱形图。
3 结果
3.1 MTS检测
MTS实验考察化合物对细胞的毒性作用,LS-180细胞实验结果显示,ACT001对LS-180细胞的IC50大于40 μmol/L;以相同的方法处理实验使用的其他细胞,结果表明ACT001对Caco-2、S2、MDCK和HEK293细胞的IC50均大于100 μmol/L,说明本研究所使用的浓度在细胞安全合理范围内,对细胞没有毒性。
3.2 ACT001对转运体的抑制作用研究
转运活性抑制实验中ACT001的给药浓度为0.3~100 μmol/L,结果见图2,ACT001对OAT1介导的14C-氨基马尿酸、OAT3介导的3H-硫酸雌酮、OCT1介导的14C-溴化四乙胺、OCT2介导的14C-溴化四乙胺、OATP1B1介导的3H-硫酸雌酮、P-gp介导的3H-地高辛、BSEP介导的3H-牛磺胆酸的转运活性无影响或影响较弱,IC50均大于100 μmol/L;对BCRP介导的3H-硫酸雌酮转运活性有明显抑制作用,即对BCRP的转运活性有显著影响,IC50为48.6 μmol/L。
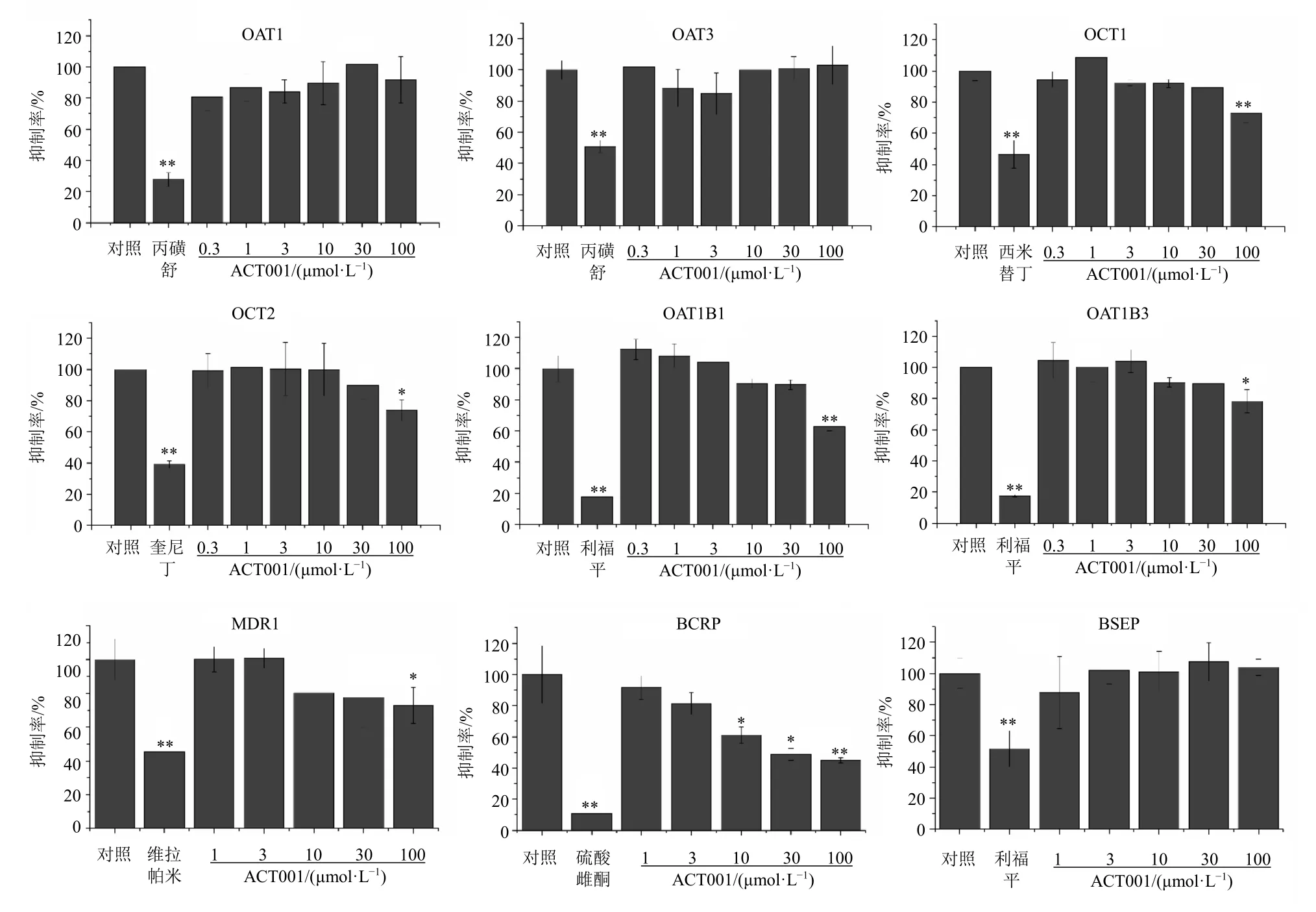
图2 ACT001对临床关键转运体的抑制作用 ( , n = 3)Fig.2 Inhibitory effect of ACT001 on clinical key transporters ( , n = 3)
3.3 底物研究
预试实验结果表明,30 μmol/L ACT001给药15 min时Papp值最佳。如表3所示,ACT001在30 μmol/L浓度下,摄入方向的Papp值为2~4,有外排现象,添加BCRP抑制剂Ko143后外排被明显抑制。
表3 ACT001在Caco-2、MDCK-BCRP和MDCK-MDR1细胞中双向转运的Papp值和RE值 ( , n = 3)Table 3 Papp and RE of ACT001 bi-directional transport in Caco-2, MDCK-BCRP and MDCK- MDR1 cell (, n = 3)
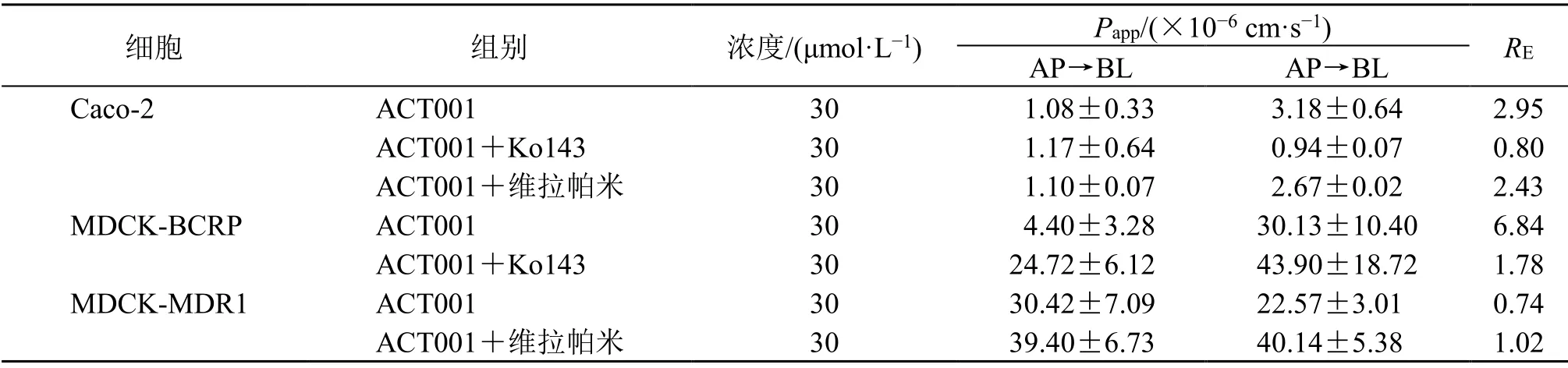
表3 ACT001在Caco-2、MDCK-BCRP和MDCK-MDR1细胞中双向转运的Papp值和RE值 ( , n = 3)Table 3 Papp and RE of ACT001 bi-directional transport in Caco-2, MDCK-BCRP and MDCK- MDR1 cell (, n = 3)
细胞 组别 浓度/(μmol·L−1) Papp/(×10−6 cm·s−1) RE AP→BL AP→BL Caco-2 ACT001 30 1.08±0.33 3.18±0.64 2.95 ACT001+Ko143 30 1.17±0.64 0.94±0.07 0.80 ACT001+维拉帕米 30 1.10±0.07 2.67±0.02 2.43 MDCK-BCRP ACT001 30 4.40±3.28 30.13±10.40 6.84 ACT001+Ko143 30 24.72±6.12 43.90±18.72 1.78 MDCK-MDR1 ACT001 30 30.42±7.09 22.57±3.01 0.74 ACT001+维拉帕米 30 39.40±6.73 40.14±5.38 1.02
以上数据说明ACT001在Caco-2细胞中跨膜能力中等,存在外排转运体BCRP参与的主动转运,在较高浓度时外排更强,且加入BCRP抑制剂后ACT001的跨膜能力达到良好。在MDCK-BCRP细胞中,ACT001在30 μmol/L浓度下给药,摄入方向的Papp值随着给药浓度的增大而降低,在30 μmol/L浓度下,外排现象明显,添加BCRP抑制剂Ko143后外排被明显抑制;在MDCK-MDR1细胞中,ACT001没有表现出外排现象,添加P-gp抑制剂也不产生影响。说明ACT001为外排转运体BCRP的底物。
3.4 诱导研究
如图3所示,ACT001孵育72 h可不同程度地上调LS-180细胞外排转运体P-gp、BCRP的mRNA表达水平,诱导96 h及以上会造成LS-180细胞的脱落,因此本研究只讨论诱导72 h时的结果。

图3 ACT001对LS-180细胞P-gp和BCRP mRNA表达的影响 ( , n = 3)Fig.3 Effect of ACT001 on P-gp and BCRP mRNA expressions in LS-180 cells ( , n = 3)
利福平作为常用的P-gp诱导剂,对P-gp的诱导作用显著,诱导倍数达到26.2倍。10 μmol/L的ACT001孵育72 h可分别上调P-gp和BCRP的mRNA表达水平8.98、8.21倍,而3、20 μmol/L的ACT001孵育72 h可使P-gpmRNA表达水平上调3.28、1.66倍;相同条件下,使BCRPmRNA表达水平上调2.43、1.54倍。蛋白诱导结果见图4,3、10、20 μmol/L的ACT001使P-gp蛋白表达水平分别上调3.06、3.76、1.44倍;相同条件下,使BCRP蛋白表达水平分别上调3.95、2.92、0.26倍。

图4 ACT001对LS-180细胞P-gp和BCRP蛋白表达的影响 ( , n = 3)Fig.4 Effect of ACT001 on P-gp and BCRP protein expressions in LS-180 cells ( , n = 3)
4 讨论
Caco-2细胞系来源于人结肠腺癌细胞,同源性好,在体外培养条件可自发进行肠道上皮样分化形成微绒毛结构,生成细胞间紧密连接蛋白,且表达各种蛋白载体和酶,与小肠上皮细胞结构类似[16]。应用Caco-2细胞模型得到的数据与体内数据基本一致,条件可控,重复性好,且相比于动物模型,实验成本低,国内外广泛应用于药物跨膜转运能力和跨膜转膜机制进行评价。与Caco-2细胞模型相比,LS-180细胞模型中参与外排转运体表达调控过程的人孕烷受体(pregnane X receptor,PXR)和类固醇外源异物受体(steroid and xenobiotic receptor,SXR)表达水平较高[17-18],因此诱导效果更为显著,是转运体体外细胞诱导试验中的常见模型[19]。
脑胶质瘤具有很高的发病率和死亡率。ACT001是针对胶质瘤的I类新药,具有明显的临床价值。先前文献报道大鼠组织分布研究中在脑组织检测到ACT001的存在,但本研究首次证明ACT001是BCRP的底物,BCRP在血脑屏障和肿瘤细胞中高表达[20-21],ACT001虽跨膜能力良好,但因是BCRP的底物,可被外排导致其生物利用度受到影响。
前期研究基于ACT001的结构特征和PBPK/PD模拟结果显示ACT001具有较高的血脑屏障渗透性,并未报道ACT001与药物转运体的具体作用关系。本研究首次从转运体角度证明ACT001是BCRP的底物以及BCRP和P-gp的诱导剂。BCRP和P-gp在血脑屏障中高表达,因此,ACT001在实际应用中可能会因BCRP和P-gp的外排作用而使药效受到一定影响。
ACT001的临床前药动学研究表明,大鼠(雄鼠)单次poACT001(20、100、500 mg/kg)体内血药浓度分别可以达到约5、25、50 μmol/L[22],因此本研究选择3、10、20 μmol/L 3个浓度作为底物研究和诱导作用研究的给药浓度,不会对细胞生长增殖造成影响;该研究结果对ACT001的实际临床应用具有参考价值。
本研究表明,ACT001对P-gp和BCRP蛋白具有诱导表达的作用,P-gp、BCRP二者与代谢酶具有较高的底物重叠率,对P-gp和BCRP表达水平产生诱导时,由于竞争和诱导作用,极有可能会出现转运体和代谢酶[23-24]介导的药物-药物相互作用[25-27],这为正确理解ACT001可能存在的药物相互作用提供了新的思路。另外,肿瘤细胞中P-gp和BCRP过表达会使肿瘤细胞产生耐药性,导致治疗效果不理想。提示ACT001在临床上应与BCRP抑制剂联合使用,这可能会增加ACT001在脑组织和肿瘤细胞内的暴露量,从而提高疗效。本研究为ACT001与药物转运蛋白之间的关联提供了新的见解,并为其临床试验和应用提供了合理、有效的参考。
利益冲突所有作者均声明不存在利益冲突
