基于Box-Behnken设计和主成分分析法研究当归-苦参药对的提取工艺及不同比例配伍对急性心肌缺血大鼠的影响
2022-06-17王蕊娇张育龙董培良
王蕊娇,张育龙,董培良,韩 华*
1.黑龙江中医药大学,黑龙江 哈尔滨 150040
2.黑龙江中医药大学中医药研究院,黑龙江 哈尔滨 150040
药对是中药配伍中的最小单元,因其组成简单及具备中药配伍的特点,成为现代复方研究的主要方向之一[1]。目前临床上运用的治疗皮肤病的当归苦参丸,其药方以当归、苦参为药对,常用当归贝母苦参丸加减方治疗消化系统和心血管系统多种疾病[2-3]。相关研究发现当归-苦参药对也具有治疗心肌缺血的作用[4]。研究表明[5-7],心肌缺血发生时肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、乳酸脱氢酶(lactate dehydrogenase,LDH)均上调。当归始载《神农本草经》,性温味甘、辛、苦,入心、肝、脾经,为血病之要药[8],具有补血活血、调经止痛、润肠通便之功效,主要化学成分为酚酸类(阿魏酸、绿原酸等)、内酯类(藁本内酯、洋川芎内酯、欧当归内酯等)、香豆素和黄酮类、多糖类[9-10]。苦参始载于《神农本草经》,味苦、性寒,入心肝、胃、大肠、膀胱经[11],具有清热燥湿、杀虫利尿、消炎、抗心律失常、抗炎、抗病毒、抗肿瘤等的药理活性[12-13],主要化学成分为生物碱类(苦参碱、氧化苦参碱、槐果碱和氧化槐果碱等)和黄酮类[14-15]。目前,在国内外对当归-苦参不同配比的化学成分研究以及其治疗心肌缺血的相关研究较少。
Box-Behnken设计(Box-Behnken design,BBD)是一种3因素3水平设计,通过多元2次方程拟合相关因素与响应值的关系以寻求最佳工艺参数[16]。主成分分析(principal component analysis,PCA)法是将原有的多个变量降为成少数相互独立且具有代表性的综合指标的方法[17]。目前,BBD法多用于优化中药单味药、复方等提取工艺,PCA法多用于中药材质量分析及评价。本实验首先采用BBD[18]对当归-苦参药对的回流提取进行工艺优化,通过双波长HPLC法[19]对当归-苦参药对不同配伍中绿原酸、阿魏酸、洋川芎内酯I、藁本内酯、欧当归内酯A、槐果碱、苦参碱、氧化槐果碱、槐定碱、氧化苦参碱、苦参酮11个成分进行含量测定,再通过PCA法将生化指标CK、CK-MB、IL-1β、IL-6、LDH等指标与药对化学成分含量整合,综合各指标评价不同配伍之间的差异,得出当归-苦参药对的最佳配伍比例,为当归-苦参药对的配伍特点和临床应用规律、解析以其为基础的复方构成及新的复方开发中提供一定的理论依据。
1 仪器与材料
1.1 仪器
Agilent 1260高效液相色谱仪,美国安捷伦公司;N-110型旋转蒸发仪,上海爱朗仪器有限公司;98-1-B型电热套,天津市泰斯特仪器有限公司;AB204-N型分析天平,德国Mettler-Toledo公司;Epoch 2型酶标仪,美国伯腾仪器有限公司。
1.2 材料
当归饮片、苦参饮片,购买于黑龙江中医药大学附属第一医院,经黑龙江中医药大学中药资源与开发教研室主任王振月教授鉴定,当归为伞形科当归属植物当归Angelica sinensis(Oliv.) Diels的干燥根,苦参为豆科槐属植物苦参Sophora flavescensAit.的干燥根。对照品绿原酸、阿魏酸、藁本内酯、欧当归内酯A,中国食品药品检定研究院,批号110753-200413、110773-201012、111737-201910、11826-201001;对照品洋川芎内酯I,德思特生物技术有限公司,批号94596-28-8;对照品槐果碱、苦参碱、氧化槐果碱、槐定碱、氧化苦参碱、苦参酮,成都埃法生物科技有限公司,批号145572-44-7、110805-200508、26904-64-3、6882-68-4、16837-52-8、34981-26-5,质量分数>98%。乙腈、甲醇为色谱纯,购自北京迈瑞达科技有限公司;实验用水为娃哈哈纯净水,其他试剂均为分析纯。水合氯醛,购于黑龙江省久丰生物工程有限公司;CK、CKMB、IL-1β、IL-6、LDH试剂盒,购于天津阿尔法生物科技有限公司。
1.3 动物
SD大鼠购于黑龙江中医药大学药物安全评价中心,实验动物合格证号SCXK2008-0001;所有大鼠单独关在笼中,在温度为(25±2)℃、相对湿度为30%~40%的受控标准实验室环境下和12 h的明暗循环,标准饮食,自由进水。所有大鼠均为常规饲养1周。所有动物实验遵循黑龙江中医药大学伦理委员会有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 当归-苦参药对含量测定方法建立
2.1.1 混合对照品溶液的制备 精密称取各对照品适量,加甲醇溶解,摇匀,分别定容制成分别含绿原酸40.20 μg/mL、阿魏酸71.60 μg/mL、洋川芎内酯I 32.60 μg/mL、藁本内酯122.40 μg/mL、欧当归内酯43.20 μg/mL的混合对照品溶液I和分别含槐果碱74.80 μg/mL、苦参碱92.60 μg/mL、氧化槐果碱268.00 μg/mL、槐定碱62.40 μg/mL、氧化苦参碱品324.00 μg/mL、苦参酮346.00 μg/mL的混合对照品溶液II,即得。
2.1.2 供试品溶液的制备 称取当归、苦参和当归-苦参1∶1,总量各为2 g,将药材分别用10倍量70%乙醇回流提取1 h,浓缩,置于10 mL量瓶中,加甲醇定容至刻度,溶液用0.22 μm滤膜滤过,取续滤液,即得供试品溶液。
2.1.3 色谱条件 色谱柱为XBridge柱(150 mm×4.6 mm,5 μm);检测当归指标流动相为乙腈-0.03%磷酸水溶液,梯度洗脱:0~20 min,5%~40%乙腈;20~40 min,40%~100%乙腈;检测波长280 nm;检测苦参指标流动相为乙腈-0.03%氨水溶液,梯度洗脱:0~20 min,5%~40%乙腈;20~40 min,40%~100%乙腈;检测波长220 nm[20-21];体积流量1.0 mL/min;柱温30 ℃;进样量为10 μL。
2.1.4 专属性实验 精密吸取对照品溶液与供试品溶液,分别按照“2.1.3”项下色谱条件进样10 μL测定。分别在当归中检测绿原酸、阿魏酸、洋川芎内酯I、藁本内酯、欧当归内酯A,在苦参中检测氧化苦参碱、氧化槐果碱、槐定碱、苦参酮、槐果碱和苦参碱。色谱图见图1、2。
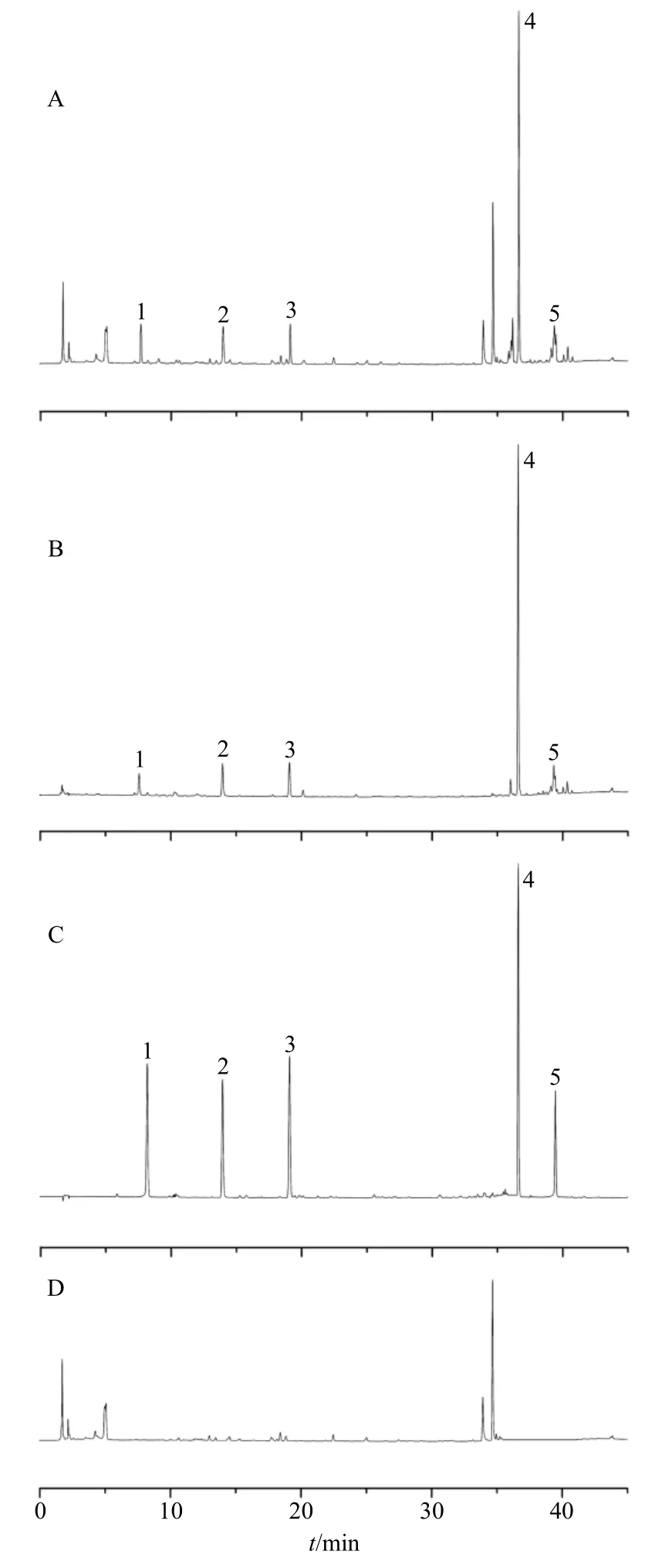
图1 当归-苦参 (1∶1) 样品 (A)、当归样品 (B)、混合对照品I (C)、苦参样品 (D) 的HPLC图 (280 nm)Fig.1 HPLC of ASR-SFR (1:1) sample (A), ASR sample(B), mixed reference substances Ⅰ (C), and SFR sample (D)(280 nm)

图2 当归-苦参 (1∶1) 样品 (A)、苦参样品 (B)、混合对照品II (C)、当归样品 (D) 的HPLC图 (220 nm)Fig.2 HPLC of ASR-SFR (1:1) sample (A), SFR sample(B), mixed reference substances II (C), and ASR sample (D)(220 nm)
2.1.5 线性关系考察 分别精密吸取上述对照品储备液120、100、80、60、40、20 μL至2 mL量瓶中,加甲醇定容至刻度,得到不同质量浓度水平的对照品溶液。按“2.1.3”项下色谱条件分别进样测定,测得峰面积积分值,以峰面积积分值(Y)与对照品质量浓度(X)绘制标准曲线,得回归方程。将混合对照品溶液逐级稀释,以信噪比为10∶1确定定量限,以信噪比为3∶1确定检测限。结果见表1。
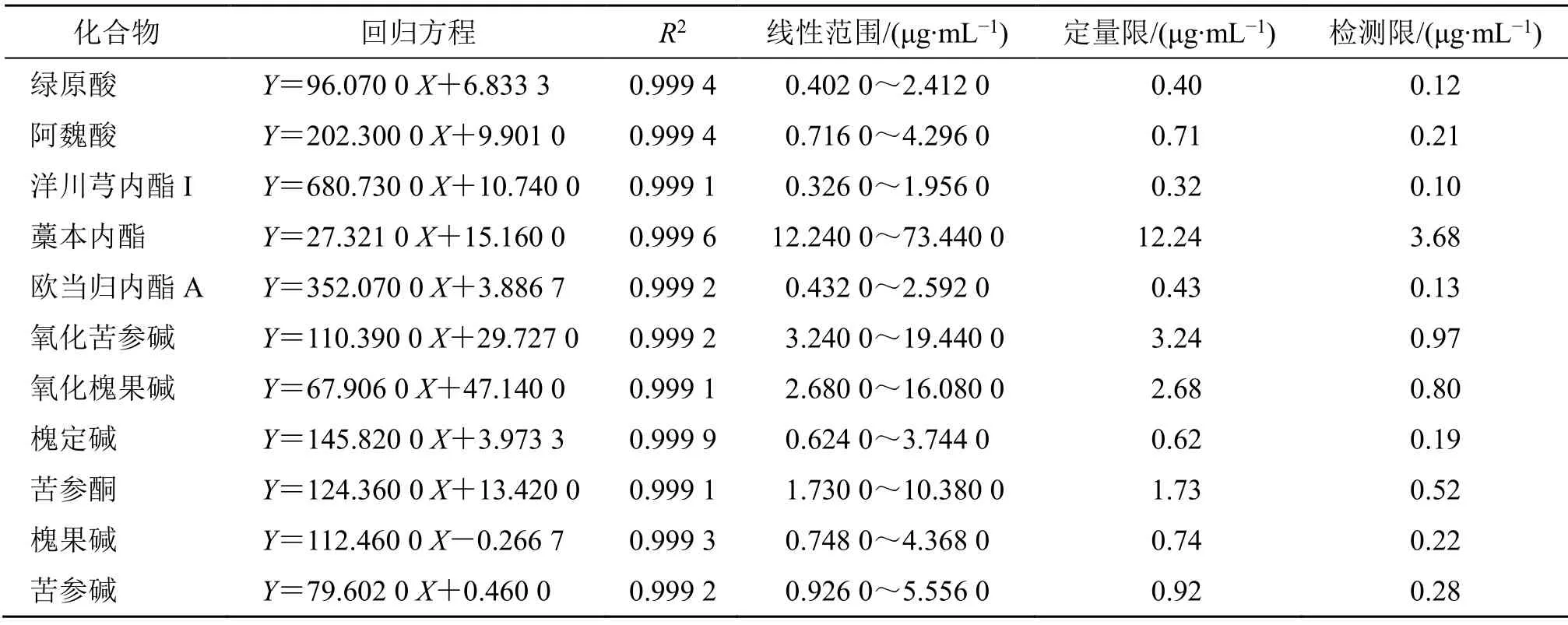
表1 线性关系考察结果Table 1 Linear relation investigation
2.1.6 精密度试验 取混合对照品溶液I、II,按照“2.1.3”项下色谱条件进样,连续测定6次,测得绿原酸、阿魏酸、洋川芎内酯I、藁本内酯、欧当归内酯A、氧化苦参碱、氧化槐果碱、槐定碱、苦参酮、槐果碱和苦参碱峰面积的RSD分别为0.13%、0.22%、0.22%、1.10%、0.35%、0.13%、0.57%、0.20%、0.86%、0.17%、0.24%,均小于2%,表明仪器精密度良好。
2.1.7 稳定性试验 取当归-苦参1∶1供试品溶液,分别于0、3、6、9、12、24 h按“2.1.3”项下色谱条件进样分析,测得绿原酸、阿魏酸、洋川芎内酯I、藁本内酯、欧当归内酯A、氧化苦参碱、氧化槐果碱、槐定碱、苦参酮、槐果碱和苦参碱峰面积的RSD分别为1.6%、1.8%、1.2%、1.3%、1.2%、1.0%、1.4%、1.4%、0.65%、1.2%、1.7%,均小于2%,表明供试品溶液在24 h内稳定性良好。
2.1.8 重复性试验 称取当归-苦参1∶1样品适量,按“2.1.2”项下方法平行制备成供试品溶液,共6份,并在“2.1.3”项色谱条件下进样测定。绿原酸、阿魏酸、洋川芎内酯I、藁本内酯、欧当归内酯A、氧化苦参碱、氧化槐果碱、槐定碱、苦参酮、槐果碱和苦参碱质量分数的RSD值分别为1.2%、1.2%、1.3%、1.2%、1.2%、1.7%、1.6%、1.5%、1.6%、1.8%、1.9%,均小于2%,说明该方法重复性良好。
2.1.9 加样回收率试验 取当归-苦参1∶1样品 6份,每份0.2 g,分别精密加入对照品溶液适量,按“2.1.2”项下方法平行制备成供试品溶液,并在“2.1.3”项色谱条件下进样测定,计算各成分的平均回收率及其RSD值。通过加入等量相同的单一成分测得化学成分含量,绿原酸、阿魏酸、洋川芎内酯I、藁本内酯、欧当归内酯A、氧化苦参碱、氧化槐果碱、槐定碱、苦参酮、槐果碱和苦参碱的平均回收率分别为98.41%、99.25%、99.25%、98.75%、98.59%、96.18%、98.01%、97.82%、97.52%、97.97%、97.38%,RSD值分别为为1.2%、1.4%、0.8%、0.96%、0.46%、0.76%、1.46%、0.81%、0.64%、1.2%、1.4%。测得值与理论值基本一致,都符合要求。
2.2 当归-苦参药对的提取工艺优化
2.2.1 BBD实验设计与结果 根据前期预实验结果分析,运用Box-Behnken试验设计原理,选取乙醇体积分数(A)、提取次数(B)、料液比(C)3种主要因素为变量,以当归-苦参药对指标成分总量提取率(Y)为响应值设计响应面分析,进行回流提取工艺优化试验。由于提取次数为非连续变量,将提取次数按照总提取时间计算,从而转化为连续变量,即提取1次为总提取时间1 h,提取2次为总提取时间2 h,提取3次为总提取时间3 h[22],实验设计与结果见表2。

表2 响应面设计与结果Table 2 Design and results of response surface
2.2.2 响应面模型建立与方差分析 通过Design Expert 12.0软件综合评分进行线性回归分析,得出拟合方程Y=22.31+0.19 A-1.71 B-0.35 C-0.96 AB-4.37 AC-0.26 BC-10.45 A2-1.78 B2-4.63 C2。该模型的方差分析和结果(表3)显示,R2=0.965 4,说明模型拟合结果比较理想,F值为12.88,P<0.000 1,说明模型具有显著性差异。其中料液比和提取次数、料液比和乙醇体积分数因素交互影响显著,而提取次数跟乙醇体积分数交互影响不显著。拟合的二次响应面图见图3。根据预测模型得出最佳工艺为料液比1∶30,乙醇体积分数为70%,提取次数为3次,每次1 h,总提取率23.24%。为验证该模型的准确性,在该条件下重复3次试验,得出总提取率为24.75%,RSD为0.24%,与该模型预测值接近,说明该条件稳定可行,具有重复性。

图3 响应面图和等高线图Fig.3 Response surface and contour map
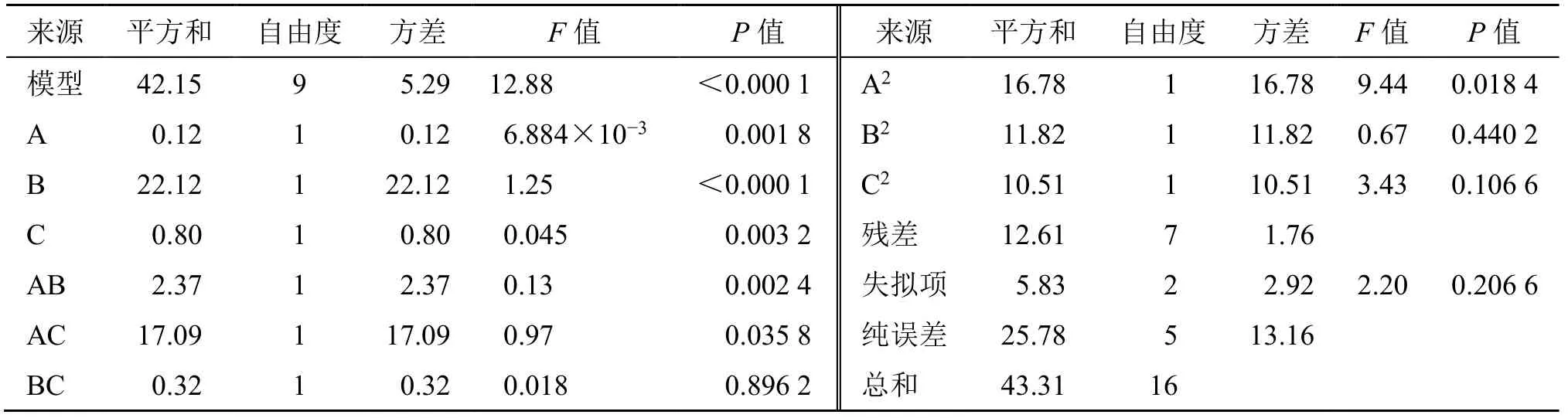
表3 响应面回归模型方差分析Table 3 Regression model and variance analysis of response surface
2.2.3 样品含量测定 选取响应面法中的最佳提取工艺来制备当归-苦参不同配伍(1∶0、1∶1、1∶2、1∶3、2∶1、3∶1、0∶1),精密吸取上述供试品溶液,按照“2.1.3”项下色谱条件进样,平行测定3次,测得生药中各指标成分的含量。结果见表4。

表4 不同配伍比例中当归、苦参指标性成分的HPLC含量测定 (n = 3)Table 4 Determination of index components of ASR and SFR in different ratios by HPLC (n = 3)
2.3 当归-苦参不同配伍改善心肌缺血的研究
SD大鼠ip 10%水合氯醛(3.0 mL/kg)麻醉,背位固定,稳定15 min。将针形电极插入四肢皮下,连接多道生理记录仪,描记肢体II导联心电图并以此为造模前心电图,供造模后心电变化分析作参照。S D大鼠胸部去毛、消毒,沿左腋窝至第五肋骨与胸骨连接处切开皮肤约2 cm,顺胸浅肌纹钝性分离肌肉层。在第3、4肋间打开胸腔,撕开心包膜,距左心耳下缘2 mm处用6~0号眼科缝合线以0.3~0.5 mm深度结扎大鼠左前降支,复位心脏,迅速缝合胸腔[23]。记录缺血后肢体II导联心电图,对比造模前心电图,造模后大鼠心电图ST段明显上抬,为心肌缺血模型成功标志[24],如图4。
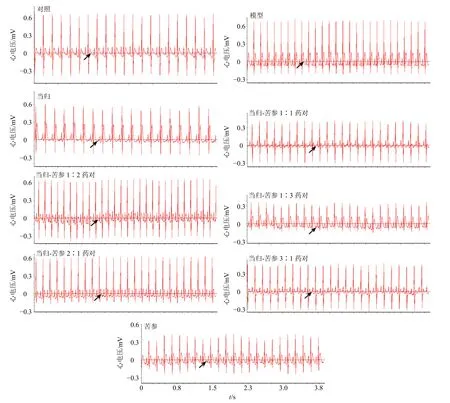
图4 当归-苦参不同配伍比例样品的心电图Fig.4 Electrocardiogram of samples of ASR-SFR with different compatibility ratios
将造完模的大鼠随机分成对照组、模型组、当归组、当归-苦参药对不同配伍组(1∶1、1∶2、1∶3、2∶1、3∶1)、苦参组。按照配伍比例,分别准确称定当归、苦参药材,加入30倍量70%乙醇,回流提取3次,每次1 h,滤过,合并滤液,浓缩至提取液无乙醇为止,置于4 ℃冰箱,备用。准确按照大鼠给药体积吸取药液并ig,各药对配比组给予2.7 g/(kg·d)(生药量),对照组和模型组给予同体积去离子水。于造模第4天,连续ig给药7 d。末次药后1 h,用5 mL含肝素钠的真空管腹主动脉采血,于4 ℃下3000 r/min离心(离心半径10 cm)20 min,取上清,分装于0.5 mL Eppendorf管中,−80 ℃冰箱保存,按照试剂盒操作说明对CK-MB、CK、LDH等血清酶学和IL-1β、IL-6等细胞因子的水平进行检测,结果见表5。与对照组比较,血清中CK、CKM、LDH、IL-1β、IL-6水平显著升高(P<0.01),不同配比药对治疗后,血清中CK、CK-M、LDH、IL-1β、IL-6水平显著降低(P<0.01),结果表明当归-苦参药对可以改善心肌受损的情况。
2.4 PCA法综合评价当归-苦参药对不同配伍对心肌缺血大鼠的影响
将当归-苦参药对化学成分含量测定结果(表4)和ELISA试剂盒测定结果(表5)用Excel 2020软件进行数据统计分析,采用SPSS 26.0软件进行PCA。
表5 血清生化指标的测定 ( , n = 8)Table 5 Determination of serum biochemical indexes ( , n = 8)

表5 血清生化指标的测定 ( , n = 8)Table 5 Determination of serum biochemical indexes ( , n = 8)
与对照组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01**P < 0.01 vs control group; #P < 0.05 ##P < 0.01 vs model group
组别 剂量/(g·kg−1)质量浓度/(ng·L−1)CK CK-MB LDH IL-1β IL-6对照 − 936.86±63.86 1.00±0.11 11.42±0.18 22.01±0.95 1.85±0.08模型 − 2 210.12±122.76** 5.93±0.22** 24.15±0.85** 74.09±3.04** 3.23±0.13**当归 2.5 1 423.09±132.60## 4.74±0.65## 16.68±0.44## 32.51±1.27## 2.31±0.11##当归-苦参1∶1药对 2.5 1 198.52±55.74## 2.77±0.15## 13.81±0.42## 32.87±1.26## 2.01±0.07##当归-苦参1∶2药对 2.5 1 489.55±69.29## 3.65±0.49## 13.83±0.66## 36.45±1.50## 2.37±0.10##当归-苦参1∶3药对 2.5 1 477.07±67.27## 2.36±0.24## 14.51±0.91## 30.95±2.00## 2.10±0.09##当归-苦参2∶1药对 2.5 1 468.73±36.62## 3.07±0.29## 15.31±0.79## 43.25±2.01## 2.62±0.10##当归-苦参3∶1药对 2.5 1 960.01±107.57## 3.94±0.21## 17.34±0.84## 41.94±2.09## 2.21±0.09##苦参 2.5 1 410.56±93.76## 4.38±0.48## 12.96±0.48## 33.82±1.95## 2.00±0.08##
2.4.1 PCA 为详细地阐释当归、苦参单味药和不同配伍(1∶1、1∶2、1∶3、2∶1、3∶1)药对治疗心肌缺血大鼠的差异,以药对化学成分含量绿原酸、阿魏酸、洋川芎内酯I、藁本内酯、欧当归内酯A、化苦参碱、氧化槐果碱、槐定碱、苦参酮、槐果碱、苦参碱和生化指标CK、CK-MB、LDH、IL-1β、IL-6为分析数据源,应用SPSS 26.0对数据进行标准化和PCA,见图5。11个化学成分和5个生化指标变化的PCA结果见表6,以特征值大于1为提取标准,得到第1主成分的特征值和方差贡献率分别为8.473%和52.957%,第2主成分的特征值和方差贡献率分别为3.967%和24.796%,第3主成分的特征值和方差贡献率分别为2.242%和14.010%,前3个成分的累积方差贡献率已达到91.763%>85%,因此,选取前3个主成分作为当归苦参药对化学成分含量和生化指标各指标数据分析的有效成分,它代表了原有16个指标变量的91.763%信息量,具有很好的代表性。

表6 当归-苦参化学成分和生化指标的特征值和贡献率Table 6 Characteristic value and contribution rate of chemical constituents and biochemical indexes of ASR and SFR

图5 PCA载荷图Fig.5 Loading plot of PCA
2.4.2 综合评价模型构建 由表7可知,可以用3个变量Z1、Z2、Z3代替原来的16个指标对不同配比当归-苦参药对进行药效综合评价[25-27],则得出线性组合(其中Y1~Y16均为标准化的变量)分别为Z1=0.267Y1+0.276Y2+0.272Y3+0.256Y4+0.268Y5+0.295Y6+0.292Y7+0.306Y8+0.292Y9+0.313Y10+0.314Y11-0.082Y12-0.127Y13-0.172Y14-0.147Y15-0.136Y16;Z2=0.138Y1+0.126Y2+0.071Y3+0.093Y4+0.119Y5+0.076Y6+0.100Y7+0.079Y8+0.070Y9+0.063Y10+0.057Y11+0.455Y12+0.388Y13+0.421Y14+0.432Y15+0.423Y16;Z3=−0.298Y1-0.275Y2-0.352Y3-0.388Y4-0.353Y5+0.307Y6+0.256Y7+0.189Y8+0.331Y9+0.208Y10+0.234Y11+0.120Y12+0.059Y13-0.059Y14+0.093Y15-0.063Y16。
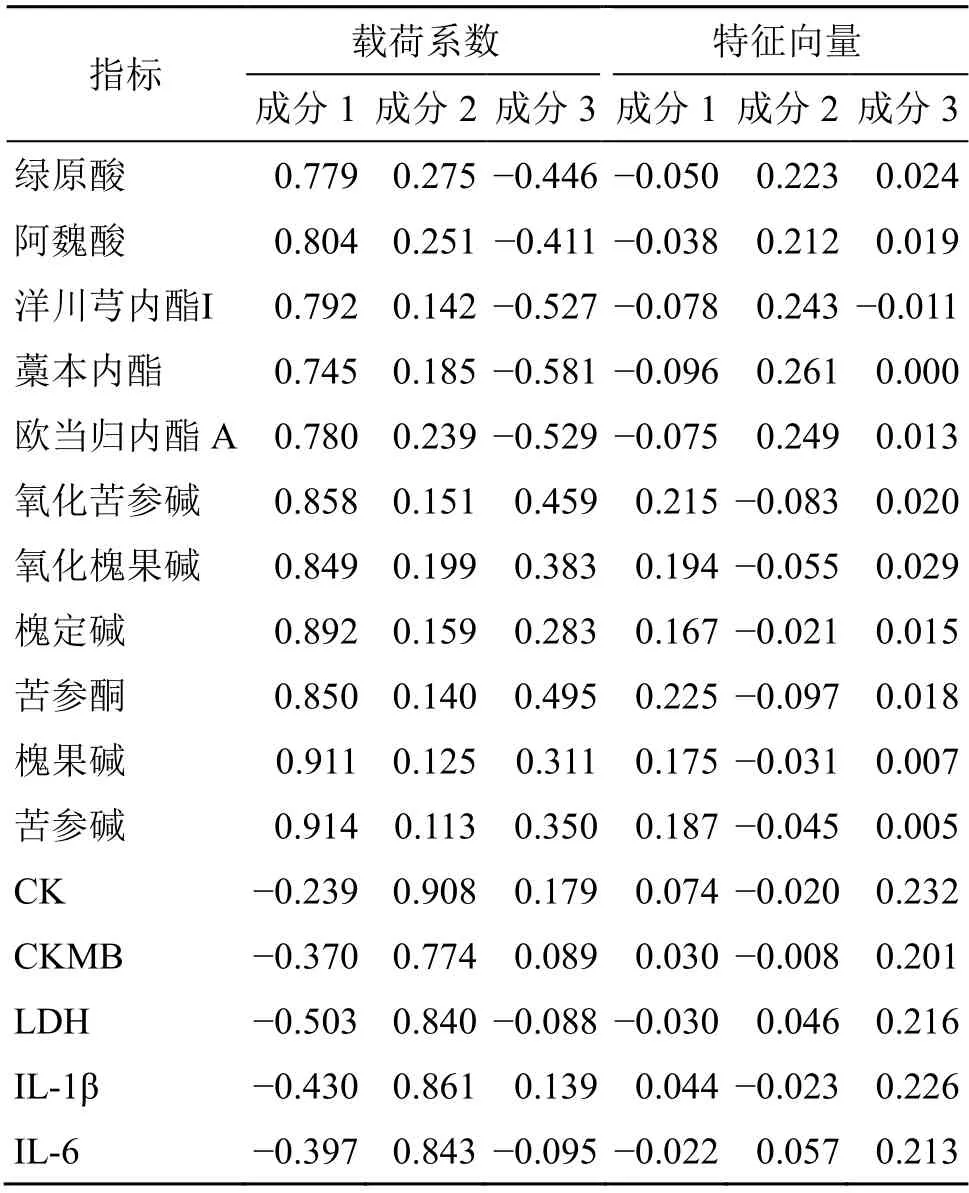
表7 主成分的载荷系数和特征向量Table 7 Load coefficients and eigenvectors of principal components
取第1~3主成分的方差贡献率α1(52.957%)、α2(24.796%)、α3(14.010%)作为权数,Z1、Z2、Z3为特征向量因子,构建综合评价模型:F=α1Z1+α2Z2+α3Z3,即F=0.529 57Z1+0.247 96Z2+0.140 10Z3,式中F值为综合评价指标,应用该模型结合标准化后的数据计算出当归苦参单味药及其不同配伍治疗心肌缺血大鼠的综合评价F。总得分高低反映了当归-苦参药对不同配比中化学成分及生化指标综合影响大小。
从表8中可以看出,随着当归-苦参配比的不同变化,综合指标F值先增大后又逐渐降低,说明随着当归-苦参配比的变化,心肌缺血大鼠有不同程度的改善,其中当归-苦参配比为1∶2时F值达到最高水平,说明当归-苦参配比为1∶2对于治疗心肌缺血大鼠的疗效较好。

表8 当归、苦参单味药及其不同配伍治疗心肌缺血大鼠的综合评价 (F)Table 8 Comprehensive evaluation of single drug and its different compatibilities of ASR and SFR in treatment of myocardial ischemia in rats (F)
3 讨论
本实验通过Box-Behnken法优选当归-苦参药对的提取工艺,其法简单可靠,首次对当归-苦参药对的提取工艺进行优化,确定最佳提取条件为料液比1∶30,乙醇体积分数为70%,提取次数为3次,每次1 h。在最佳提取条件下,通过双波长HPLC法测定当归-苦参药对不同配比中11个化学成分含量,并分析了不同配比下含量的变化。与当归-苦参0∶1比较,当归-苦参不同配比的(1∶1、2∶1、3∶1)样品中随着当归比例的升高,苦参中6种成分提取量呈“U”型分布;与当归-苦参1∶0比较,当归-苦参不同配比(1∶1、1∶2、1∶3)样品中随着苦参比例的升高,当归中5种成分提取量亦呈“U”型分布。且在当归-苦参1∶3时11个成分的含量最高。初步分析当归、苦参配比的升高,可能是通过改变整个溶剂系统的酸碱度和相关成分之间的协同作用,从而促使其不同配比化学成分的变化,具体机理有待进一步深入研究。由此可见,药对的相互配伍对其中的成分的确有一定影响。
本实验通过PCA法,将药对有效化学成分含量与血清生化16个单一指标进行整合,构建成3个独立的综合变量,计算得出当归-苦参各配比的综合指标值,经过加权进行综合评价,得出每一个配比的综合疗效排序。根据当归-苦参7个不同配比的综合得分值F大小的排序,得出当归-苦参配比为1∶2时对于心肌缺血大鼠疗效最好,1∶3次之,当归、苦参单位药的改善程度最不明显。
当归-苦参药对在古方中出现频次较高[28],但其配伍相关的有效成分及治疗心肌缺血的作用机制尚不明确。以上从化学层面和药效学角度多方面分析药对配伍机制,充分说明药对配伍过程中不仅仅是单味药之间简单的加和,而是更为复杂的发生某种小分子化学反应。本实验未考察中药材不同批次以及动物试验中未设阳性药组等问题,以上问题有待于继续深入研究。本实验首次对当归-苦参不同配比的配伍进行化学成分和药效学的研究,通过主成分分析法将单一的指标进行整合,筛选出对于治疗心肌缺血大鼠的最佳配比可能为1∶2,此方法合理可靠,为后续当归-苦参药对在临床的应用奠定了一定的科学依据,对将当归-苦参药对开发为治疗心血管的复方基础具有指导意义。
利益冲突所有作者均声明不存在利益冲突
