经典名方猪苓汤基准样品质量评价方法研究
2022-06-17王延涛孔令梅王春艳王中超马立平齐晓丹
王延涛,孔令梅, ,程 杰,张 淹, ,王春艳,王中超, ,张 燕, ,马立平, ,齐晓丹*,刘 艳
1.东阿阿胶股份有限公司 国家胶类中药工程技术研究中心,山东 聊城 252200
2.山东省胶类中药技术创新中心,山东 聊城 252200
3.山东省胶类中药研究与开发重点实验室,山东 聊城 252200
4.中国中医科学院 中药研究所,北京 100700
猪苓汤出自东汉张仲景所著《伤寒论》,是国家中医药管理局发布的《古代经典名方目录》的第9方[1],由猪苓、茯苓、泽泻、滑石、阿胶5味中药组成,以利水为主,兼以养阴清热,主治水热互结而兼阴虚之证[2]。方中以猪苓为君药,取其归肾、膀胱经,专以淡渗利水;臣药泽泻、茯苓性味甘淡,益猪苓利水渗湿之力,泽泻性寒兼可泄热,茯苓尚可健脾以助运湿;佐入滑石之甘寒,利水、清热两彰其功;阿胶滋阴润燥,既益已伤之阴,又防诸药渗利重伤阴血。五药合方,利水渗湿为主,清热养阴为辅,体现了利水而不伤阴、滋阴而不碍湿的配伍特点。在现代药理学研究及临床应用中,发现猪苓汤主要应用于改善肾功能、抗炎、利尿等[3-7]。除传统的功能主治外,猪苓汤还可以加减其他药味或方剂治疗肾炎、红斑狼疮性肾炎、心律失常、肝硬化等多种疾病[8-16]。可见该方应用价值广泛,具有重要开发意义。
对于经典名方的开发目前国家是推广和鼓励的,近年逐渐发布了一系列完善详尽的法规体系[17-19]。“经典名方基准样品”是经典名方开发的关键一环,是经典名方复方制剂生产的化学基准和生物效应基准[20],是衡量制剂与中医临床所使用的药用物质是否一致的标准,因此,基准样品的质量标准尤其重要。但是目前关于猪苓汤的报道主要集中于临床用药研究及药理研究方面,质量标准相关报道较少。为了在经典名方开发中有力支撑猪苓汤的工艺确定和标准制定,本研究特开展猪苓汤基准样品的质量研究,为其复方制剂及其他经典名方的开发应用提供参考。
1 仪器与材料
岛津LC-20A型高效液相色谱仪,LC-20AT串联双柱塞泵,DGU-20A在线脱气系统,SIL-20A自动进样器,CTO-20AC柱温箱,SPD-M20A二极管阵列检测器,日本岛津公司;KQ-250DB型数控超声波清洗器,昆山市超声仪器有限公司;BGZ-70鼓风式干燥箱,上海博讯实业有限公司医疗设备厂;XP105型十万分之一电子天平,瑞士梅特勒-托利多公司;Phenomenex Gemini C18(250 mm×4.6 mm,5 μm)色谱柱;ZF-1型三用紫外分析仪,骥辉分析仪器(北京)有限公司;DK-98-11A恒温水浴锅,天津市泰斯特仪器有限公司;硅胶G薄层板,青岛海洋化工厂分厂,批号20171029。
对照品L-羟脯氨酸(批号111578-201602)、甘氨酸(批号140689-201605)、丙氨酸(批号140680-201604)、脯氨酸(批号140677-201507)、23-乙酰泽泻醇B(批号111846-201705),质量分数依次为99.9%、100%、100%、99.9%、99.7%,购自中国食品药品检定研究院;对照品泽泻醇A(批号BCY-000924)、泽泻醇B(批号BCTG-0915),购自江西佰草源生物科技有限公司,质量分数均大于95%;茯苓对照药材(批号121117-201509)、泽泻对照药材(批号121081-201406)购于中国食品药品检定研究院;猪苓(批号180504004)购于北京仟草中药饮片有限公司。异硫氰酸苯酯(PITC)购自MACKLN公司;乙腈、磷酸,美国Fisher Chemical公司,色谱纯;水为娃哈哈纯净水,其他试剂为分析纯。
本研究中所用饮片经中国中医科学院中药研究所何希荣研究员鉴定,猪苓为多孔菌科树花属真菌猪苓Polyporus umbellatus(Pers.) Fries的菌核;茯苓为多孔菌科卧孔属真菌茯苓Poria cocos(Schw.)Wolf的干燥菌核;泽泻为泽泻科泽泻属植物东方泽泻Alisma orientale(Sam.) Juzep.的干燥块茎;阿胶为马科马属动物驴Equus asinusL.的干燥皮或鲜皮经煎煮、浓缩制成的固体胶;滑石为硅酸盐类矿物滑石族滑石,主含含水硅酸镁[Mg3(Si4O10)(OH)2]。
15批次猪苓汤基准样品所用饮片批号及产地信息见表1,所有饮片均有相关质量标准检测报告,检查结果均符合《中国药典》2020年版要求。

表1 15批猪苓汤饮片信息Table 1 Information of 15 batches of Zhuling Decoction
2 方法与结果
2.1 猪苓汤煎煮方法及样品制备
猪苓汤基准样品对应实物制备过程中,采用Excel软件中的RAND程序,对每个药味的15批饮片进行随机排列,形成不同批次饮片的组合(S1~S15)。
采用陶瓷煎药壶加盖煎煮,武火(功率2200 W)煮沸,文火(功率500 W)保持微沸。取猪苓、茯苓、泽泻、滑石各13.80 g,置2 L煎药壶中,加水800 mL,加盖煮沸(加热约5 min),保持微沸45 min,滤过,得滤液;趁热加入阿胶烊化,得猪苓汤汤剂;60 ℃减压浓缩30 min,浓缩液冷冻干燥24 h,得猪苓汤基准样品。
按照同样方法制备各单味药样品及缺阿胶、泽泻、茯苓、猪苓的阴性样品。
2.2 特征图谱方法建立
2.2.1 供试品溶液的制备 按照“2.1”项下方法制备猪苓汤基准样品、单味药样品和各阴性样品。精密称定各样品冻干粉1.0 g,置具塞锥形瓶中,精密加丙酮50 mL,密塞,超声处理(功率800 W、频率40 kHz)30 min,放冷,滤过,滤液蒸干,残渣加80%乙腈溶解,定容至5 mL,滤过,即得供试品溶液。
2.2.2 对照品溶液的制备 精密称定泽泻醇A、泽泻醇B、23-乙酰泽泻醇B,加乙腈溶解,制成质量浓度为泽泻醇A 40 μg/mL、泽泻醇B 25 μg/mL、23-乙酰泽泻醇B 23 μg/mL的混合对照品溶液。
2.2.3 色谱条件 Phenomenex Gemini C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-0.2%磷酸水溶液,梯度洗脱:0~15 min,55%~70%乙腈;15~30 min,70%~85%乙腈;30~35 min,85%~95%乙腈;35~45 min,95%乙腈;检测波长208 nm;柱温30 ℃;体积流量1.0 mL/min;进样量10 μL。
2.2.4 精密度考察 取同一份猪苓汤基准样品供试品溶液(批号20181112),按照“2.2.3”项下方法重复进样6次,计算各共有峰的相对保留时间和相对峰面积,结果如表2所示,RSD≤5.0%,表明仪器精密度良好。

表2 特征图谱方法学考察 (n = 6)Table 2 Methodological investigation of characteristic atlas(n = 6)
2.2.5 重复性考察 平行制备6份猪苓汤基准样品的供试品溶液(批号20181112),按照“2.2.3”项下方法进样测定,计算各共有峰的相对保留时间和相对峰面积,结果如表2所示,RSD≤5.0%,该方法重复性合格。
2.2.6 稳定性考察 取同一份猪苓汤基准样品的供试品溶液(批号20181112),分别于制备后0、2、4、8、10、15、20、24 h,按“2.2.3”项下方法进样测定,计算各共有峰的相对保留时间和相对峰面积,结果如表2所示,RSD≤5.0%,结果表明供试品溶液在24 h内稳定,符合要求。
2.2.7 特征图谱的建立与相似度分析 取15批猪苓汤基准样品的供试品溶液,按“2.2.3”项下方法测定,记录50 min色谱图。用中药色谱指纹图谱相似度评价系统(2012版)进行评价,对15批基准样品进行色谱图叠加得图1-A,并生成对照特征图谱,见图1-B。将特征图谱进行特征峰归属,对应图谱见图2、3,全方共确定8个共有峰,经对照品、猪苓汤样品、单味药样品、各单味药阴性样品相关图谱色谱峰比对,峰1~3号峰来自于泽泻,分别为泽泻醇A、泽泻醇B、23-乙酰泽泻醇B;4~8号峰来自于阿胶,通过与相关文献资料对比,均为阿胶中的脂溶性成分[21]。

图1 15批猪苓汤基准样品的HPLC指纹图谱 (A) 和特征图谱 (B)Fig.1 HPLC fingerprint of 15 batches of material benchmarks of Zhuling Decoction (A) and its characteristic chromatogram (B)

图2 猪苓汤基准样品与单味药对照图谱Fig.2 Reference spectrum of substance benchmark of Zhuling Decoction and sing-flavor drugs

图3 猪苓汤基准样品与各单味药阴性样品对照图谱Fig.3 Reference spectrum of substance benchmark of Zhuling Decoction and negative samples of each single-flavor drugs
以2号峰为参照峰,计算其他峰的相对保留时间和相对峰面积;计算相似度,计算参数:以S1为参照图谱,采用中位数法,时间窗宽度0.1,15批猪苓汤基准样品对应实物(S1~S15)特征图谱与其对照图谱的相似度分别为0.989、0.985、0.985、0.971、0.986、0.970、0.997、0.998、0.968、0.988、0.995、0.990、0.995、0.995、0.990,均大于0.95,表明猪苓汤基准样品的制备工艺稳定,不同批次间的差异较小。
2.3 基准样品含量测定方法建立
本研究以L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸为指标成分,建立了猪苓汤基准样品的含量测定方法。
2.3.1 对照品溶液的制备 精密称定L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸适量,加0.1 mol/L盐酸溶液制成质量浓度为L-羟脯氨酸80 μg/mL、甘氨酸160 μg/mL、丙氨酸70 μg/mL、脯氨酸120 μg/mL的混合对照品溶液。
2.3.2 供试品溶液的制备 精密称取猪苓汤基准样品0.2 g,置25 mL量瓶中,加0.1 mol/L盐酸溶液20 mL,超声处理(功率500 W、频率40 kHz)30 min,放冷后加0.1 mol/L盐酸溶液至刻度,摇匀。精密量取2 mL,置5 mL安瓿中,加盐酸2 mL,150 ℃水解1 h,放冷,转移至蒸发皿中,蒸干,残渣加0.1 mol/L盐酸溶液溶解,转移至25 mL量瓶中,加0.1 mol/L盐酸溶液至刻度,摇匀,即得供试品溶液。
2.3.3 衍生化 分别精密吸取上述混合对照品溶液和供试品溶液各1 mL,置20 mL具塞试管中,精密加入0.1 mol/L PITC的乙腈溶液0.5 mL,1 mol/L三乙胺乙腈溶液0.5 mL,摇匀,室温放置1 h,精密加入50%乙腈3 mL,摇匀。精密加入正已烷3 mL,振摇,静置10 min,取下层溶液,滤过,取续滤液,即得。
2.3.4 色谱条件 色谱柱为Phenomenex Gemini C18柱(250 mm×4.6 mm,5 µm);以乙腈-0.1 mol/L醋酸钠水溶液(用醋酸调节pH值至6.5)(7∶93)为流动相A,乙腈-水(4∶1)为流动相B,梯度洗脱:0~11.0 min,0~7% B;11.0~13.9 min,7%~12%B;13.9~14.0 min,12%~15% B;14.0~29.0 min,15%~34% B;29.0~30.0 min,34%~100% B;体积流量0.8 mL/min;检测波长254 nm;柱温为43 ℃;理论塔板数按L-羟脯氨酸峰计算应不低于4000,所得HPLC色谱图如图4所示。
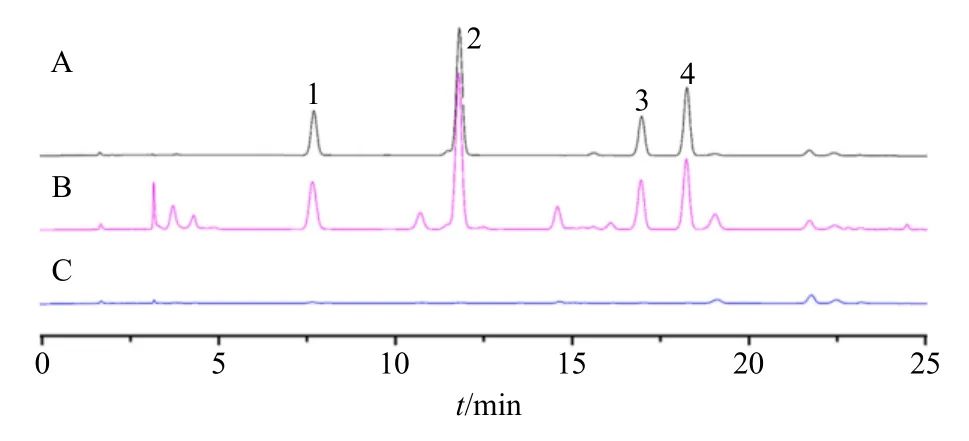
图4 混合对照品 (A)、猪苓汤样品 (B) 和缺阿胶阴性样品(C) 的HPLC图Fig.4 HPLC of reference substances (A), Zhuling Decoction sample (B) and negative sample without Ejiao (C)
2.3.5 线性关系考察 精密称取L-羟脯氨酸10.52 mg、甘氨酸18.57 mg、丙氨酸13.84 mg、脯氨酸9.14 mg,分别置于10 mL量瓶中,加0.1 mol/L盐酸溶液至刻度,摇匀,精密量取液L-羟脯氨酸1.6 mL、甘氨酸1.8 mL、丙氨酸1.0 mL、脯氨酸2.6 mL置于同一10 mL量瓶中,加0.1 mol/L盐酸溶液至刻度,摇匀,即得L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸质量浓度分别为168.32、334.26、138.40、237.64µg/mL的混合对照品溶液。
精密吸取混合对照品溶液,分别稀释2、4、8、16、32倍,取混合对照品溶液及稀释后混合对照品溶液各1 mL,按“2.3.3”项方法衍生化后按“2.3.4”项下色谱条件测定,测得峰面积。分别以L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸的进样量为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得线性回归方程分别为L-羟脯氨酸Y=1 491 243.32X+15 954.32,r=0.999 9,线性范围26.30~841.60 ng;甘氨酸Y=2 287 191.79X-28 656.61,r=0.999 9,线性范围52.23~1 671.30 ng;丙氨酸Y=1 772 915.93X-11 323.89,r=0.999 9,线性范围21.62~692.00 ng;脯氨酸Y=1 669 948.55X+10 809.09,r=0.999 9,线性范围37.13~1 188.20 ng。结果表明,4种氨基酸在各自线性范围内线性关系良好。
2.3.6 精密度考察 精密量取“2.3.5”项中未稀释的混合对照品溶液,按“2.3.4”项下色谱条件连续进样6次,计算4种氨基酸峰面积的RSD,结果L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸峰面积的RSD分别为0.15%、0.12%、0.10%、0.15%,表明仪器精密度良好。
2.3.7 稳定性考察 精密量取同一猪苓汤基准样品供试品溶液(批号20181112),分别于制备后0、2、6、10、15、20、24 h按“2.3.4”项下色谱条件进样测定,计算供试品溶液中L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸的峰面积的RSD,结果L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸峰面积的RSD分别为0.18%、0.13%、1.03%、0.13%,表明供试品溶液24 h内稳定性良好。
2.3.8 重复性考察 精密称取猪苓汤基准样品(批号20181112),平行制备6份猪苓汤基准样品供试品溶液,按“2.3.4”项下色谱条件进样,计算4种氨基酸质量分数的RSD,结果L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸质量分数的RSD分别为1.22%、1.06%、0.99%、1.39%,表明该方法重复性良好。
2.3.9 加样回收率考察 精密称取已知L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸含量的猪苓汤基准样品(批号20181112)0.1 g,共6份,分别置25 mL量瓶中,按照比例加入对照品溶液(对照品溶液质量浓度:L-羟脯氨酸2.772 4 mg/mL、甘氨酸4.988 8 mg/mL、丙氨酸1.966 8 mg/mL、脯氨酸2.896 0 mg/mL)各3.0 mL,超声10 min,放冷,加0.1 mol/L盐酸至刻度,摇匀。精密量取2 mL,按照“2.3.2”“2.3.3”项方法制备供试品溶液,按“2.3.4”项下色谱条件测定,计算各氨基酸的回收率。结果显示,L-羟脯氨酸、甘氨酸、脯氨酸、丙氨酸的平均加样回收率分别为97.7%、97.3%、98.7%、98.0%,RSD分别为2.58%、1.55%、1.42%、1.80%;4种氨基酸加样回收率均符合95%~102%的要求,该方法准确度良好。
2.3.10 有效成分转移率 按照公式计算有效成分转移率,结果如表3所示,L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸平均转移率分别为90.89%、90.25%、90.29%、91.28%,均未出现离散数据(均值的70%~130%)。根据15批基准样品检测结果,确定猪苓汤中L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸的转移率分别为63.62%~118.20%、63.18%~117.30%、63.20%~117.40%、63.90%~118.70%。
转移率=wm/WM
w为基准样品中有效成分的质量分数,m为基准样品样品量,W为饮片中有效成分的质量分数,M为饮片投料量
2.3.11 水分 取15批猪苓汤基准样品的供试品,按照2020年版《中国药典》四部,通则0832第二法则测定水分,结果如表3所示,15批基准样品的水分为2.64%~4.84%。

表3 猪苓汤饮片基准样品的转移率及干膏率Table 3 Transfer rate and paste rate of benchmark samples of Zhuling Decoction
2.3.12 干膏率 按照公式(2)计算干膏率,结果如表3所示,15批基准样品平均干膏率为21.53%,均未出现离散数据(均值90%~110%)。根据15批基准样品检测结果,确定猪苓汤干膏率为19.37%~23.68%。
干膏率=m×(1-水分)/M
m为基准样品的质量,M为饮片投料量
2.4 薄层色谱法研究
猪苓、茯苓两药味因存在共同成分,单独鉴别时各自阴性均有影响,因此采用共同鉴别。泽泻鉴别结果显示阴性无干扰,故泽泻单独鉴别。分别处理按照“2.1”项下方法制备的猪苓汤基准样品及各药味阴性样品,进行薄层鉴别研究。
2.4.1 猪苓、茯苓鉴别 称取2.0 g样品,加乙醚50 mL,超声处理10 min(功率800 W、频率40 kHz),滤过,滤液蒸干,残渣加甲醇1 mL溶解,作为供试品溶液。另取茯苓对照药材、猪苓对照药材1 g,同法制成对照药材溶液。分别吸取对照药材溶液5 μL,供试品溶液30 μL,点于同一硅胶G薄层板上,以环己烷-醋酸乙酯-甲酸(8∶1∶0.1)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇,置365 nm下检视。供试品溶液在与对照药材溶液相同位置显相同颜色斑点。分别处理猪苓药材、茯苓对照药材、猪苓汤基准样品及缺猪苓、茯苓的猪苓汤样品。结果显示,猪苓汤基准样品中在与药材溶液相同位置显相同颜色斑点,缺猪苓、茯苓的猪苓汤样品无干扰,见图5。
2.4.2 泽泻鉴别 称取2.0 g样品,加甲醇50 mL,超声处理30 min(功率800 W、频率40 kHz),滤过,滤液蒸干,残渣加甲醇1 mL溶解,作为供试品溶液。另取泽泻对照药材1 g,同法制成对照药材溶液。分别吸取对照药材溶液2 μL,供试品溶液5 μL,点于同一硅胶G薄层板上,以环己烷-醋酸乙酯(1∶1)为展开剂,展开,晾干,喷以2%香草醛硫酸溶液,105 ℃加热至斑点清晰。供试品溶液在对照药材溶液相同位置呈现相同颜色斑点。分别处理泽泻对照药材、猪苓汤基准样品及缺泽泻猪苓汤样品。结果显示,猪苓汤基准样品中在与对照药材溶液相同位置显相同颜色斑点,缺泽泻猪苓汤样品无干扰,见图5。
2.4.3 薄层色谱测鉴定结果 取15批猪苓汤基准样品,按照猪苓茯苓鉴别、泽泻鉴别方法检测。结果如图5所示,15批猪苓汤基准样品均可见与对照药材一致的斑点且阴性无干扰。

图5 15批猪苓汤基准样品的薄层色谱Fig.5 Thin-layer chromatograms of 15 batches of Zhuling Decoction benchmark samples
3 讨论
3.1 基准样品处方剂量和制法
猪苓汤来源于汉代张仲景《伤寒论》,原方制法描述为:“猪苓(去皮)、茯苓、泽泻、阿胶、滑石(碎)各一两。上五味,以水四升,先煮四味,取二升,去滓,内阿胶烊消,温服七合,日三服”。基准样品制备方法应与传统的煎煮工艺基本相同[22],需要将古方中剂量折算成现代剂量以便于经典名方的开发研究。对于经典名方中剂量的折算及应用,需要参考前人考证的量制,也要关注中医理论指导和临床实践结果。多名专家学者曾对汉代剂量进行考证,得出1两可折算成13.8、15.6、7.0 g等结果[23-24]。柯雪帆等[25]和郝万山[26]通过测定出土的汉代衡器大司农铜权得出汉代1两折合15.6 g左右、1斤为250 g,但这个研究结论缺乏更多佐证资料,且大司农铜权的标称值不确定。后经大量文献资料查阅整理,发现国家计量总局主编《中国古代度量衡图集》中收载东汉百一十斤权重23 940 g,折合1斤217.63 g,1两为13.60 g[27]。邱光明从考古实物佐证、史料记载等全面、综合、真实的考证东汉度量衡史,得出东汉与今天的度量衡单位折算为汉代1斤为220 g,1两为13.8 g。经反复考证和研究,确定汉代“一两”折合现代剂量为13.8 g。
为考察“1两折合15.6 g”实验研究数据在“1两折合13.8 g”折算标准中的适用性,比较了以15.6 g与13.8 g为折算标准所制备样品(S15.6、S13.8)的出膏量、干膏率、含量测定指标。结果见表4,以13.8 g和15.6 g折算标准所制得样品干膏率和含量指标无明显差异(RSD≤5%)。
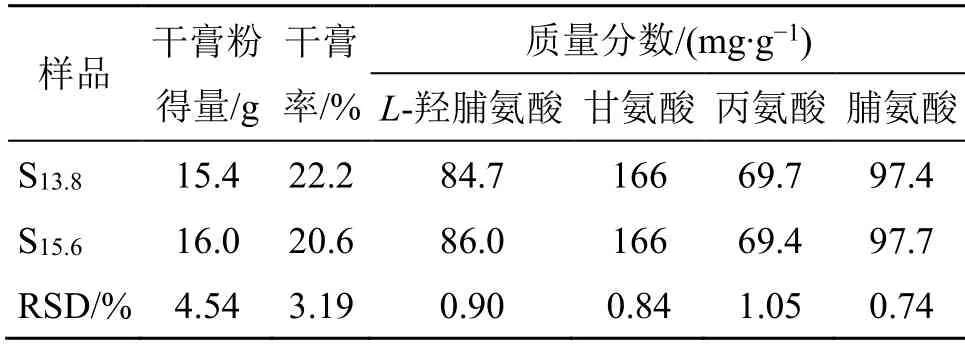
表4 剂量对比研究Table 4 Dose comparison study
经搜集两汉时的量器实测容量折算,以“大司农”器的实测数值为依据,折合每升单位量值在196~204 mL,用算数平均法求得其单位量值为199.4 mL,扣除因制造不精而产生的示值误差,每升厘定为200 mL[28]。
综上,猪苓汤剂量“一两折合13.8 g”“一升折合200 mL”,本研究确定猪苓汤中各药材用量为13.8 g,总方69 g,每服23 g。猪苓汤制法为用水800 mL,先加入猪苓、茯苓、泽泻、滑石4味药煎煮至400 mL,去掉药渣,再加入阿胶烊化溶解,每次温服约140 mL,3次/d。
3.2 含量测定成分选择
本实验研究的猪苓汤基准样品对应实物(冻干粉)为经考察的传统煎煮工艺制备而成汤剂经浓缩干燥后的实物[29],基准样品的质量标准选择参考《中国药典》成药中含量测定质量指标的选择要求,即指标成分稳定且含量不宜过低。因此,本实验以药味在猪苓汤组方中的君、臣、佐、使地位,首先考察了猪苓中麦角甾醇和泽泻中的23-乙酰泽泻醇B。实验结果显示,在猪苓汤样品中未检测出麦角甾醇,而23-乙酰泽泻醇B含量低于万分之一,检测误差大。推测原因是麦角甾醇和23-乙酰泽泻醇B极性小,水提效果较差。因此,麦角甾醇、23-乙酰泽泻醇B均不推荐为定量指标的成分。在猪苓汤基准样品中未发现来自于茯苓的定量成分,最终根据指标的稳定性和含量,确定以阿胶中的L-羟脯氨酸、甘氨酸、丙氨酸、脯氨酸为指标成分,建立猪苓汤基准样品的含量测定方法。鉴于《中国药典》2020年版中泽泻增加了23-乙酰泽泻醇C、阿胶增加了特征多肽的含量检测,后续本研究会考虑进一步对猪苓汤中的植物药成分、特征多肽含量指标进行深入研究。
3.3 检测项目确定
为确保猪苓汤中各药味都能实现质控,达到国家部门相关规定中“经典名方应加强专属性鉴别和多成份、整体质量控制”的要求[17],同时也具备确保质量标准的简单实用性,本研究将性状、鉴别、水分检查、特征图谱及含量测定共同作为猪苓汤基准样品质量属性的检测项目。具体检测项目内容如表5所示。

表5 猪苓汤基准样品检测项目Table 5 Test items of benchmark samples of Zhuling Decoction
3.4 检测结果分析
本研究对猪苓汤基准样品建立了薄层鉴别方法、HPLC法特征图谱和指标成分含量测定方法。建立的薄层色谱方法实现了猪苓、茯苓和泽泻等药味的鉴别;通过HPLC色谱法建立特征图谱,确定了8个共有峰,并指认了其中3个峰,以2号峰泽泻醇B为参照峰,15批猪苓汤基准样品特征图谱与对照特征图谱的相似度均良好。后续将探索更加准确的方法增加各药味的特征信息;通过HPLC法建立指标成分含量测定方法,15批基准样品指标成分平均转移率均在90%以上。
同时,对猪苓汤的干膏率及水分进行了考察并确定了范围。研究结果表明,含量测定、干膏率、水分均未现离散数据(平均值的70%~130%以外),表明制备的15批次猪苓汤基准物质对应实物质量基本稳定。
4 结论
猪苓汤用药精炼,组方严谨,本实验研究了猪苓汤基准样品对应实物的制备工艺,并制定了较科学合理的质量标准。建立了简便、可行、重复性良好的特征图谱,可以较全面反映猪苓汤的特征成分信息。通过干膏率、指标成分含量、转移率等的测定,对猪苓汤基准样品进行了质量属性研究,为猪苓汤质量标准制定提供实验数据。同时,建立了猪苓、茯苓、泽泻的薄层色谱鉴别方法,实现了药味的鉴别要求。
本研究目前除阿胶外未制定其他药味含量测定方法,后面将持续深入研究其他药味的含量测定方法,以期使猪苓汤颗粒的质量标准体系更加全面;在猪苓汤颗粒的后续开发过程中将尝试采用混批投料的方式,以期减小由于批次间差异所导致的质量差异。综上,本研究对经典名方猪苓汤基准样品初步建立了质量评价方法,以期为经典名方猪苓汤制剂的开发及质量控制提供借鉴。
利益冲突所有作者均声明不存在利益冲突
