碱性体系选择性回收废旧锂离子电池的研究进展
2022-06-16龚海强彭德招张佳峰
龚海强,彭德招,欧 星,张佳峰
中南大学冶金与环境学院,长沙 410083
锂离子电池能量因密度高、电压窗口宽、比容量大、循环稳定性好,以及具有环境友好,电流效率高等优势而备受关注.随着新型电子产品技术与锂离子电池开发的高速发展,锂离子电池市场占有率逐年增加,广泛应用于无线通信、家庭电子设备、便携式仪器、汽车以及其他工业设备.据估计,2020年锂离子电池生产价值达到250亿美元,且锂离子电池总市场规模突破500亿美元[1].但锂离子电池在数百次充放电循环后,正负极的材料结构受到严重破坏,从而使电极材料脱嵌Li+的可逆性大大降低.一般来说,锂离子电池的使用寿命为1~3 a,这意味着预计2020年,废旧锂离子电池规模将达到50万吨[2].目前车载锂离子电池是主要的废旧锂离子电池来源,主要的回收方法是由各个废旧车回收点或车辆维修点回收废旧电池,再根据电池实际可逆容量进行分类,在20%~80%之间的废旧锂离子电池可进行阶梯利用;不可阶梯利用的则进行拆解回收[3].这种回收方式流程繁琐,污染严重,不适合大批量的处理废旧锂离子电池.目前废旧锂离子电池回收体系不全,相关法律法规较少,成本高盈利少,严重阻碍了锂离子电池的批量回收处理.实现电池回收行业的合理规范整合,标准回收体系的有效健全,以及相关法律法规的制定是未来锂离子电池回收必须面对的挑战[4].
锂离子电池的大规模使用和高消耗速度给锂资源带来了巨大的压力,从锂含量较高的废旧锂离子电池中回收锂相对于从品位较低的自然锂矿和盐湖中提取锂,无论是在经济成本上还是环保效益上都具有明显的优势.此外,废旧锂离子电池中还含有大量的镍钴锰等有价金属,可进一步提高废旧锂离子电池回收的经济效益[5].废旧锂离子电池的回收工艺由早期的火法还原熔炼[6]到如今的还原热解[7],从近年来各种酸法联合回收[8]到目前的碱法联合回收[9],已经实现由火法回收向湿法回收的转变[10].Bhuntumkomol等[11]研究了镍氧化物在硫酸和氨溶液中的浸出行为,发现镍氧化物在两者中的浸出效果基本相同,但酸浸完成后需要额外的工序实现镍钴锰的沉淀分离.Wang等[12]实验后发现Ni、Mn和Co的沉淀过程在pH分别为2、1和3时开始,在pH为8、12和10时结束,酸法回收需要加入大量的碱液实现镍钴锰等有价元素与锂金属的分离.此外,根据Ni、Mn和Co的电势-pH相图,沉淀的pH范围相互重叠,导致有价金属分离不彻底.与之相比,氨浸则具备明显优势,在氨浸过程中,一方面无需加入大量的碱液来调整pH,另一方面在浸出过程中由于不同金属与氨根离子络合能力不同,可以实现Mn和Al的优先分离,减少了后续的分离步骤.
酸法和火法对废旧锂离子电池的处理效率低,流程复杂,成本高,回收的经济和环境效益较低.碱法对不同金属的选择性提取提高了回收的效率,使得短流程地回收废旧锂离子电池中的有价金属成为可能.当下碱法回收锂离子电池已然成为一个研究热点,本文对目前碱浸回收废旧锂离子电池的方法进行了详细的总结.
1 碱性浸出方法
1.1 氢氧化钠预处理碱浸体系
碱浸法处理正极材料回收Al是早期碱法回收处理的重要尝试,经过如图1(a)所示的拆解过程后,所得的正极材料中含有部分的Al,由于正极活性物质不与NaOH反应,而Al作为两性物质可以溶于强碱,故从电极上分离回收Al是可行的.谭群英等[13]采用二级碱浸处理废旧锂离子电池正极极片.第一级碱浸不加入新的NaOH,只加入第二级浸出返回的浸出液和电极原料,保持液固比为(3~4)∶1,搅拌速度为 150 r·min−1,温度 80 ℃,调节浸出液沉积铝.第二级碱浸,加入化学计量比1.2∶1的NaOH溶液和第一级碱浸渣,搅拌速度和温度不变.实验研究了加料方式,一、二级碱分配比,二级碱浓度,浸出时间以及外界温度对铝浸出率的影响.结果表明,先加碱后加原料,加料速度为 4 g·min−1,保持一二级碱分配为 40%和60%,碱质量分数为15%,反应时间为2 h,外界温度为95 ℃时,铝的浸出率最高[13].
但仅从电极材料上回收Al远远无法实现收益最大化,目前碱浸法通常以NaOH除Al作为一种预处理方法,先实现Al的回收,防止Al对后续金属回收步骤造成影响.张永禄等[14]采取循环碱浸−降温结晶氢氧化铝的工艺对正极材料进行处理.正极材料从废旧电池分离出后,将正极材料加入200 g·L−1的 NaOH 溶液,保持液固比为 7∶1,温度为90 ℃,浸出时间为2 h.浸出过滤后,滤渣可经进一步处理回收有价金属,滤液则降温结晶回收Al(OH)3,结晶所得一部分用于回收,另一部分用作下一步的结晶晶种,NaOH溶液则返回至碱浸阶段,实现碱液的循环利用.结果表明,废旧锂离子电池经循环碱浸后,铝的浸出率达90.98%,渣中平均铝质量分数为0.78%,母液含铝22.08 g·L−1[14].
随着正极材料除铝技术的逐渐发展,一些新型除铝技术,如选择浸出法、有机溶剂分离法、电解除铝法、热处理除铝法等同样被证明具有一定的工业价值[15].
1.2 氨系碱浸
氨浸−还原剂浸出体系是碱浸工艺的核心,在氨与 Co2+、Ni2+的络合作用下,Co2+、Ni2+以络合物Co(NH3)62+、Ni(NH3)62+的形式存在于溶液中,Al、Mn无法与氨产生稳定的络合作用,无法在以离子态存在于微碱性溶液中,从而实现了有价金属Co、Ni与金属杂质Al的绿色分离,大幅度降低了废旧电池的回收成本,回收的基本流程如图1(b)所示.Zheng等[16]采用氨−亚硫酸钠浸出体系回收废旧电池材料,发现在浸出过程中Mn的浸出行为和Ni、Co和Li有较大差异.在浸出过程中,锰−氨络合物不稳定,在323 K到333 K时, 溶解度与时间呈线性关系,当温度上升到343 K时,Mn逐渐以(NH4)2Mn(SO)3·H2O沉淀的形式析出.表明Mn与氨形成的稳定性较低,无法形成稳定的Mn-NH4络合物.同时研究表明Al在氨浸过程中表现出相同的规律[16].
在废旧锂离子电池的回收工艺中,虽然热力学上高价态的Co氧化物更容易与氨形成络合物,但在动力学上该反应十分缓慢[17].为了使Co2+、Ni2+更快的与氨结合形成络合物,高价态的Co 和Ni需要被还原为 Co2+、Ni2+.目前,SO32−和H2O2是常用的碱浸还原剂.王皓等[18]对比了亚硫酸钠和双氧水两种还原剂对废旧锂离子电池有价金属浸出率的影响.当氨水浓度为 4 mol·L−1,硫酸氨浓度1.5 mol·L−1,亚硫酸钠浓度 0.5 mol·L−1,搅拌速度500 r·min−1,温度 80 ℃,反应时间 300 min,液固比为100时,Li和Co的浸出率分别为95%和80%.在其他条件不变的情况下,将加入亚硫酸钠替换成加入质量分数为5%的双氧水,Li和Co的浸出率为95%和82%.两种方法均有着较高的浸出率,相对来说双氧水更加高效,且还原产物更加清洁.Ku等[17]运用亚硫酸氨等还原剂降低Ni、Co的价态,有效提高了Ni、Co的浸出动力学趋势,得出了相似的结论.Wang等[19]研究表明,在氨−缓冲剂体系中,还原剂的作用效率为Na2SO3≈(NH4)2SO3>Na2S2O3>Na2HPO3,而在无缓冲剂体系中,还原剂的作用效率为(NH)2SO3>Na2SO3≈Na2S2O3>Na2HPO3.在另一方面,若还原剂的量过高,pH上升,Ni2+、Co2+生成氢氧化物沉淀的趋势增大,降低氨络合物离子的稳定性.
Das等[20]研究表明,Ni(NH3)62+、Co(NH3)62+配合物的稳定pH范围一般为8~10.通过图1(c)、(d)和(e)可发现,加入(NH4)2CO3等缓冲体系,准确控制物质的量浓度之比C(NH3) /C(NH4+)是提高Co2+、Ni2+浸出率的关键,图1(d)中Eq指根据方程pH=9.26+log([NH3]/[NH4+])的计算理论值.Qi等[21]构建出NH3·H2O和NH4HCO3的缓冲体系,加入亚硫酸钠作为还原剂提高浸出率.同时控制亚硫酸钠的用量,避免导致金属离子的沉积.实验证明,当 NH3·H2O 的质量浓度为 120 g·L−1,NH4HCO3质量浓度为 75 g·L−1,物质的量之比n(Na2SO3):n(Co)=2∶1,浸出温度控制在353 K,浸出时间为240 min的条件下,Co、Li的浸出率达到最高值,分别为91.16%和97.57%.同时对浸出渣进行进一步研究,用硫酸溶解浸出渣后,过滤分离石墨,加入氨水调节pH,实现Al和Fe的分离.最后加入NH4HCO3,以MnCO3的形式回收碳酸锰.整个碱浸工艺回收效率高,工艺简单.Wang等[22]采用类似的多级氨浸回收废旧锂离子电池,并在原来的基础上,提出使用NH3-(NH4)2CO3-Na2SO3体系直接浸出Li和Co,同时Mn以MnCO3形式沉积,降低后续还原剂的消耗,大大降低了回收工艺的成本.
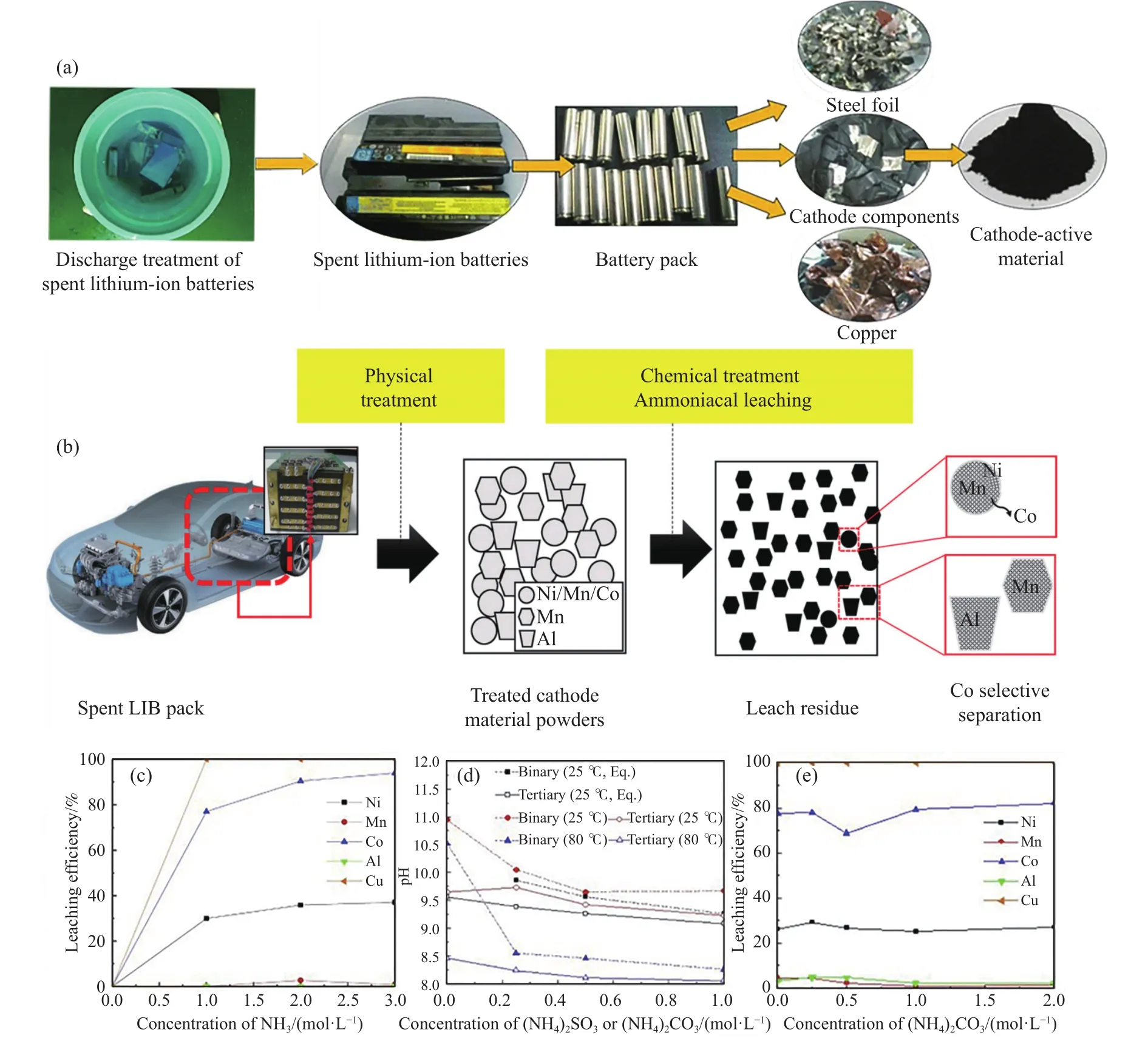
图1 (a)废旧锂离子电池处理流程图[23];(b)废旧锂离子电池回收过程[17];(c)浸出剂含量对金属浸出效率的影响(摩尔比NH3∶(NH4)2SO3:(NH4)2CO3=1∶0.5∶1, 80 oC和1 h)[17];(d)二元体系(氨+亚硫酸铵)或三元体系(氨+亚硫酸铵+碳酸铵)中pH的变化[17];(e)碳酸铵浓度对金属浸出效率的影响 (1 mol·L−1氨溶液,0.5 mol·L−1亚硫酸铵,80 oC和1 h) [17]Fig.1 (a) Flow chart of recycling waste lithium-ion batteries[23]; (b) the recycling process of waste lithium-ion batteries[17]; (c) the effect of leaching agent content on metal leaching efficiency (NH3∶(NH4)2SO3:(NH4)2CO3=1∶0.5∶1, 80 °C, and 1 h)[17]; (d) change in pH in a binarysystem (ammonia +ammonium sulfite) or ternary system (ammonia + ammonium sulfite + ammonium carbonate)[17]; (e) the effect of ammonium carbonate concentration on metal leaching efficiency (1 mol·L−1 ammonia solution, 0.5 mol·L−1 ammonia sulfite solution, 80 °C, and 1 h) [17]
此外,体系温度、固液比等也是影响Ni、Co浸出的关键因素,通常认为在80 ℃到100 ℃间浸出率较高.温度过高会导致Co(NH3)62+不稳定,降低浸出率,温度过低则会影响反应速度,降低反应效率.与此同时,温度的改变对Mn、Al、Cu的浸出效果几乎没有影响.调整浸出的固液比也能对Ni、Co的浸出造成显著影响,较低的固液比能扩大电极材料与浸出液的接触面积,提高Ni、Co的浸出效率[23].而固液比对Mn、Al的浸出率几乎没有影响.
直接利用还原剂处理废旧锂离子电池极片可以有效地回收废旧电池中的有价金属,实现废旧电池的循环利用.但反应速率慢,工艺周期长,氨耗量高等缺点制约着碱浸回收废旧锂离子电池工艺的商业化.本文以氨浸−还原剂体系为出发点,着重介绍通过搭配其他工艺流程,有效地解决氨浸−还原剂体系所遇到的主要问题.
1.2.1 氨浸−热加工−还原剂体系
氨浸−热加工体系是指在还原浸出前,先用热处理实现铝箔与活性物质的分离,并减小废旧电极材料的粒径大小,提高后续还原浸出效率,其具体的回收流程如图2(a)所示[24].同时,利用还原性气体直接还原高价态金属,并对热处理后的材料进行氨浸处理,形成络合物实现有价金属的回收.
Chen等[25]结合热加工和氨浸实现废旧锂离子电池的有效回收.废旧锂离子电池在放电后,通过机械拆分获得电极材料,并在空气气氛中300 ℃下焙烧1 h除去黏结剂,实现铝箔与活性物质的分离.活性物质在550 ℃下进一步煅烧0.5 h.煅烧前后的微观结构如图2(b)所示,煅烧过程有效去除了黏结剂和碳,且温度更高颗粒的粒径越小.以(NH4)2SO4和(NH4)2SO3溶液为浸出剂,以180 ℃,浸出2 h为实验条件,研究(NH4)2SO4浓度(1.5~3.5 mol·L−1)、(NH4)2SO3浓度(0.5~ 1.5 mol·L−1)和固液比 (67~200 g·L−1) 对浸出效率的影响.结果如图2(c)和(d)所示,当 (NH4)2SO4质量浓度为 3 g·L−1,(NH4)2SO3浓度为 0.75 mol·L−1,固液比为 83 g·L−1时,金属Ni、Li、Co和Mn的回收率分别达到98%、98%、81%和92%.随着(NH4)2SO3浓度增加,Mn逐渐形成 (NH4)2Mn(SO3)4·H2O和(NH4)2Mn(SO4)2·6H2O双盐导致浸出效率下降由图2(b)可看到.此外,研究表明(NH4)2SO4和(NH4)2SO3的浓度和固液比对金属的浸出率有不同的影响,因此通过调控双盐体系的成分可以更好地实现金属的选择性浸出.另外,浸出过程中氨并未进入最终产品,利用加热回收氨,建立氨的循环利用系统,对氨浸−热加工体系的工业化具有重大意义[24].
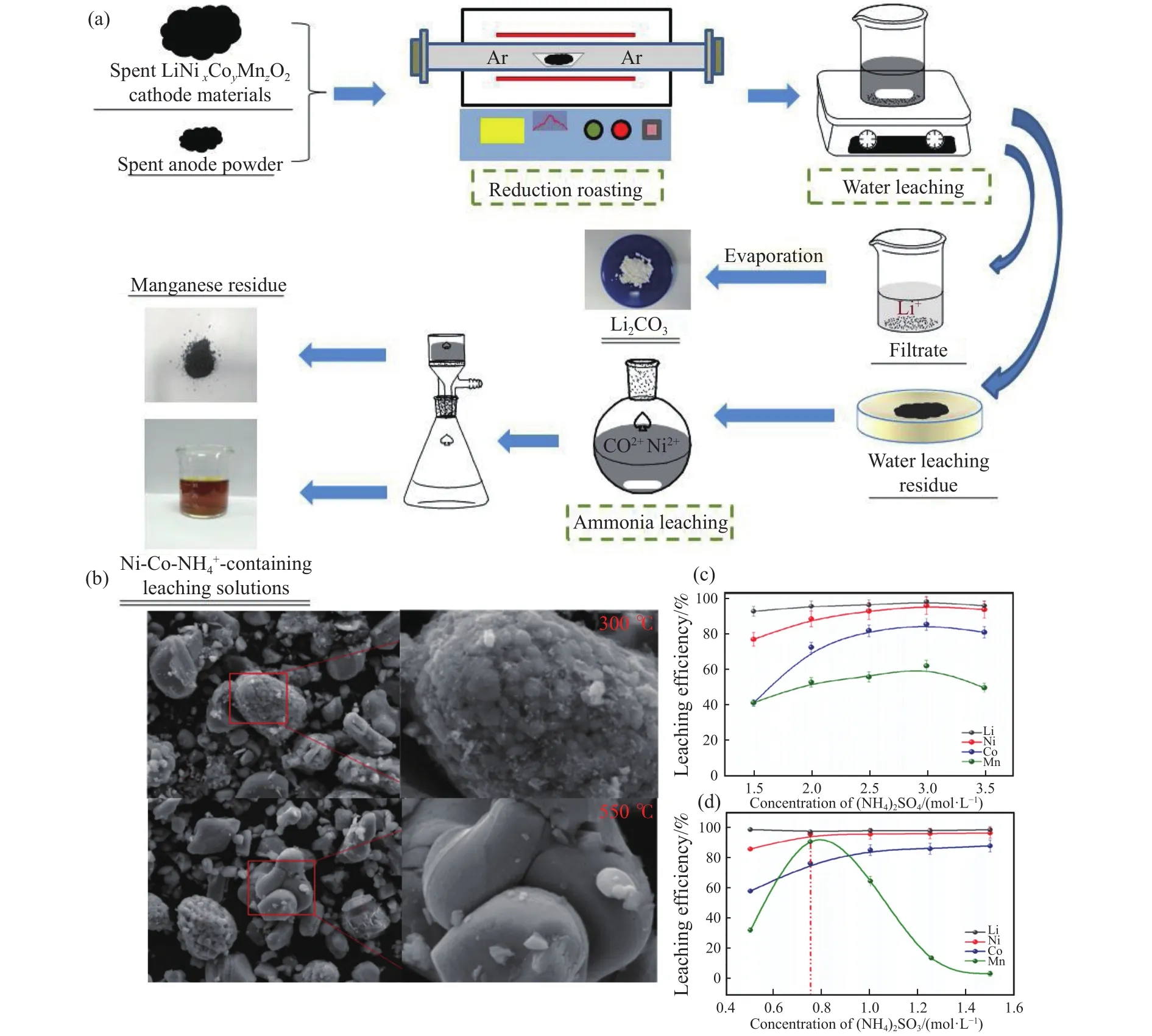
图2 (a) 废旧锂离子电池中有价金属回收过程图[24];(b) 在300 ℃和500 ℃下煅烧的阴极活性粉末的SEM图[25];(c) (NH4)2SO4浓度对Ni、Co、Li和Mn 浸出效果的影响 (3 mol·L−1 (NH4)2SO4,阴极粉末质量与加入溶液的体积比为 100 g·L−1)[25];(d) (NH4)2SO3浓度对 Ni、Co、Li和Mn 浸出效果的影响(3 mol·L−1 (NH4)SO3,阴极粉末质量与加入溶液的体积比为100 g·L−1)[25]Fig.2 (a) Diagram of the valuable metal recovery process from waste lithium-ion batteries[24]; (b) the SEM images of the cathode active powder calcined at 300 ℃ and 500 ℃[25]; (c) the effect of (NH4)2SO4 concentration on Ni, Co, Li, and Mn leaching efficiencies (3 mol·L−1 (NH4)2SO4, the ratio of the mass of cathode powder to volume of added solution is 100 g·L−1) [25]; (d) the effect of (NH4)2SO3 concentration on Ni, Co, Li, and Mn leaching efficiencies (3 mol·L−1 (NH4)2SO3, the ratio of the mass of cathode powder to volume of added solution is 100 g·L−1) [25]
1.2.2 氨浸−还原剂−电沉积体系
氨浸−电沉积体系利用金属与氨根离子形成配合物,有价金属仍以离子态进入溶液,再通过不同金属沉积电位的差别实现有价金属的选择分离.氨浸−电沉积体系可以大幅度提高金属回收效率,降低二次污染[26].
陈梦君等[27]结合碱浸与电沉积回收废旧锂离子电池,废旧的锂离子电池经过放电、干燥、破碎等预处理步骤后得到废旧正极材料,流程示意如图3(a)所示.所得正极材料在氨质量浓度为120 g·L−1,碳酸氢铵质量浓度为 75 g·L−1,温度为353 K,亚硫酸钠和钴的物质的量之比为2∶1,反应时间为240 min的条件下进行络合浸出.过滤后浸出液成分为:Li,718.20 mg·L−1、Cu,278.90 mg·L−1、Ni,386.40 mg·L−1、Co,3291.00 mg·L−1、Mn,0.40 mg·L−1、Al,0.90 mg·L−1.浸出液在 1 V 下电解 3 h,得到钴、镍、铜和锂的金属粉末.反应过程示意如图3(b)所示.实验表明,随着电解电流的升高,镍、钴和铜的回收率不断升高,当电流达到5 A时,镍、钴和铜的回收率接近100%.而锂的回收率呈现先降后升再降再升的波动式规律.由图3(c)可从外观看出当筛分颗粒粒径在0.45 mm以下时Cu和Al的杂质含量较少.

图3 (a)氨浸−电沉积的工艺流程;(b) 电解沉积装置示意图[28];(c) 锂离子电池破碎筛分所得粉末[28]Fig.3 (a) Process flow of ammonia leaching-electrodeposition; (b) schematic diagram of an electrolytic deposition device[28]; (c) powder obtained from crushing and sieving of lithium-ion batteries[28]
1.2.3 氨浸−还原剂−锂吸附体系
氨浸−还原剂−锂吸附体系是指通过锂离子筛将锂离子直接从氨浸浸出液中吸附出来基本思路如图4(a)所示.氨浸−还原剂−锂吸附体系对锂具有很好的回收效果,且离子筛可以循环利用,具备潜在的低成本商业价值.
Wang等[29]利用热处理对废旧锂离子电池进行预处理,在NH3·H2O和NH4HCO3的体系下加入还原剂H2O2,再以锂离子筛分离Li和Ni、Co,工艺流程如图4(b)所示.当 H2O2质量浓度为 63.24 g·L−1,NH3·H2O 质量浓度为 367.5 g·L−1,NH4HCO3质量浓度为 140 g·L−1时,Li、Ni和Co 的回收率分别为81.2%,96.4%和96.3%.由图4(c)和(d)不难发现,初始锂含量的增加强化了离子筛的Li+/H+离子交换过程,锂可更容易地进入离子筛中,从而提高了吸收容量,而过量的离子筛则显著降低了溶液中的游离锂离子含量,剩余的锂离子更难以进入离子筛中,导致容量的降低.浸出液通过锰型离子筛后,Li+被选择性吸附,回收率达到99.9%,只有0.17%的Ni2+和1.79%的Co2+被吸附进离子筛中.然后用HCl溶液分离并解吸Li+,同时实现锂离子筛的循环利用.用NaOH溶液中和锂离子解吸液后加入Na2CO3,沉淀获得Li2CO3.另一方面,含氨的镍钴浸出液可以通过蒸馏回收氨,再用硫酸溶解回收.氨浸−还原剂−锂吸附体系实现了废旧锂离子电池的高效回收,浸出剂和吸附筛可以循环利用,整个过程污染小,选择性回收效果好,省去了复杂的分离回收过程,大幅度缩短了工艺流程,降低回收成本.

图4 (a)锂吸附法回收过程示意图[29];(b)锂吸附法回收锂离子电池中Li、Co和Ni的流程[29];(c) 初始锂离子浓度[29]; (d)每升溶液锂离子筛用量与锂离子筛上吸附的Li+、Ni2+和Co2+的量的关系[29]Fig.4 (a) Schematic diagram of lithium adsorption recovery process[29]; (b) the process of recovering Li, Co, and Ni in lithium-ion batteries by lithium adsorption[29]; (c) initial lithium-ion concentration[29]; (d) the amount of lithium-ion sieve per liter of solution relationship with the amounts of Li+, Ni2+,and Co2+ adsorbed on the lithium-ion sieve[29]
1.2.4 氨浸−还原剂−氧化分离体系
氨浸后的滤渣除了含有大量的Mn、Al化合物,残留的负极材料石墨同样具有一定的回收价值.氨浸−还原剂−氧化分离体系通过利用酸性强氧化氛围溶解Mn、Al化合物,得到高纯度石墨废渣,清洗后实现石墨回收.
吴彩斌和李本盛[30]通过还原氨浸回收废旧电池中的废石墨制备石墨烯.废旧锂离子电池在1.5 mol·L−1氨水、1 mol·L−1亚硫酸氨和1 mol·L−1碳酸氢氨组成的还原浸出溶液中实现有价金属的回收.浸出渣通过高锰酸钾、浓硫酸插层剂插层和过氧乙酸辅助氧化剥离废旧石墨,实现石墨烯的再生.在质量分数为5%的盐酸来洗去石墨烯表面金属离子后,经105oC干燥,最终获得高纯度石墨烯.通过氧化分离回收石墨烯,避免使用硝酸盐和其他危险有机物,对环境较为友好,同时工艺流程短,制得的石墨烯品质高具备工业化实践的潜力.
2 结束语
近年来,由于锂离子电池的大规模使用和有限的生命周期,大量退役锂离子电池的处理成为了锂离子电池行业亟待解决的问题.
(1)碱性浸出回收废旧锂离子电池具备清洁、高效、节能、短流程、可工业化应用、可大规模处理等优点,是锂离子电池回收研究的主要方向.氨浸−还原剂体系是目前碱性浸出的主要研究方向,通过形成络合物选择性地从电极材料中分离提取有价金属,配合电化学和萃取等方法实现清洁高效的回收.
(2)浸出效果的优劣取决于还原剂的用量、浸出温度、液固比、反应时间以及碱的浓度.此外,通过机械活化等预处理手段可大幅度降低浸出条件.
(3)目前有关氨浸回收锂离子电池技术已有深入的研究,但一些问题限制了该工艺的工业化应用,特别是工业上的实际效果和工艺效益方面还有待探索.最为突出的问题是氨浸的最佳固液比较低、浸出速率较酸浸慢以及氨耗量较大,这直接导致生产的效益降低.
(4)此外,当下研究的回收方法往往是针对一种锂离子电池,而市面上不同类型的锂离子电池,成分和结构不同,为工业化回收带来了较大困难.
