大黄素对内毒素诱导的牙龈成纤维细胞ROS/MAPK/AP-1通路及炎性因子表达的影响
2022-06-16杨桂梅孙玉梅颜淑云郭玮
杨桂梅 孙玉梅 颜淑云 郭玮
大黄素是从中药大黄中提取的有效活性成分,具有抗肿瘤、抗炎、抗氧化、抗菌、抗病毒等多种生理活性,研究表明大黄素可促进牙周膜细胞活性及增殖,对牙周炎症相关疾病具有一定的缓解作用[1-2],具体作用机制仍不清晰。活性氧/丝裂原活化蛋白激酶/活化蛋白1(reactive oxygen species/mitogen-activated protein kinase/activator protein-1,ROS/MAPK/AP-1)通路与机体炎症反应密切相关,细菌裂解后释放的LPS可诱导ROS产生,并促进MAPK、AP-1的表达,并加速机体相关炎症因子的表达[3-4]。本研究利用脂多糖诱导人牙龈成纤维细胞炎症反应,初步探究大黄素作用机制,供临床治疗牙周病参考。
1 材料与方法
1.1 细胞
人牙龈成纤维细胞HGF-1(资源编号:BNCC339845)(北京贝纳创联生物技术研究院)。
1.2 主要试剂及仪器
大黄素(上海麦克林生化科技有限公司);牙龈卟啉单胞菌内毒素(广东翁江化学试剂有限公司); ROS活性氧诱导剂/ROS诱导剂(上海贝博生物有限公司);抗MAPK、AP-1、GAPDH、山羊抗小鼠IgG(Abcam公司, 美国; p38-MAPK(武汉菲恩生物科技有限公司); 细胞培养箱(MCO-15AC, SANYO公司, 日本); 酶标仪(XElx800, Perkin Elmer公司, 美国);蛋白凝胶成像仪(GIS-500, 杭州Miulab公司)。
1.3 细胞培养
将HGF-1细胞株细胞复苏,用含有10%FBS的DMEM培养液培养,培养箱条件设为37 ℃、 5% CO2,每两天更新一次培养液。待培养瓶中细胞密度高于80%时进行0.25%胰蛋白酶消化传代培养。取对数生长期细胞进行后续实验。
1.4 大黄素溶液制备
大黄素用二甲基亚砜溶解,配置成50 mmol/L的母液,使用时用DMEM培养基稀释成20、40、60、80、100、120 μmol/L的含药培养基[5]。
1.5 大黄素对HGF-1细胞增殖的影响
采用CCK-8法测定大黄素对人牙龈成纤维细胞增殖的影响。收集对数生长期HGF-1细胞,接种于96 孔板,细胞约为1×104个/孔,分别加入不同浓度的(0、 20、 40、 60、 80、 100、 120 μmol/L)含大黄素培养基, 37 ℃、 5% CO2条件下培养24 h,更换新鲜培养基后每孔加入10 μL CCK-8溶液,继续在培养箱中孵育1~4 h,测定各孔HGF-1细胞在450 nm处的吸光度,根据公式计算不同浓度大黄素对HGF-1细胞增殖的影响。细胞活力(%)=[A加药-A空白]/[A对照-A空白]×100%,A加药:含有细胞、含大黄素培养基、CCK-8溶液孔的吸光度值;A空白:有相应培养基、CCK-8溶液、无细胞孔的吸光度值;A加药:含有细胞、CCK-8溶液、无药培养基孔的吸光度值。
1.6 HGF-1细胞分组及药物处理
收集对数生长期HGF-1细胞,随机分为对照组(常规培养)、 LPS组(800 μg/L LPS培养24 h后更换普通培养基培养24 h)[6]、大黄素组(800 μg/L LPS培养24 h后更换60 μmol/L大黄素培养基培养24 h)、ROS诱导剂组(800 μg/L LPS培养24 h后加入稀释比为1∶1 000的ROS培养1 h,然后换用普通培养基继续培养24 h)、大黄素+ROS诱导剂组(800 μg/L LPS培养24 h后计入稀释比为1∶1 000的ROS培养1 h,然后换用60 μmol/L大黄素培养基继续培养24 h)。培养结束后采集各组细胞用于后续实验。
1.7 各组HGF-1细胞活力检测
收集各组HGF-1细胞,根据CCK-8试剂盒中的具体操作步骤测定各组HGF-1细胞的细胞活力。
1.8 各组HGF-1细胞中炎性因子及氧化应激因子表达水平检测
收集各组HGF-1细胞,无菌条件下将细胞转移至离心管中, 1 000 g离心后取上清液,根据白细胞介素(interleukin, IL)-6、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malonaldehyde, MDA)、乳酸脱氢酶(lactate dehydrogenase, LDH)相关试剂盒中检测步骤进行测定。
1.9 各组HGF-1细胞中ROS含量测定
利用荧光探针DCFH-DA进行ROS检测,收集各组HGF-1细胞,弃去培养液加入经DMEM培养基稀释的DCFH-DA(1∶1 000), 37 ℃、5% CO2条件下孵育20 min,经DMEM培养基洗涤细胞后在荧光分光光度计中测定DCF的荧光强度。细胞内的ROS可将无荧光的DCFH氧化为有荧光的DCF,因此DCF荧光强度越高即代表细胞内ROS含量越多。
1.10 各组HGF-1细胞中ROS/MAPK/AP-1通路相关蛋白检测
收集各组HGF-1细胞,弃培养液,移入无菌离心管中,低温加入蛋白质提取试剂盒中RIPA裂解液,充分裂解后离心取上清液,根据BCA蛋白浓度测定试剂盒的操作步骤测定其中蛋白质含量,取20 μL各组待测样品,通过SDS-PAGE电泳分离蛋白,然后转移到PDVF膜上,用TBST漂洗,然后用5%的脱脂奶粉室温封闭,加入MAPK(1∶1 000)、AP-1(1∶1 000)、GAPDH(1∶2 000)一抗, 4 ℃条件下孵育并过夜,用TBST漂洗,加入辣根过氧化酶标记的山羊抗小鼠IgG(1∶10 000)继续孵育2 h,经显色、曝光后分析各组HGF-1细胞中MAPK、 AP-1蛋白表达情况。
1.11 统计学分析
2 结 果
2.1 大黄素对HGF-1细胞增殖的影响
大黄素浓度在20~60 μmol/L时HGF-1细胞的细胞活力逐渐增强(P<0.05),浓度在80~120 μmol/L时细胞的细胞活力显著下降(P<0.05),选择60 μmol/L的大黄素浓度用于后续研究(表 1)。

表 1 大黄素对HGF-1细胞增殖的影响
2.2 各组HGF-1细胞的细胞活力比较
与对照组相比,LPS组HGF-1细胞活力显著降低(P<0.05);与LPS组相比,大黄素组HGF-1细胞活力显著升高(P<0.05);与大黄素组相比,ROS诱导剂组及大黄素+ROS诱导剂组HGF-1细胞活力显著降低(P<0.05);与ROS诱导剂组相比,大黄素+ROS诱导剂组HGF-1细胞活力显著升高(P<0.05)(表 2)。

表 2 各组HGF-1细胞活力比较
2.3 各组HGF-1细胞中炎症因子表达水平比较
与对照组相比,LPS组HGF-1细胞中IL-1β、IL-6、TNF-α表达水平显著升高(P<0.05); 与LPS组相比,大黄素组HGF-1细胞中IL-1β、IL-6、TNF-α表达水平显著降低(P<0.05);与大黄素组相比,ROS诱导剂组及大黄素+ROS诱导剂组HGF-1细胞中IL-1β、IL-6、TNF-α表达水平显著升高(P<0.05);与ROS诱导剂组相比,大黄素+ROS诱导剂组HGF-1细胞中IL-1β、IL-6、TNF-α表达水平显著降低(P<0.05)(表 3)。

表 3 各组HGF-1细胞中炎症因子表达水平比较
2.4 各组HGF-1细胞中氧化应激因子表达水平比较
与对照组相比,LPS组HGF-1细胞中SOD表达水平显著降低(P<0.05),MDA、LDH表达水平显著升高(P<0.05);与LPS组相比,大黄素组HGF-1细胞中SOD表达水平显著升高(P<0.05),MDA、LDH表达水平显著降低(P<0.05);与大黄素组相比,ROS诱导剂组及大黄素+ROS诱导剂组HGF-1细胞中SOD表达水平显著降低(P<0.05),MDA、LDH表达水平显著升高(P<0.05);与ROS诱导剂组相比,大黄素+ROS诱导剂组HGF-1细胞中SOD表达水平显著升高(P<0.05),MDA、LDH表达水平显著降低(P<0.05)(表 4)。

表 4 各组HGF-1细胞中氧化应激因子表达水平比较
2.5 各组HGF-1细胞中ROS含量比较
与对照组相比,LPS组HGF-1细胞中ROS含量显著升高(P<0.05);与LPS组相比,大黄素组HGF-1细胞中ROS含量显著降低(P<0.05);与大黄素组相比,ROS诱导剂组及大黄素+ROS诱导剂组HGF-1细胞中ROS含量显著升高(P<0.05);与ROS诱导剂组相比,大黄素+ROS诱导剂组HGF-1细胞中ROS含量显著降低(P<0.05)(表 5)。

表 5 各组HGF-1细胞中ROS含量比较
2.6 各组HGF-1细胞中ROS/MAPK/AP-1通路相关蛋白表达比较
与对照组相比,LPS组HGF-1细胞中p38-MAPK、AP-1蛋白表达水平显著升高(P<0.05);与LPS组相比,大黄素组HGF-1细胞中p38-MAPK、AP-1蛋白表达水平显著降低(P<0.05);与大黄素组相比,ROS诱导剂组及大黄素+ROS诱导剂组HGF-1细胞中p38-MAPK、AP-1蛋白表达水平显著升高(P<0.05);与ROS诱导剂组相比,大黄素+ROS诱导剂组HGF-1细胞中p38-MAPK、AP-1蛋白表达水平显著降低(P<0.05)(表 6、 图 1)。

表 6 各组HGF-1细胞中MAPK、AP-1蛋白表达水平比较
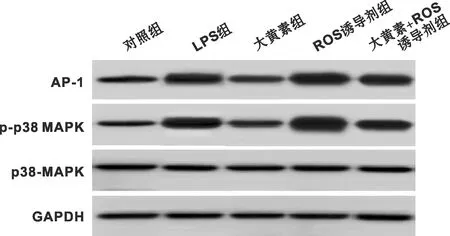
图 1 各组HGF-1细胞中p38-MAPK、AP-1蛋白表达情况
3 讨 论
牙周病是由粘附在牙齿表面的微生物群引起的慢性感染性疾病,人牙龈成纤维细胞是牙周组织主要的细胞类别之一,在牙周组织修复及再生中发挥重要作用,在病理状态下,人牙龈成纤维细胞被炎症介质激活,增加炎症因子的释放,进而影响患者口腔健康[7-8]。牙周组织中的细菌裂解后产生的脂多糖可作用于牙龈成纤维细胞及牙周膜细胞, 增强牙周组织炎症反应,进而参与牙周病的产生与发展[9]。牙龈卟啉单胞菌是牙周病的重要致病菌之一,在整个炎症反应过程中起到重要作用,用牙龈卟啉单胞菌LPS诱导牙龈成纤维细胞HGF-1发生炎症反应的效果显著[10]。本研究结果显示,LPS显著降低HGF-1的细胞活性,HGF-1细胞中IL-1β、IL-6、TNF-α等炎症因子及MDA、LDH氧化应激因子表达水平显著升高,SOD表达水平显著降低,提示LPS可诱导牙龈成纤维细胞的炎性反应,并降低其抗氧化能力,Dronik等[11]研究表明脂质过氧化在牙周病患者牙周组织炎症发生中起到重要作用,且与正常人相比,牙周炎患者血浆中沉积的MDA较多,抗氧化能力显著较低。
大黄素是中药大黄的有效成分之一,具有抗炎、抗氧化、抗菌等多种生物活性, Lee等[12]研究发现大黄素可显著降低花生四烯酸诱导的HepG2肝细胞氧化应激反应,并显著降低HepG2肝细胞中的ROS含量。张国华等[13]研究表明大黄素能显著改善牙龈卟啉单胞菌诱导的大鼠牙周炎,并降低大鼠牙周组织中IL-6、TNF-α等炎症因子的表达。本研究结果显示,经过大黄素处理的HGF-1细胞的细胞活力较LPS处理细胞有显著提升,IL-1β、IL-6、TNF-α等炎症因子及MDA、LDH氧化应激因子表达水平显著降低,SOD表达水平显著升高,表明大黄素具有抑制LPS诱导的HGF-1细胞炎性反应,提高其抗氧化能力的作用。
多项研究表明ROS/MAPK/AP-1通路与机体炎症反应及氧化应激反应密切相关,ROS在氧化剂应激及炎症反应中具有重要作用,被促炎因子激活的成纤维细胞可产生大量ROS,引起机体氧化还原失衡,导致细胞发生过氧化损伤,进而降低细胞活性,促进细胞死亡[14-15],ROS会使下游的MAPK发生磷酸化,进而激活AP-1等多种转录因子[16],激活的AP-1可增加IL-1β、TNF-α等炎症因子的表达[17],进而促进机体炎症反应。苏丽等[18]研究发现甘草次酸可通过抑制ROS/p38-MAPK/AP-1信号通路降低电离辐射诱导的小鼠巨噬细胞炎症反应。本研究结果显示,LPS组及ROS诱导剂组HGF-1细胞中ROS含量、ROS/MAPK/AP-1通路相关蛋白表达水平显著高于对照组,表明HGF-1细胞的炎性反应及氧化应激反应可能与ROS/MAPK/AP-1通路的激活密切相关;与ROS诱导剂组相比,大黄素+ROS诱导剂组HGF-1细胞中ROS含量、ROS/MAPK/AP-1通路相关蛋白表达水平显著降低,提示大黄素缓解LPS诱导的HGF-1细胞炎性反应及氧化应激反应与抑制ROS/MAPK/AP-1通路有关。
综上所述,大黄素具有降低LPS诱导的HGF-1细胞炎性反应的作用,可能通过抑制ROS/MAPK/AP-1通路发挥作用。
