低氧对鼠枸橼酸杆菌感染小鼠肠道固有免疫功能的影响※
2022-06-16朱沁芳杜忠蕾贾茹涵马倩倩周义玲申香群
高 翔,张 昱,朱沁芳,杜忠蕾,韩 莹,贾茹涵,马倩倩,周义玲,申香群,张 伟△
[1.青海大学高原医学研究中心;2.高原医学教育部重点实验室;3.青海省高原医学应用基础重点实验室(青海-犹他高原医学联合重点实验室);4.青海大学医学部基础医学部,青海 西宁]
研究低氧对肠道免疫相关机制的影响,找到干预靶点,能够解决高原地区肠源感染性疾病防控中的瓶颈性问题。本研究以小鼠感染肠道鼠枸橼酸杆菌(Citrobacterrodentium)为模型,首次在高原环境下探讨低氧对细菌感染小鼠肠道固有免疫功能的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级C57BL/6野生型小鼠(18~20g),8周龄,雌性,购于湖南斯莱克景达实验动物有限公司[许可证号:SCXK(湘)2020-0001],饲养于独立通气鼠笼(IVC,H6,苏州实验动物设备有限公司)。实验方案通过青海大学动物保护伦理委员会审查。
1.1.2 实验试剂
所用抗体购自美国BD和BioLegend公司;辣根过氧化物酶、TMB显色液购自上海玉博生物科技有限公司;4%多聚甲醛和麦康凯琼脂培养基购自Solarbio公司;胎牛血清购自浙江天杭生物科技有限公司。
1.2 方法
1.2.1 实验动物分组与造模
将32只小鼠随机分为常氧对照组(NC)、常氧感染组(NB)、低氧对照组(HC)和低氧感染组(HB),每组8只。感染组小鼠通过灌胃(C.rodentium,菌量约为5×108CFU/mouse)造模。常氧组小鼠饲养于IVC鼠笼(2260m,大气压582mmHg,PO2121.6mmHg),低氧组饲养于低压氧仓(模拟海拔5000m,大气压405mmHg,PO284.7mmHg)。造模期间监测小鼠体重和感染组小鼠排菌量以观察其在低氧条件下的体重变化以及感染组小鼠排菌量的变化。1周后取材,收集结肠和脾脏,采集血清,用H&E染色法观察炎症病理变化,用PCR、Western blotting法检测脾脏及结肠中吞噬细胞的炎性细胞因子和趋化因子,用Elisa法检测血清及脾脏组织中炎性细胞因子的表达水平,用Immunofluorescence法观察小鼠结肠及脾脏吞噬细胞趋化因子的表达水平。
1.2.2C.rodentium活化
配制C.rodentium菌悬液,在LB固体培养基及麦康凯琼脂培养基上进行平板划线分离培养,倒置放于37 ℃培养箱内过夜。挑选单个C.rodentium菌落接种于LB液体培养基,在恒温培养振荡器内(37℃,200r/min)过夜。将菌株复苏活化后,通过传代培养(2代)恢复活力,用于后续实验。
制作小鼠结肠炎模型:用无菌PBS将C.rodentium菌液浓度调整为2.5×108CFU/mL,感染组小鼠灌胃菌量为5×108CFU/mouse。C.rodentium感染小鼠引发的肠黏膜炎症与人类炎症性肠病(IBD)症状相似,长期用于EPEC和EHEC感染的发病机制研究[1],可作为研究小鼠肠源性感染性疾病和IBD的良好模型[2]。
1.2.3 小鼠体重、排菌量统计
自C.rodentium造模开始,每天称重小鼠,监测体重变化。同时收集感染组小鼠粪便,称重,稀释,调整浓度(0.1mg/μL),混匀,做浓度梯度稀释,取100 μL稀释液接种在麦康凯琼脂培养基上,置37 ℃培养箱过夜,根据菌落数计算排菌量(CFU/g)。
1.2.4 实验动物取材
摘除小鼠眼球取血,静置2 h后离心收集血清备用;消毒小鼠腹部,开腹,取结肠测量长度;收集结肠和脾脏。
1.3 统计学方法
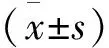
2 结果
2.1 小鼠表现
NB组小鼠出现感染细菌3天后状态萎靡、便稀软、背部隆起、毛发枯燥;HB组症状早于NB组出现,且更为明显,并伴有轻微的便血。
2.2 小鼠体重变化及排菌量变化
小鼠体重变化:小鼠体重与初始体重相比。重复测量方差分析结果(表1)显示,小鼠体重变化在不同时间段的差异有统计学意义(F=16.119,P<0.001),不同组间小鼠体重变化差异有统计学意义(F=24.149,P<0.001),其中NB、HB组小鼠体重降低明显,显示感染能使小鼠体重减轻;HB组小鼠体重降低较NB组更为明显,显示低氧环境可降低感染后小鼠的体重。(图1)
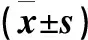
表1 小鼠体重与初始体重变化百分比
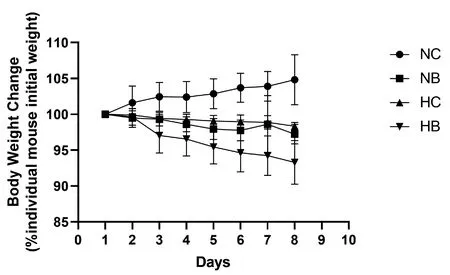
图1 低氧处理1周小鼠体重变化图
图2显示,感染组小鼠粪便细菌在麦康凯培养基上生长良好。计数菌落用以反映小鼠排菌程度。
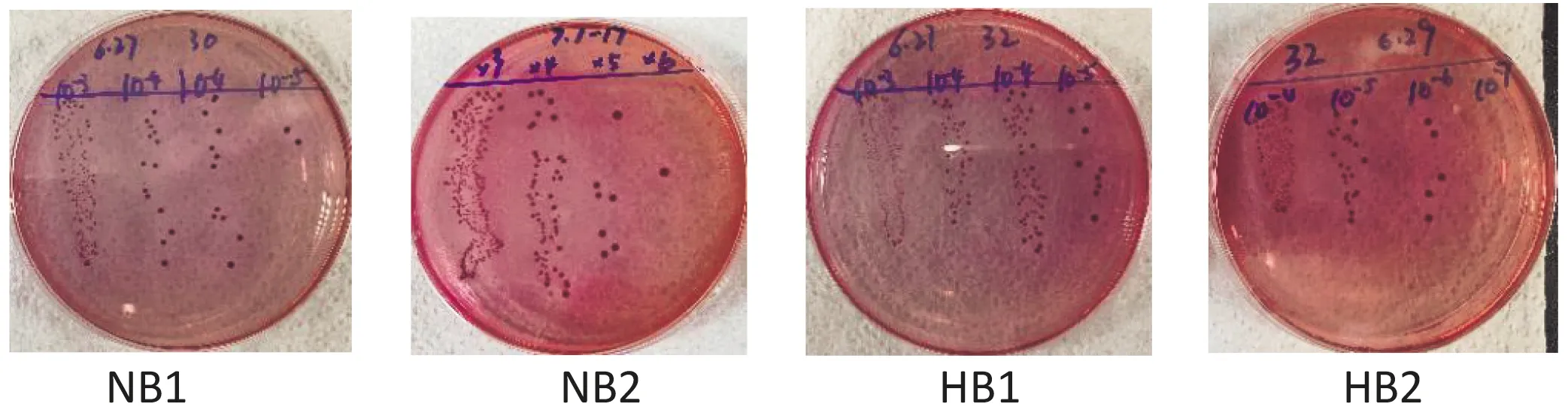
图2 细菌生长状态图
图3和表2为各感染组间小鼠排菌量非参数检验结果,HB组小鼠排菌量较NB组明显增加。排菌量的增加表示低氧暴露可使小鼠肠道清除细菌能力减弱,且NB组小鼠在第6、7天排菌量明显下降(P<0.05),说明常氧条件下机体清除细菌能力正常。
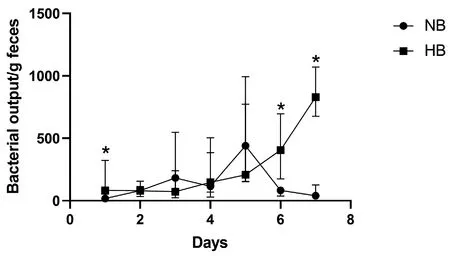
图3 小鼠排菌量变化图(*:与NB组比较,P<0.05)
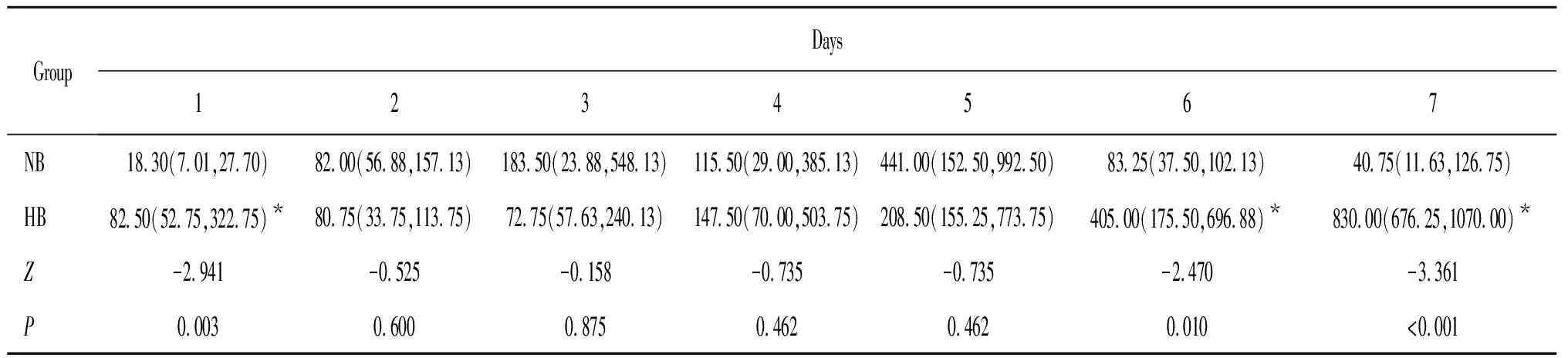
表2 感染组小鼠排菌量统计表[M(P25,P75)]
2.3 小鼠结肠长度变化及病理评分
感染组小鼠结肠缩短、变细,出现溃疡现象。表3显示,感染组小鼠结肠长度均变短,与对照组比较存在显著性差异,说明小鼠在感染C.rodentium后,结肠炎症反应加剧,导致结肠缩短。NB组和HB组比较,二者存在明显差异,说明低氧可以导致小鼠结肠缩短。组织病理学评分采用一种改良的评分方法[3]:细胞浸润得分(评分范围:0~4)和结肠组织损伤得分(评分范围:0~4)之和。结果显示(表3),感染组与对照组比较,病理组织评分均存在显著性差异。NB组和HB组比较,低氧情况下感染组病理评判结果差异更为显著,说明低氧能加剧小鼠感染C.rodentium后结肠的病理损伤。
表3 小鼠结肠长度及病理评分
病理结果显示(图4),对照组小鼠肠黏膜组织结构完整,绒毛排列整齐且隐窝较深;感染组小鼠肠黏膜组织发生损伤,肠壁变薄,发生水肿,绒毛长短不一且紊乱,隐窝变浅并伴有炎性细胞浸润,HB组尤为明显,结肠组织结构完整性破坏明显,黏膜损伤严重。
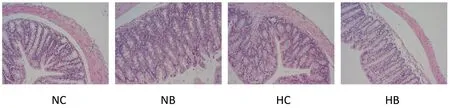
图4 结肠组织病理切片图(20×,H&E)
2.4 小鼠脾脏炎性细胞浸润变化
图5显示,感染组小鼠脾脏有大量炎性细胞浸润。相比而言,HB组炎性细胞浸润不如NB组严重。
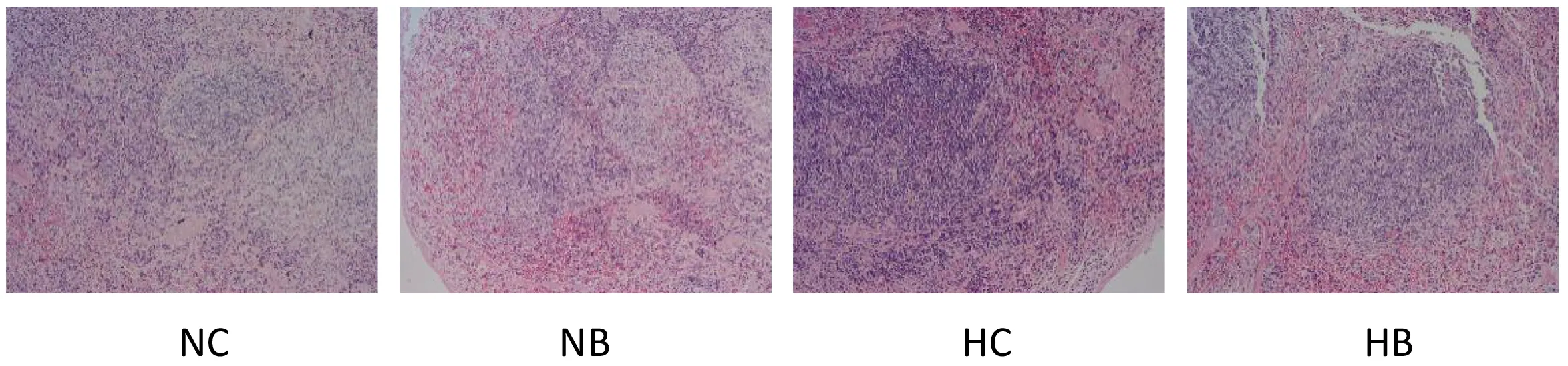
图5 脾脏组织切片(20×,H&E)
2.5 小鼠血清和脾脏、结肠中相关炎性因子表达
表4~5显示,用C.rodentium感染小鼠后,NB、HB组血清和脾脏、结肠中的炎性因子TNF-α、IL-1β、IFN-γ表达水平均明显增高,且血清中IL-6 表达增加。HB组各炎性因子表达水平虽均有增高,但不及NB组,提示低氧暴露可致炎性反应能力下调。HC组与NC组比较,血清中IL-1β和脾脏中IL-1β、TNF-α炎性因子均有降低,提示低氧暴露可造成炎性反应能力减弱。
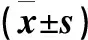
表4 ELisa法检测的血清及脾脏中相关炎性因子水平
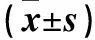
表5 用PCR法检测的结肠及脾脏中相关炎性因子
2.6 低氧暴露下的小鼠感染C.rodentium后对吞噬细胞的影响
表6~7及图6~7为用PCR、Western blotting法和Immunofluorescence法检测的小鼠脾脏和结肠中吞噬细胞的巨噬细胞炎性蛋白2(MIP2)、角质细胞趋化因子(KC)、单核细胞趋化蛋白1(MCP1)水平。结果显示,用C.rodentium感染小鼠后,脾脏、结肠中的中性粒细胞趋化因子MIP2、KC和巨噬细胞趋化因子MCP1表达水平与对照组比较均明显增高。HB组与NB组比,MIP2、KC、MCP1均有所降低,提示低氧暴露可使机体中性粒细胞和巨噬细胞趋化能力有所下调。NC组与HC组比,低氧暴露同样可以造成中性粒细胞趋化因子MIP2、KC和巨噬细胞趋化因子MCP1表达水平降低。
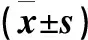
表6 用PCR法检测的脾脏中性粒细胞和巨噬细胞趋化因子结果
表7 用免疫印迹法检测的脾脏中性粒细胞和巨噬细胞趋化因子结果
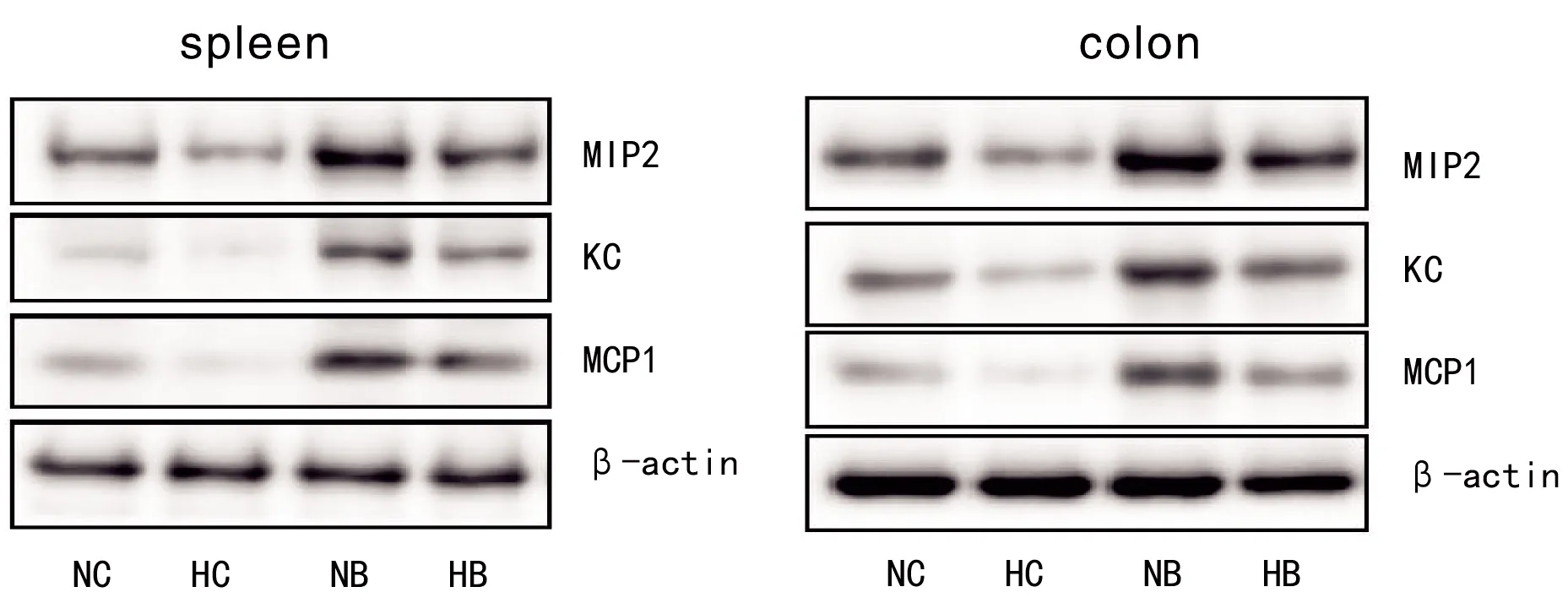
图6 各组小鼠脾脏及结肠组织细胞趋化因子图
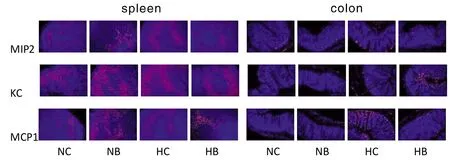
图7 脾脏及结肠组织细胞趋化因子免疫荧光染色检测图(merge重合信号图)
3 讨论
氧是一种环境刺激及发育信号,可以调节细胞的能量产生、生长和分化过程,并调控细胞的生物学表型性状。经过长期进化,生物体已形成一套完整的氧感受机制及在不同氧环境下的基因表达调控机制,对保障组织细胞的正常功能具有重要的作用[4]。低氧的一个重要的细胞代谢特征是低氧诱导因子的表达升高,其通过调控多种相关基因参与人体的生理和病理过程[5]。
3.1 低氧暴露对小鼠结肠炎的影响
IBD是一种特异性易复发的肠道炎症疾病,以结肠和直肠黏膜及黏膜下层的大量炎性细胞浸润为主要特征。临床的典型症状包括腹痛、腹泻和便血。目前,化学诱导、细菌感染、基因敲除的小鼠肠道炎症疾病模型已经广泛用于科学研究[6]。C.rodentium诱导的小鼠结肠炎模型病理特征类似于人类炎症性肠炎,主要症状包括结肠充血、直肠出血,水肿、腹泻,肠上皮屏障破坏、隐窝结构破坏、杯状细胞丢失,黏膜组织炎性细胞浸润[7]。这种模型可重复性好、成功率高,是目前主要应用于肠炎研究的模型。从本实验结果可以看出,常氧环境中被C.rodentium感染导致小肠长度缩短,低氧暴露下更为显著。低氧暴露可造成感染组小鼠结肠组织上皮损伤、糜烂,固有腺体排列紊乱,黏膜和黏膜下层可见大量炎性细胞浸润。
本研究成功建立由C.rodentium诱导的小鼠结肠炎模型,通过此模型研究发现低氧暴露可以加剧炎症性结肠炎的发生和发展。
3.2 低氧暴露对小鼠中性粒细胞的影响
中性粒细胞来源于骨髓,发挥非特异性免疫防疫作用并参与机体的免疫应答及炎症损伤。中性粒细胞依靠强大的氧化暴发能力产生破坏病原体的效应分子,包括氧自由基和氯衍生物[8]。此外,中性粒细胞吞噬体内的蛋白质水解酶活性较高。因此,与其他免疫细胞相比,中性粒细胞具有较强的抗原降解能力。在病原体入侵中性粒细胞的早期阶段,吞噬体膜上大量募集的NOX2使吞噬体内部pH水平变化,产生活性氧[9]。ROS是免疫细胞发挥吞噬和杀伤作用的主要介质。另外,吞噬体中的MPO可催化超氧化物转化为多种对微生物有降解和杀灭作用的分子,如次氯酸、氯、氯胺、羟基等[10]。最终中性粒细胞吞噬体内部的蛋白质水解酶活性增强,发挥较强的降解和杀灭病原体的能力。氧的不足导致中性粒细胞内部NOX2募集不足使活性氧产生不足,进而导致清除病原体能力下降。另外,本研究结果显示,低氧可造成中性粒细胞趋化性降低。中性粒细胞趋化性降低使得清除病原体的中性粒细胞参与率下降,造成小鼠结肠感染症状加重。
3.3 低氧暴露对小鼠巨噬细胞(MΦ)的影响
MΦ为肠道的主要吞噬细胞,与炎症性肠炎的发生、发展关系密切[11]。MΦ主要依靠形成吞噬体来清除病原体,吞噬体是胞吞过程中在被吞噬物质周围形成由细胞膜向细胞内凹陷而成的囊泡结构,是免疫过程中MΦ常见的亚细胞结构,其功能为杀灭和降解入侵机体的病原微生物,并对相关抗原进行加工提呈。Anne-Marie等[12]证明吞噬体在成熟过程中需与溶酶体融合,生成兼具隔离与分解异己物质能力的吞噬溶酶体。炎症性肠炎急性期肠黏膜中MΦ量明显增加,且表达相当数量的T细胞共刺激分子(CD40、CD80、CD86等)。同时,TLR2和TLR4表达上调,且共表达CD14、CD89和髓系细胞触发受体-1(TREM-1)[13]。TREM-1可触发促炎因子的合成与分泌,包括TNFα、IL-1β、IL-6和IL-8等,造成局部组织破坏。这与我们的研究结果一致。
MΦ吞噬功能的发挥主要依赖于吞噬体膜上V-ATPase的高效募集[14,15],进而迅速导致吞噬体内部pH水平变化,最终增强降解抗原和杀灭病原微生物的能力。MΦ细胞质膜上大量募集的NOX2 产生的ROS 可导致组织炎症[16]。病原体侵入MΦ的早期阶段,大量的V-ATPase募集到吞噬体膜上[17],导致吞噬体腔内迅速酸化。有研究发现,MΦ吞噬抗原后几分钟内,吞噬体内pH值下降[18]。迅速酸化的吞噬体结合腔内大量补充的溶酶体蛋白酶,形成有效降解和杀灭病原体的内环境。由此可见,MΦ主要通过募集V-ATPase促进吞噬体内部的酸化,激活强大的溶酶体蛋白质水解活性杀灭病原体并发生组织炎症。但是低氧环境可造成MΦ的趋化性降低,使机体清除病原体的功能减弱,病原体在体内大量聚集,造成较为严重的炎症损伤。
另外,MΦ的代谢特征以糖酵解为主,其促炎功能的发挥依赖于糖酵解通量的增加[19]。文献报道,LPS和IFN-γ诱导的MΦ糖酵解能力显著增强[20]。缺氧诱导因子(HIF-1)是一种异二聚体转录因子,对细胞适应氧气变化起到关键作用,HIF-1α作为HIF-1活性亚基是其发挥功能的主要部分[21]。HIF-1α靶基因非常广泛,其中包括多种糖酵解酶,如GLUT1等[22]。活化的MΦ可通过将其代谢途径转向糖酵解途径来适应炎症因子的刺激,低氧环境可以使HIF-1α显著上调[23],使活化的MΦ转向糖酵解途径来适应炎症反应。
近年来的研究显示,IBD的发病与固有免疫缺陷相关,它的发展与固有免疫系统所介导的炎症密切相关。肠道黏膜屏障的损伤、肠道菌群的紊乱、固有免疫细胞的失调、固有免疫相关分子和基因缺陷等均对IBD的发生、发展起到重要的作用。作为结肠固有免疫的重要组成角色,受低氧条件影响,中性粒细胞和MΦ所发挥功能与常氧条件下细胞功能有所差异。在低氧环境中,我们发现低氧暴露可以降低小鼠巨噬细胞及中性粒细胞的趋化性,导致小鼠固有免疫功能降低、感染症状和病理反应加重。
