黄芪甲苷介导核苷酸结合寡聚化结构域样受体蛋白-3改善雄性小鼠放射性心脏损伤※
2022-06-16郝彦惠
张 雨,郝彦惠,王 财,张 伟,陈 凡*
(1.青海大学医学院,青海 西宁 810001;2.青海大学附属医院,青海 西宁 810001)
射线照射在提高胸部肿瘤治疗疗效的同时,不可避免地引起放射性心脏损伤(Radiation-induced heart damage,RIHD),限制了临床肿瘤靶区的受照剂量。介导核苷酸结合寡聚化结构域样受体蛋白-3(nucleotide-binding oligomerization domain-like receptor protein-3,NLRP-3)炎症小体在改善心脏损伤中具有关键作用,但对放射性心脏损伤是否同样具有改善作用目前未见报道,尤其是用黄芪甲苷(Astragaloside IV,AS-IV)介导NLRP-3炎症小体改善小鼠放射性心脏损伤的研究尚属空白[1-2]。本课题就此开展相关研究。
1 材料与方法
1.1 实验动物
雄性C57BL/6J小鼠40只,7周龄,无特定病原体(specific pathogen free,SPF)级别,购于北京华阜康生物科技股份有限公司[许可证号:SCXK(京)2020-0004]。实验小鼠饲养于青海大学高原医学研究中心[许可证号:SYXK(青)2020-0001],采用普通光照,予正常饮水及足够的饲料适应性喂养7 d,于照射后第28天处死进行实验[3]。
1.2 实验试剂与仪器
黄芪甲苷(纯度>98%,货号:SA8640)、苏木素(货号:G1080)、伊红(货号:G1100)购自北京索莱宝有限公司。小鼠白介素-1β酶联免疫检测试剂盒(IL-1β,货号:E-EL-M0037c)和小鼠白介素-18酶联免疫检测试剂盒(IL-18,货号:E-EL-M0730c)购自武汉伊莱瑞特生物科技股份有限公司。NLRP3抗体(货号:A18281)、ASC抗体(货号:A2156)、Caspase-1抗体(货号:A0964)购自武汉爱博泰克生物公司。动物气体麻醉机购自英国ELGA公司。医用电子直线加速器(23EX)购自美国VaRian公司。离心机(5811)购自德国Eppendorf公司。iMark酶标仪购自美国BioRad公司。显微镜购自宁波舜宇仪器有限公司。
1.3 实验方法
1.3.1 实验动物分组
随机分为空白对照组、单纯照射组和AS-IV低剂量组(AS-IV-L)、AS-IV高剂量组(AS-IV-H)。
1.3.2 实验动物照射
小鼠用动物气体麻醉机进行麻醉后于治疗床上固定四肢,激光灯定位于心尖搏动部,源皮距100 cm,射野约为1.0 cm×1.0 cm。除空白对照组外,其余组均采用6MV 20Gy射线单次局部照射心脏。照射完成后将小鼠送置动物房继续饲养。
1.3.3 实验动物给药
AS-IV低剂量组(AS-IV-L)、AS-IV高剂量组(AS-IV-H)分别给予40、80 mg/kg AS-IV(灌胃),空白对照组、单纯照射组分别给予5 ml/kg生理盐水(灌胃)。每日1次,连续28 d。
1.3.4 实验动物心脏组织形态观察
将小鼠心脏组织固定、包埋、切片、脱蜡脱水、染色,镜下观察各组小鼠心脏组织形态的变化情况。
1.3.5 实验动物心脏组织中炎症因子白介素-1β(IL-1β)、18(IL-18)的水平检测
将小鼠心脏组织磨碎、离心、稀释,根据酶联免疫吸附法(ELISA)试剂盒说明书所示方法进行实验操作,在波长450 μm处测量吸光度值,计算浓度。
1.3.6 NOD样受体蛋白3(NLRP3)、凋亡相关斑点样蛋白(ASC)、半胱氨酸天冬氨酸特异性蛋白酶-1(Caspase-1)在实验动物心脏组织中的表达水平检测
使用蛋白印迹法(Western blotting,WB)。将心脏组织匀浆、离心、稀释、定量、上样、电泳、转膜、封闭,分别孵育一抗过夜,次日洗涤后孵育二抗,曝光,显影。
1.4 统计学方法
2 结果
2.1 各组小鼠心脏组织的形态学变化
空白对照组心肌细胞排列规则,血管结构完整清晰,血管内皮完整。AS-IV-H组心肌细胞排列规则,血管内皮结构欠清晰,较空白对照组病变略严重。AS-IV-L组心肌细胞排列规则,血管内皮结构较模糊,局部区域血管内皮细胞减少,少量内皮细胞溶解,较空白对照组和AS-IV-H组病变略有加重。单纯照射组血管内皮结构模糊,血管内皮不完整,内皮细胞明显缺失,周围少量心肌细胞溶解,心肌细胞出现不同程度的变形及断裂,病变程度较AS-IV-L组有加重。见图1。

图1 HE染色图(400×)
2.2 各组小鼠心脏组织中炎症因子IL-18、IL-1β表达水平
与空白对照组比较,AS-IV-H、AS-IV-L和单纯照射组IL-18、IL-1β的表达水平升高(P<0.05);与AS-IV-H组比较,AS-IV-L和单纯照射组IL-18、IL-1β的表达水平升高(P<0.05);与AS-IV-L组比较,单纯照射组IL-18、IL-1β的表达水平升高(P<0.05),差异具有统计学意义。见表1。
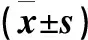
表1 IL-18、IL-1β表达水平
2.3 各组小鼠心脏组织中NLRP3、ASC、Caspase-1蛋白表达水平
与空白对照组比较,AS-IV-H、AS-IV-L和单纯照射组NLRP3蛋白表达水平升高(P<0.05)。与AS-IV-H组比较,AS-IV-L和单纯照射组NLRP3蛋白表达水平升高(P<0.05);与AS-IV-L组比较,单纯照射组NLRP3蛋白表达水平升高(P<0.05),差异具有统计学意义。见图2、表2。
A:空白对照组;B:AS-IV-H组;C:AS-IV-L组;D:单纯照射组
表2 NLRP3、ASC、Caspase-1在各组小鼠心脏组织中的表达水平
与空白对照组比较,AS-IV-L组ASC蛋白表达水平升高(P<0.05)。与AS-IV-H组比较,AS-IV-L和单纯照射组ASC蛋白表达水平升高(P<0.05),差异具有统计学意义。见图2、表2。
与空白对照组比较,AS-IV-H、AS-IV-L和单纯照射组Caspase-1蛋白表达水平上升(P<0.05)。与AS-IV-H组比较,AS-IV-L和单纯照射组Caspase-1蛋白表达水平升高(P<0.05),差异具有统计学意义。见图2、表2。
2.4 各组小鼠心脏组织中NLRP3、ASC、Caspase-1表达情况
小鼠心脏组织中NLRP3、ASC、Caspase-1蛋白表达在IHC图中表现为细胞内呈淡紫色着色。见图3~5。
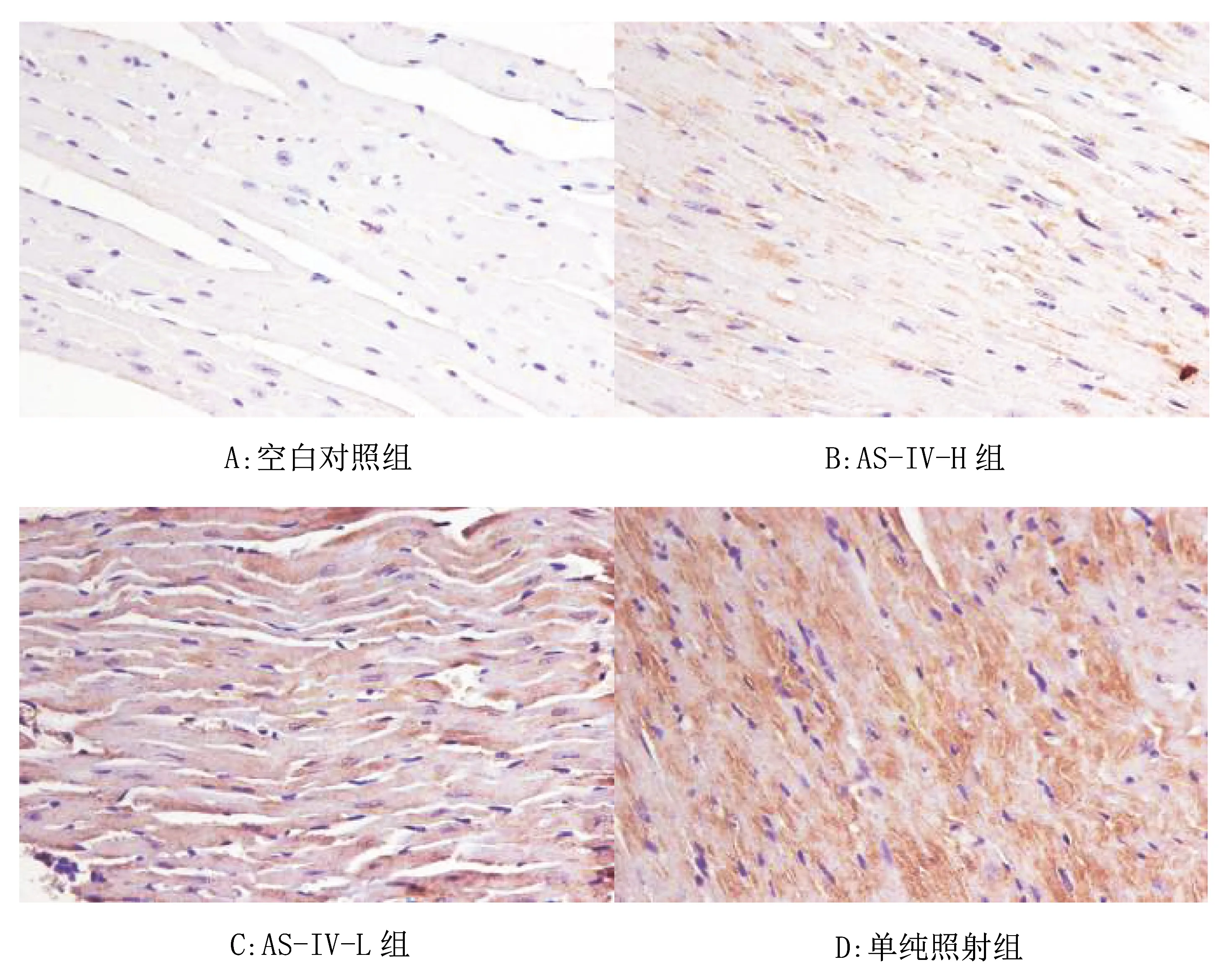
图3 各组小鼠心脏组织中NLRP3的表达图(400×)

图4 各组小鼠心脏组织中ASC的表达图(400×)
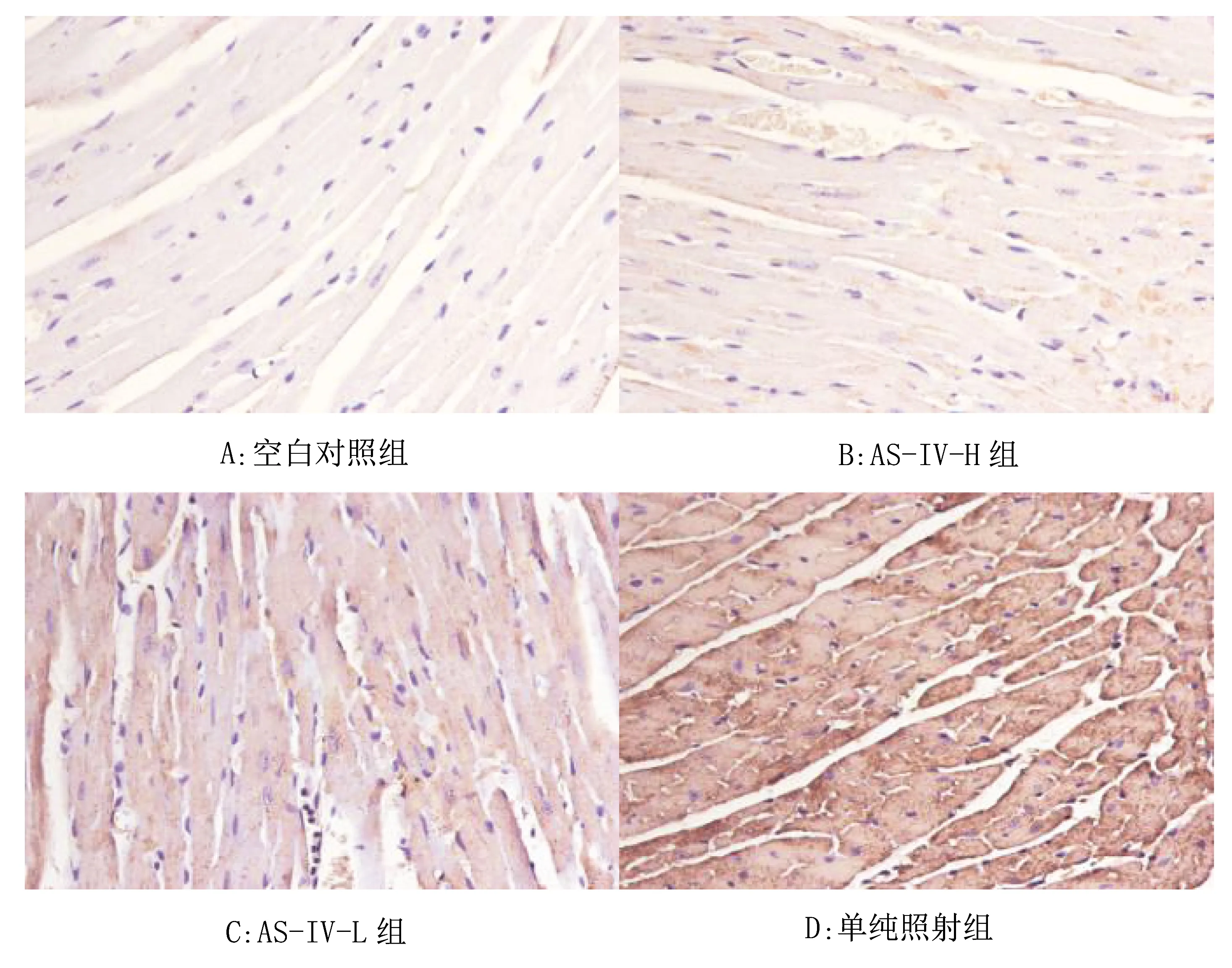
图5 各组小鼠心脏组织中Caspase-1的表达图(400×)
与空白对照组比较,AS-IV-H、AS-IV-L和单纯照射组NLRP3蛋白表达水平上升(P<0.05)。与AS-IV-H组比较,AS-IV-L和单纯照射组NLRP3蛋白表达水平上升(P<0.05)。与AS-IV-L比较,单纯照射组NLRP3蛋白表达水平升高(P<0.05),差异具有统计学意义。见表3。
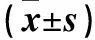
表3 NLRP3、ASC、Caspase-1表达情况
与空白对照组比较,AS-IV-H、AS-IV-L和单纯照射组ASC蛋白表达水平上升(P<0.05)。与AS-IV-H组比较,AS-IV-L和单纯照射组ASC表达水平上升(P<0.05)。与AS-IV-L组比较,单纯照射组ASC蛋白表达水平升高(P<0.05),差异具有统计学意义。见表3。
与空白对照组比较,AS-IV-H、AS-IV-L和单纯照射组Caspase-1蛋白表达水平明显上升(P<0.05)。与AS-IV-H组比较,AS-IV-L和单纯照射组Caspase-1蛋白表达水平上升(P<0.05)。与AS-IV-L组比较,单纯照射组Caspase-1蛋白表达水平增高(P<0.05),差异具有统计学意义。见表3。
3 讨论
NLRP-3炎症小体是炎症反应的主要参与者,被射线激活后分解为NLRP3、ASC、Caspase-1并使炎症因子IL-1β、IL-18释放,加剧炎症反应[4]。研究显示,AS-IV不仅能对抗心肌细胞损伤、缓解血管内皮细胞障碍、促进心血管生成,而且可降低NLRP-3在受损心脏组织中的表达[5-6]。Zhang T[6-7]等的实验表明,AS-IV可通过抑制NLRP-3炎症小体的表达来缓解机械应激引起的心脏损伤及辐射诱导的肾损伤。本研究建立在小鼠模型基础上,探讨AS-IV与小鼠RIHD中NLRP3的表达关系,为RIHD的临床防治提供基础实验依据。
NLRP-3是一种能够感知损伤并释放炎症因子的炎症小体,被激活后,接头蛋白ASC可将其中的NLRP3与Caspase-1蛋白前体连接起来,促使Caspase-1活化继而放大细胞的炎症反应[8]。Zhang WJ[8]等认为激活后的NLRP3可进一步促进细胞炎症反应且与缺血、损伤等心血管疾病密切相关。Smith AO[9-11]等认为被电离辐射等因素激活后的Caspase-1在短期内引起血管内皮细胞损伤后可诱导IL-1β、IL-18释放,最终引起细胞炎性死亡。本研究中,小鼠心脏组织切片镜下可见经射线照射后,单纯照射组小鼠心脏血管内皮结构模糊,内皮细胞坏死、溶解或缺失等,其病理改变较空白对照组和AS-IV-H、AS-IV-L组明显,AS-IV-L组中心肌细胞和血管内皮结构的病变程度较空白对照组和AS-IV-H组病变略有加重,提示AS-IV可缓解小鼠RIHD程度。本实验结果显示,NLRP3、ASC、Caspase-1蛋白在空白对照组和AS-IV-H组的表达活性明显低于单纯照射组及AS-IV-L组,表明在小鼠心脏模型中,AS-IV可减轻小鼠RIHD组织中NLRP-3炎症小体的表达。IHC结果显示,单纯照射组和AS-IV-L组较空白对照组及AS-IV-H组染色增重,单纯照射组染色重于AS-IV-L组,AS-IV-L组的淡紫色染色略重于AS-IV-H组,提示AS-IV可减少NLRP-3炎症小体的表达。
炎症因子IL-1β作为IL-1的主要分泌形式,在使免疫因子大量募集的同时,能够明显上调炎症反应水平[11-12]。Zeng ZL等[13]认为心血管病的发生与IL-1β的大量释放密切相关。炎症因子IL-18在促进细胞合成与分化的同时,能够明显上调炎症反应水平[11,14]。Sun W[15]的研究显示,IL-18作为一种高效促炎因子,其高表达可引起冠心病等心血管疾病。Liao H[16]等的实验结果显示,经射线辐射后的细胞内炎症因子IL-18的分泌水平增加,细胞活性降低。Mezzaroma E[17]等通过小鼠心脏实验表明,抑制NLRP3、ASC、Caspase-1、IL-1β、IL-18的表达可明显减轻心脏损伤。本实验ELISA结果显示,单纯照射组和AS-IV-L组中IL-1β、IL-18的表达量明显增加,AS-IV-L组的表达较空白对照组和AS-IV-H组略高,AS-IV-L组的表达低于单纯照射组的表达,提示IL-1β、IL-18参与了射线照射后心脏的损伤过程,并且AS-IV可减轻射线引起的这种心脏损伤。另外,本实验全程在青海西宁(海拔约2200m)进行,高海拔缺氧环境下细胞间炎性浸润程度加重[18],其对实验结果造成影响。
综上所述,AS-IV通过调控NLRP-3炎症小体的表达改善小鼠RIHD程度,AS-IV对射线诱导的小鼠心脏损伤有一定修复保护作用。
