胃癌中FKBP5的表达及其与免疫浸润和预后相关性研究
2022-06-16刘伟强
刘伟强,符 洋
(郑州大学第一附属医院胃肠外科,河南 郑州 450052)
胃癌是全世界范围内最常见的恶性肿瘤之一,也是最常见的恶性肿瘤死亡原因之一[1]。有研究报道胃癌发病率居我国恶性肿瘤第2位,死亡率居我国恶性肿瘤第3位。该病的主要危险因素包括幽门螺杆菌感染、年龄、高盐摄入量以及水果和蔬菜含量低的饮食[2]。尽管近些年靶向治疗对恶性肿瘤生物学和发展的理解方面取得了进展,但胃癌的治疗效果有限,患者的预后仍然较差。急需有效的生物标志物和治疗的靶点[3-4]。因此,进一步探索研究新的基因功能改变与胃癌发生、发展及其恶性特征的关系,对揭示其发生、发展的精确分子机制、设计合理的治疗药物及判断预后,进一步提高我国胃癌的治疗水平具有重要意义。
FKBP家族基因因其能够于FK506或雷帕霉素结合发挥免疫抑制作用而得名,是进化保守的亲免素家族的重要成员,在哺乳动物中普遍表达[5-6]。FKBP家族基因都含有一个或多个PPIase结构域,在生理或者病理情况下参与多种生物学过程,包括蛋白折叠、转录后调控、炎症反应、免疫应答、受体信号通路等[6-7]。近年来越来越的的证据表明FKBP 家族基因在恶性肿瘤的发生发展中起到不可忽视的作用[8-9]。FKBP5作为FKBP家族基因的一员,其在胃癌中的表达及临床意义尚不明确,本研究旨在分析FKBP5在胃癌中的表达,并利用生物信息学方法分析FKBP5与免疫浸润及患者预后的关系。
1 资料与方法
1.1 数据来源从UCSC Xena(http://xena.ucsc.edu/)网站下载人类肿瘤基因组图谱数据库(TCGA)中的包含完整预后信息的胃癌组织(408例)和癌旁正常组织样本(35例)的RNA表达数据并与临床信息(包括总生存时间、生存状态、T分期、病理分级等)进行匹配,预后信息及相关临床缺失的样本予以剔除。
1.2 TIMER数据库使用TIMER 2.0数据库中的检索功能评估FKBP5在TCGA不同肿瘤中的mRNA水平的表达情况;利用TIMER数据库评估胃癌中FKBP5 mRNA表达与6种免疫细胞浸润的相关性,计算出Spearman秩相关系数和P值并绘制散点图。根据免疫细胞浸润水平中位数将样本分为高、低组,应用Kaplan-Meier方法绘制生存曲线,log rank检验其对胃癌患者预后的影响。
1.3 GSEA分析从分子特征数据库(MSigDB)中下载 hallmark基因集(h.all.v7.2.symbols.gmt)和ontology基因集(c5.all.v7.4.symbols.gmt),使用clusterprofiler按照默认参数进行GSEA分析高、低表达FKBP5组的富集通路,计算出富集分数(ES)、P值和错误发现率(FDR),分析FKBP5潜在作用机制。FDRP<0.05定义为差异有统计学意义。使用gseaplot2绘制富集图。
1.4 KM plotter数据库使用KM plotter在线网站检索在GSE62254数据集283例带有完整预后信息的样本,按照FKBP5表达中位数将样本分为FKBP5高表达和低表达组,Kaplan-Meier方法绘制生存曲线,log rank检验其对胃癌患者预后的影响。根据分期筛选出Ⅱ期和Ⅲ期的样本,并在亚组中分析FKBP5对患者预后的影响。
1.5 免疫检查点基因相关性分析在TCGA胃癌数据集中,利用Pearson相关分析FKBP5与免疫检查点基因的表达相关性,其中P<0.05被认为差异有统计学意义。利用corrplot程序包绘制相关性热图,ggplot2绘制相关性散点图。
1.6 统计学处理采用R-4.0.3进行本研究的统计分析及作图。2组之间的差异分析使用Wilcoxon-Mann-WhitneyU检验,2组以上采用Kruskal-WallisH检验。在TCGA胃癌数据集中以FKBP5表达中位数分组用Kaplan-Meier法绘制生存曲线评估FKBP5高、低表达对患者总生存时间的影响,log rank检验进行统计学。limma程序包用来分析FKBP5高、低表达组样本的差异基因。检验水准α=0.05。
2 结果
2.1 FKBP5在泛癌中表达利用TIMER数据库检索FKBP5在TCGA数据库33种肿瘤样本的转录水平的表达,FKBP5在多形性胶质母细胞瘤、肝癌组织中表达上调,而在胆囊癌、乳腺癌、结肠癌、甲状腺癌、胃癌等癌组织中的表达低于癌旁组织(P<0.05)。见图1。

图1 FKBP5在33种人类肿瘤组织中的表达(1)P<0.05,2)P<0.01,3)P<0.001)
2.2 FKBP5在胃癌中表达进一步我们分析了FKBP5在胃癌不同亚组中的表达,发现FKBP5在肿瘤组织中表达下调,进一步我们分析FKBP5在不同组织学亚组中的表达差异。发现在较高的病理分级(G3)中FKBP5表达较高,FKBP5的表达随着T分期的增加而增高(P<0.05)。见图2。
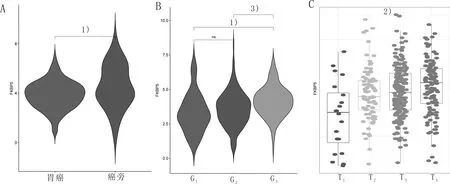
图2 FKBP5在不同胃组织中的表达(1)P<0.05,2)P<0.01,3)P<0.001)
2.3 FKBP5的表达与胃癌患者的预后相关在TCGA胃癌数据集中,将不同样本中FKBP5的表达按照中位数分为高表达和低表达2组,然后利用Kaplan-Meier绘制生存曲线,log rank 检验比较2组生存曲线的P值,FKBP5高表达组患者总生存率较差(P<0.05)。就不同分期而言,在Ⅱ期胃癌患者中FKBP5高表达与较差的预后相关,而在Ⅲ期胃癌中FKBP5 高表达的患者预后较差,虽然P>0.05,但2组之间的差异有一定趋势。然后我们利用KM plotter 网站检索在GSE62254数据集中进一步验证FKBP5表达对胃癌患者预后的影响,发现FKBP5高表达患者无论是在总体样本中还是在Ⅱ期或者Ⅲ期患者中均表现出较差的预后(HR>1.50,P<0.05)。见图3。
2.4 FKBP5在胃癌中富集通路分析在TCGA胃癌数据集中,分析FKBP5高、低表达2组的差异基因,将基因按照差异倍数(Log2FC)从高到低排序,利用GSEA分析,以GO基因集分析显示FKBP5高表达组富集的前5个基因集为吞噬识别、免疫球蛋白复合物、免疫球蛋白复合物循环、T细胞受体复合物、免疫球蛋白受体结合。以Hallmark基因集分析显示FKBP5高表达组与同种异体排斥、上皮间质转化、HEDGEHO信号、炎症反应、肌生成等信号通路相关(ES>1.50,P<0.05)。这些结果提示FKBP5在胃癌中的潜在作用机制。见图4。

图4 GSEA分析FKBP5在胃癌中富集通路分析
2.5 FKBP5与肿瘤免疫细胞浸润相关通过TIMER数据库分析FKBP5转录水平与胃癌中B细胞、CD4 T细胞、CD8 T细胞、巨噬细胞、中性粒细胞、树突状细胞6种免疫细胞浸润水平的相关性。发现FKBP5与CD4+ T细胞、CD8+ T细胞、巨噬细胞、中性粒细胞、树突状细胞的浸润呈正相关(cor>0.35,P<0.05),与肿瘤纯度呈负相关,与B细胞浸润水平无明显相关性(P>0.05)。在TCGA胃癌样本中,利用免疫浸润水平中位数分组,生存分析发现高巨噬细胞浸润与较差的预后相关(P<0.05),而其他几种免疫细胞浸润水平与患者预后无明显相关性。见图5。

图5 FKBP5在胃癌中免疫浸润的关系
2.6 FKBP5的表达与免疫检查点基因正相关利用Pearson相关分析评估FKBP5转录水平表达与一些经典的免疫检查点基因的相关性并绘制热图。FKBP5与大部分免疫检查点基因存在正相关(cor>0.45,P<0.05);散点图显示FKBP5与PDCD1(cor=0.43,P<0.05)、PDCD1LG2(cor=0.56,P<0.05)明显正相关。见图6。
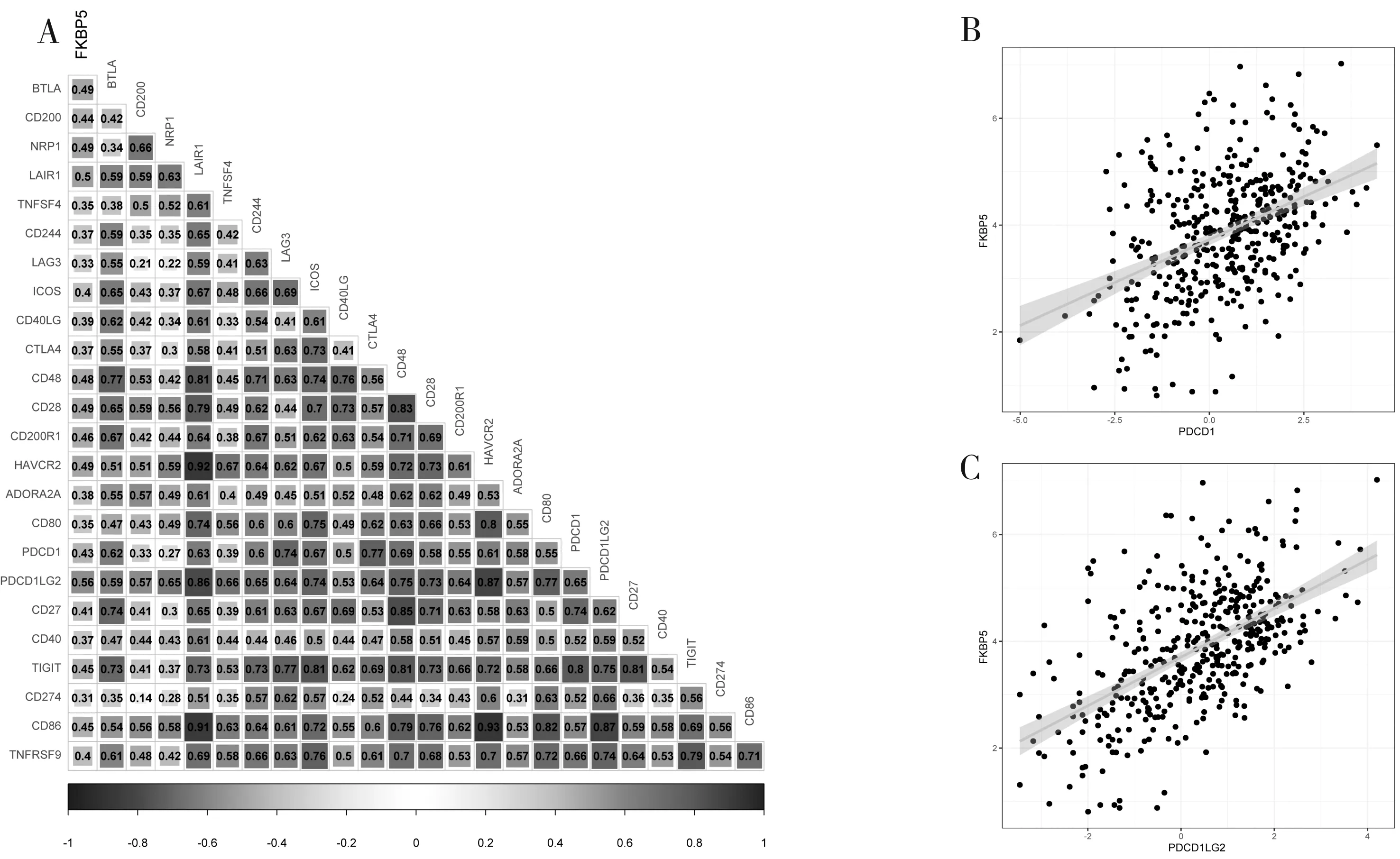
图6 FKBP5与免疫检查点基因的相关性
3 讨论
胃癌是一种发病率和死亡率都很高的恶性肿瘤。目前的分子检测学数据表明,胃癌并不是一个单一的、均质化的实体肿瘤,而是由具有不同生物学特性的几种胃癌分子亚型组成。比较经典的分型标准是1965年确立的Lauren分型,根据胃癌的组织结构和生物学行为分为:肠型和弥漫性[10]。而后随着测序技术和高通量数据分析技术的发展,有机会从分子水平进一步探究胃癌发生发展的机制。TCGA团队依据高质量、大规模的测序数据将胃癌分为:EBV病毒阳型、微卫星不稳定型、基因组稳定型、染色体不稳定型4种分子亚型[11]。与传统的组织学分型相比,分子分型在患者预后预测、个体化治疗方案确定、疗效评估等方面更具临床影响力。但是目前并没有一些针对胃癌的特异性分子被应用于临床。因此挖掘新的、有效的分子标志物对胃癌的诊断、预后评估及治疗具有重要意义。
FKBP5是一种编码蛋白质的基因,作为进化保守的亲免素家族的一员,其蛋白序列中含有两个PPIase结构域和3个重复的TPR结构域,这些结构域对于其行使功能具有重要作用[12]。例如,FKBP5通过与热休克蛋白Hsp90/Hsp70结合成复合体进而调节糖皮质激素受体功能[13]。既往研究[14-15]表明,FKBP5的表达失调或表观遗传学的改变会导致炎症、心血管疾病、精神疾病的发生、发展。近年来越来越的研究[16-18]发现FKBP5的失调与甲状腺癌、恶性胶质瘤、黑色素瘤等的发生和生存预后显著相关。
本研究利用生物信息学发现FKBP5在多种肿瘤组织中的普遍失调,其中在胃癌肿瘤组织中下调,同时FKBP5 在不同T分期和组织学分级中的表达也存在异质性,FKBP5在高T分期(T4、T3)中的表达更高,在高组织学分级(G3)中表达更高,这些结果表明FKBP5 可能在胃癌的发生、发展中起到重要作用。同时我们分别在TCGA的测序数据和GSE62254芯片数据中发现FKBP5高表达的患者总生存时间更短,预后更差,且这种差异独立于不同的病理分期。表明FKBP5有望成为胃癌潜在的生物标志物及治疗靶点。GSEA富集分析发现FKBP5主要与同种异体排斥、上皮间质转化、HEDGEHO 信号、炎症反应等通路相关。上皮间质转化是指上皮细胞与其周围的细胞分离并获得间质迁移特性的过程。目前普遍认为上皮间质转化在恶性肿瘤迁移、侵袭和远处转移的具有重要作用[19]。因此,我们推测FKBP5可能通过激活上皮间质转化、炎症反应等信号促进胃癌的侵袭和转移,但其潜在机制仍需要深入研究。
肿瘤微环境由各种免疫细胞、炎症细胞、间质细胞、血管、淋巴管及细胞外基质组成[20]。近年来靶向肿瘤微环境的研究成为热点。肿瘤中不同比例的免疫细胞能够与肿瘤细胞相互作用,从而发挥抗肿瘤或者促进肿瘤发生发展的作用。作为肿瘤中免疫浸润细胞的组成部分,巨噬细胞在肿瘤的发生、发展及免疫治疗耐药等方面具有重要作用。例如,M2巨噬细胞受到Th2细胞因子激活并表现出促进组织重塑和肿瘤进展的功能[21]。本研究的数据表明,在胃癌中微环境中巨噬细胞比例增多与不良预后明显相关,相关性分析显示FKBP5 mRNA的表达与巨噬细胞浸润、CD4+ T细胞浸润、中性粒细胞浸润、树突状细胞浸润明显正相关,提示FKBP5可能参与免疫微环境的调节。有研究[22]发现FKBP51s可以作为黑色素瘤患者免疫治疗效果的预测因子。D’Arrigo等[23]发现FKBP51s通过催化随后糖基化所需的蛋白质折叠上调质膜上的PD-L1表达。因此我们进一步分析FKBP5的表达与一些公认的免疫检查点基因的表达的相关性,发现FKBP5与这些免疫相关基因明显正相关。目前以程序性死亡受体1、PD-L1为靶点的药物已经被批准用于部分肿瘤的免疫治疗。我们的数据表明FKBP5可能参与胃癌中的免疫调节,从而促进肿瘤的进展及免疫逃逸,因此靶向FKBP5可能通过调节免疫微环境,从而提高免疫治疗效果。
综上所述,本研究利用生物信息学方法系统的发现FKBP5在胃癌较高的病理分级和T分期中表达较高,且高表达与预后不良相关。FKBP5高表达与巨噬细胞等免疫浸润水平正相关,同时参与上皮间质转化等致癌相关通路,有望成为胃癌预后生物标志物和治疗的新靶点。
