三叶木通体细胞胚胎发生及植株再生研究
2022-06-16姜治国李友志杨敬元陈发菊
姜治国 马 鑫 胡 胜 李友志 杨敬元 陈发菊
(1.神农架国家公园管理局,神农架金丝猴保育生物学湖北省重点实验室,湖北 神农架 442421;2.三峡大学,三峡地区珍稀植物遗传发育与种质创新重点实验室,湖北 宜昌 443002)
三叶木通(Akebia trifoliate)为木通科(Lardizabalaceae)木通属半落叶木质藤本果树,木通科植物多为寡种属或单种属,其中木通属有4 种,三叶木通是该属中唯一的小叶为3 的进化支系[1−2]。三叶木通全株可入药,根及藤茎入药具有补虚、止咳、清热利尿、通经活络、镇痛、排脓、通乳等功效[3];其果实入药能疏肝理气、活血止痛、调息通脉。同时三叶木通全株蛋白质、黄酮类、油脂、氨基酸、多糖、酚类、维生素、矿质元素、甾类含量丰富,具有抗氧化功能,能够提高人体抗病能力、延缓衰老、抗炎防癌[4−5]。除鲜食外,其果实深加工,可酿制出酒、果汁、果脯、果冻和茶等食品[6]。三叶木通集药用、食用、经济、观赏等价值于一体,且具有较强的生态适应性,应用前景广阔[7−8]。但由于三叶木通自然状态下结实率及发芽率偏低导致生产用三叶木通资源供不应求,因此,快速有效扩繁三叶木通,显得十分必要。
体细胞胚具有遗传特性相对稳定、数量多、速度快、结构完整、再生率高等优点[9],是遗传转化的理想受体,同时也是制备人工种子、原生质体的基础,体胚可长期保存,利于种质资源的保存。间接体胚发生过程的无性系变异利于突变体的选择,该途径繁殖效率高,一块愈伤组织可以产生几十个成熟的体细胞胚,取材范围也更广泛[10]。植物体细胞胚胎发生是一个复杂的生理过程,影响因素众多,基因型和外植体类型是影响植物体细胞胚胎发生的重要内部因素,不同的基因型和外植体类型,在诱导体细胞胚胎的难易程度及频率上会有差别[11−14]。木本植物的体胚发生常选取种子和未成熟合子胚作为材料,因为这类细胞全能性高,分化程度低,脱分化相较于其他组织容易[15]。植物生长调节剂是体细胞胚胎发生的重要调节物质,植物生长调节剂的种类、浓度及配比对体细胞胚的诱导、分化都会产生重要的影响,是细胞状态和质量的重要调控因素[16]。植物生长调节剂,有时单一使用,也可组合使用,作用效果因材料不同而有所差异。常见的组合有细胞分裂素和生长素,二者配比不同,诱导作用不同[17−19]。
我国对木通属植物的研究主要集中在药用成分提取[20−22]方面,组织培养的研究起步较晚。吴玲利[23]对木通属白木通(A.trifoliatevar.australis)进行组织培养研究,以白木通的带芽茎段培养分别得出,腋芽诱导、增殖的最适宜培养基及培养条件,同时得到再生植株;以白木通种胚为试材进行沙藏萌发,得出种胚成苗最适培养条件,建立了组织培养再生体系。近年来,木通属植物尤其是药用三叶木通供不应求,随着野生资源的不断消耗,三叶木通组织培养[24]、多倍体诱变育种[25]、苗木繁殖[26]等人工繁殖的研究逐渐增多,丰富了三叶木通资源的开发利用途径。苏慧慧等[27]用三叶木通试管苗的下胚轴为材料,研究发现下胚轴愈伤组织的诱导分化与植物生长调节剂配比、不同抗褐化剂及光照时间等因素都有关系,其中在培养基中同时加入适宜浓度的 2,4−D和 NAA 时,愈伤组织诱导率高达 96.5 %。有研究表明[28],以三叶木通未成熟合子胚为材料在不含植物生长调节剂的MS 培养基直接诱导出体细胞胚,诱导率为52.5 %,体细胞胚数平均达19.5个,且在原生胚胎上以较高频率(95.8 %)出现次生胚胎,在1/2 MS 中添加0.5 mg/L 6−BA 可显著提高体细胞胚转化为植株的概率,这一研究建立了三叶木通体胚直接发生体系,而间接发生体系还未见报道。贾明良等[29]以三叶木通幼嫩枝条为外植体,得出愈伤组织诱导的最佳培养基为MS+NAA 0.4 mg/L+2,4−D 4 mg/L+活性炭1 g/L,诱导率为92 %,愈伤组织诱导胚状体的最佳培养基为MS+NAA 0.4 mg/L+6−BA 2.0 mg/L,最高诱导率为15.33 %,然后接种至无激素的MS 培养基中,可得到种苗,但未见生根。由于木通科植物生长区域限制,国外对于木通科木通属植物再生培养鲜少报道。我国对三叶木通组织培养方面的报道从2006 年后逐渐增多,但缺乏体胚发生及再生培养方面的报道,并未有建立高效率的体胚发生体系。本试验以期通过间接方式建立三叶木通体细胞胚胎发生及植株再生体系,为建立三叶木通的遗传改良体系提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
试验材料采自神农架林区官门山木鱼山庄处野生三叶木通,果实每年8—9 月成熟开裂,于2019 年8 月中旬摘取成熟果实,此时种胚(合子胚)未完全成熟。采摘当天带回实验室,扒开果实挑出种子,搓洗干净放置在4 ℃冰箱中备用。
1.1.2 试验试剂及仪器
MS 盐M519−50L(湖北泽川科技有限公司),2,4−二氯苯氧乙酸(2,4−D),α-萘乙酸(NAA),6−苄基嘌呤(6−BA),激动素(KT),活性炭(AC),植物组培抗菌剂(PPM),蔗糖,琼脂等。
高压蒸汽灭菌锅HVE−50 日本HRAY AMA制造公司,超净工作台SW−CJ−2E(上海博讯实业有限公司),电子分析天平BSA323S(赛多利斯科学仪器北京有限公司),pH 计PHS25 型/3C型(上海越平科学仪器制造有限公司),50、100、500、1 000 mL 容量瓶,100、200、1 000、5 000 μL移液枪,90 mm 培养皿,镊子,手术刀。
1.2 试验方法
1.2.1 培养基配制
以MS 为基本培养基,添加不同浓度植物生长调节剂(2,4−D、6−BA、NAA、KT 等),蔗糖30 g/L,pH 调至5.8,琼脂7 g/L,分装至培养皿/瓶中,放入高压蒸汽灭菌锅中121 ℃,0.1 Mpa 条件下灭菌20 min,待其冷却凝固后备用。
1.2.2 外植体灭菌
将三叶木通种子用洗洁精水没过浸泡 5 min,在流水下冲洗 20 min,晾干后装入锥形瓶转入超净工作台进行灭菌,倒入75 %乙醇摇晃洗涤30 s,无菌水清洗 2 次,再用0.1 % HgCl2(升汞)溶液进行灭菌处理,处理时间梯度设置为10、12、15、18、20 min,无菌水清洗6 次以洗净升汞残留,最后置于无菌瓶中待用。随后无菌外植体接入培养基中培养观察,待15 d 后记录污染、褐化等生长情况。考虑到外植体污染情况,另外在培养基中0.05 % 的PPM,可有效抑制组织培养过程中的微生物污染及内源性污染[30],而不影响外植体诱导愈伤组织。PPM 只在初次诱导愈伤组织的培养基中使用,后面的试验过程中均不添加。
1.2.3 愈伤组织诱导及诱导率测定
用接种刀将灭菌消毒好的种子沿背腹线纵切开,解剖针挑出幼胚,然后接种到MS 添加植物生长调节剂2,4−D(1.0、2.0、4.0 mg/L),NAA(0.2、0.5、1.0 mg/L),6−BA(0.2、0.5、1.0 mg/L),KT(0.2、0.5、1.0 mg/L)以及蔗糖 30 g/L、琼脂7 g/L,pH 为 5.8 培养基中诱导愈伤组织,以不添加植物植物生长调节剂的MS 作对照。为有效预防控制外植体污染,在培养基中0.05 % 的PPM,PPM 用于植物组织培养中植物的微生物污染防治与清除。每个处理接种4 个培养皿,每皿15个种胚。放于温度 (25 ± 2)℃ ,黑暗条件下培养。
1.2.4 体细胞胚胎诱导及诱导率测定
待初代愈伤生长状态稳定后,接种至含有不同浓度的NAA(0.1、0.2 mg/L)和6−BA(0.2、0.5、1.0 mg/L)组合的培养基中,置于光照强度为2 000 lx,光照周期16/8 h,温度 (25 ± 2)℃条件下继续培养,30~40 d 继代1 次。继代时去掉愈伤组织上分化出的不定根及褐化坏死的部分,将体积较大的愈伤切分成大小均匀的愈伤组织块,切口朝下放置培养基上。培养过程中观察记录愈伤组织的生长变化。
1.2.5 体胚继代培养
在愈伤组织继代培养过程中选取生长状况良好的胚性愈伤组织接种到一起,待胚性愈伤组织分化形成体细胞胚胎后将体胚转移至含有不同浓度的6−BA(0.1、0.2 mg/L)和 NAA(0.05、0.1 mg/L)及不同添加物(香蕉泥、土豆泥、水解酪蛋白)的MS 继代培养基上,每个培养瓶中接种8 块体胚,35 ~ 40 d 继代1 次,观察并记录体胚生长状况。
1.2.6 植株再生
选取长势良好、有分化趋势或已分化的体胚再生苗,转移至MS 培养基中每瓶接种6 块体胚再生苗,(25 ± 2)℃下光照培养,光照时间12 h/d,光照强度 2 000 lx,观察并记录其生长状况,待其分化形成完整植株后,在湿度为70 % ~ 80 %的人工光照培养箱中炼苗3~5 d,移栽到灭菌过的泥炭土:蛭石:珍珠岩体积比为 2∶1∶1 的基质中进一步生长。
1.2.7 数据处理与分析

用Microsoft Excel 2010 和SPSS 23.0 软件对实验数据进行处理分析。
2 结果与分析
2.1 不同灭菌条件对外植体的影响
三叶木通种子灭菌处理后剥胚接种培养,污染及褐化情况见表1。由表1 可知,升汞灭菌10 min时,污染率最严重为100 %,随着灭菌时间增长,污染率逐渐降低,而褐化情况则随之严重,升汞有效杀菌的同时对植物外植体的毒害作用较大,因此灭菌时间不宜过长。当升汞灭菌时间为18 min 时,污染及褐化情况较轻,但污染情况虽降低,外植体污染量仍然影响到后续的愈伤诱导。在培养基中添加低浓度的植物抗菌剂之后有效控制住污染情况。综合得出,三叶木通种子合适的灭菌处理方式为先用0.1 % HgCl2溶液灭菌18 min,无菌水冲洗干净后接种在添加了0.05 %PPM 的愈伤诱导培养基上,有效控制污染情况,只有极少数污染现象。

表1 灭菌时间对外植体的影响Table 1 Influence of sterilization time on external implants
2.2 不同植物生长调节剂及浓度对三叶木通幼胚诱导愈伤组织的影响
种胚在接种5 d 时开始启动,10 d 时如图1c所示,此时颜色呈浅黄色,随后逐渐膨大愈伤化,培养至40 d 时体积明显增大,完全形成愈伤组织,如图1d 所示,颜色呈暗黄色、黄褐色居多。在诱导初代愈伤的培养基中添加0.05 % 的植物组织培养抗菌保护剂PPM 有效控制了污染率,这在一定程度上提高了诱导出愈伤组织的效率。

图1 三叶木通幼胚诱导的愈伤组织Fig.1 Callus induced from immature embryos of A.trifoliate
外植体诱导愈伤组织的实验结果见表2。由表2 可知,不同培养基中,愈伤组织的形态及诱导率有较大差异。外植体在不添加植物生长调节剂的MS 培养基中未长出愈伤组织。在愈伤组织诱导阶段,2,4−D 的作用是促进外植体脱分化,当2,4−D 浓度为1 mg/L 和4 mg/L 时,愈伤诱导率差异不显著,而2,4−D 浓度为2 mg/L 时,愈伤诱导率普遍较高。
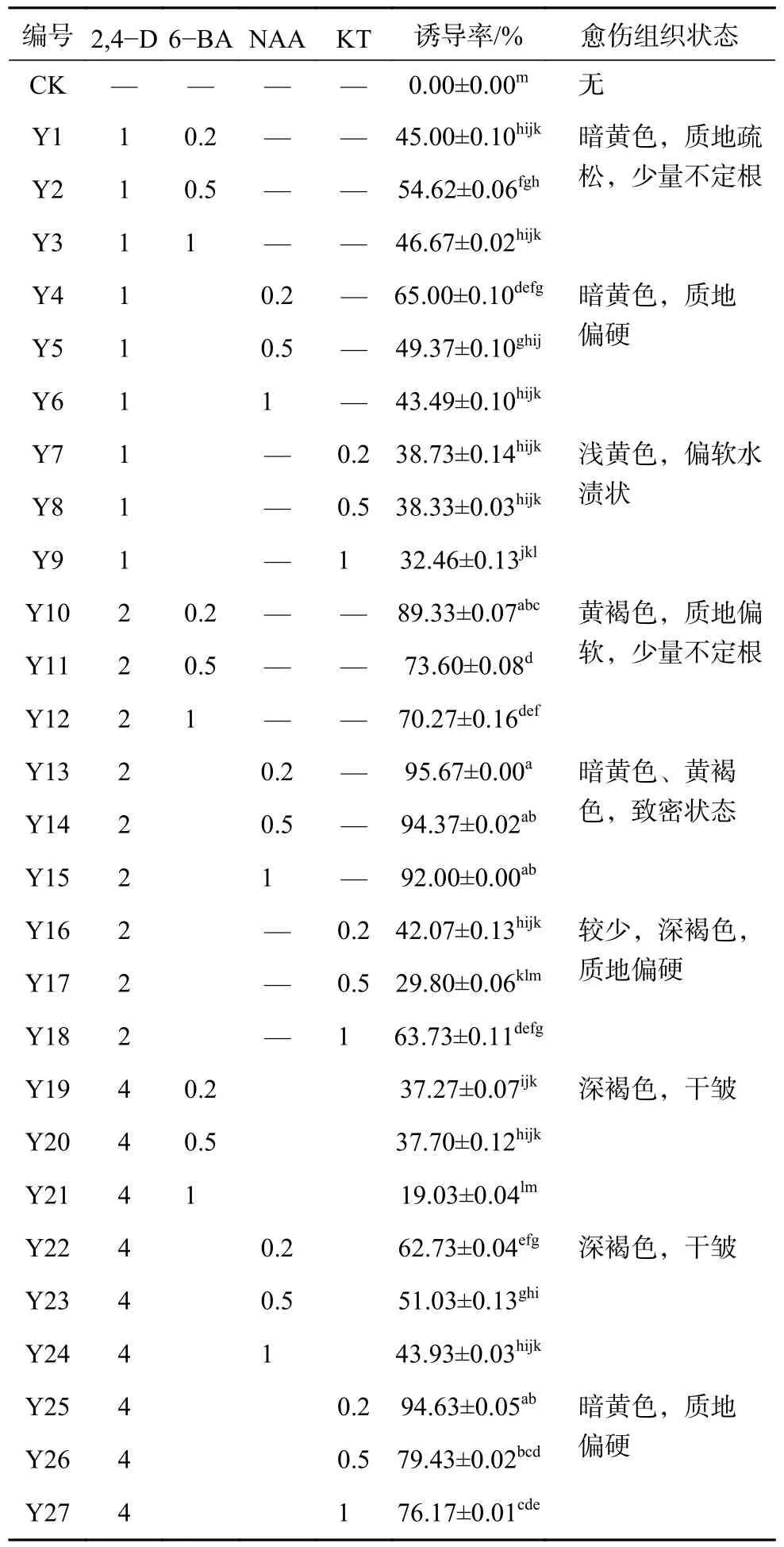
表2 不同培养基对愈伤组织诱导的影响Table 2 Influence of different medium on callus induction mg/L
在2,4−D 与6−BA 的组合中,随着6−BA 浓度的变化,愈伤诱导率未出现规律性变化,且差异不显著,愈伤组织状态多为黄褐色、深褐色,质地疏松;在2,4−D 与NAA 的组合中,愈伤诱导率整体较其他处理高,其中当2,4−D 为2 mg/L,NAA 为0.2 mg/L 时诱导率最高,为95.67 %,这一组愈伤组织多呈现暗黄色、黄褐色,结构较为致密,当2,4−D 浓度一定时,随着NAA 浓度的升高,愈伤诱导率呈下降趋势,但差异不显著,且含有NAA 的培养基中,愈伤组织表面产生少量不定根;在2,4−D 与KT 的组合中,愈伤诱导率随2,4−D 浓度的提高呈上升趋势,KT 浓度的变化对愈伤诱导率的影响不显著,愈伤组织的状态多为黄褐色、深褐色,质地偏硬。由此可知,适宜浓度的2,4−D 和NAA 可促进三叶木通幼胚诱导愈伤组织。从数据统计及处理结果来看Y14、15、25 与Y13 并未有显著差异,针对这一情况持续观察发现Y14、15 愈伤表面产生较多不定根,后期愈伤状态没有Y13 中好,Y25 中出现愈伤褐化死掉的现象,但Y13 中则没有这一情况。结合愈伤诱导率和愈伤组织形态及后续得生长状况来看,MS 添加2,4−D 2 mg/L,NAA 0.2 mg/L 是最适合愈伤组织诱导的培养基。
2.3 不同植物生长调节剂及浓度对体细胞胚诱导的影响
愈伤组织在继代培养初期,颜色及状态如图1e和f 所示,大部分呈现褐色、深褐色致密状态,去掉2,4−D,放置光照条件下培养继代1~2 次后部分愈伤组织颜色转变为乳白色、黄绿色、绿色此为非胚性愈伤组织,表面呈水渍状或稀软不成型如图2a 所示;胚性愈伤组织多为暗黄褐色、深褐色致密状态,如图2b 所示,可诱导分化形成体细胞胚,如图2c 所示。但也有部分胚性愈伤组织未诱导出体胚,逐渐褐化、死掉。

图2 愈伤组织继代及体胚诱导Fig.2 Callus subgeneration and somatic embryo induction
NAA 和6−BA 对体细胞胚胎诱导的影响见表3。由表3 可知,在培养过程中,胚性愈伤组织状态维持30d 左右分化形成体细胞胚胎,低浓度时体胚诱导率较高。当NAA 浓度为0.1 mg/L,6−BA 浓度为0.2 mg/L 时,诱导率最高为55 %,该组处理与其他处理得出的诱导率有显著性差异。
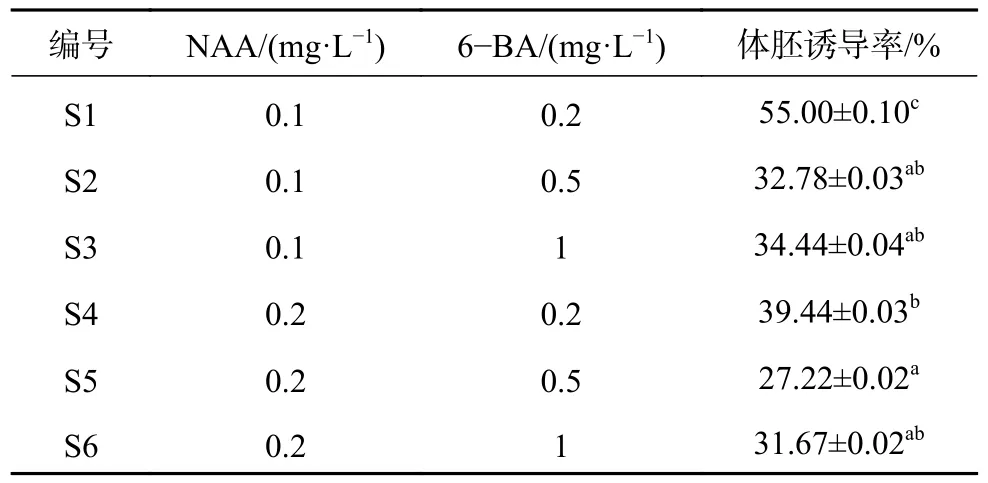
表3 不同培养基对体胚诱导的影响Table 3 Effects of different media on somatic embryo induction
2.4 不同植物生长调节剂、浓度及添加物对次生胚增殖的影响
继代过程中体胚远离培养基的上端生长分化,贴近培养基的部分发生次生胚且不断增多,处于边分化边增殖次生胚的状态,多数体胚形态正常,有少数畸形胚,逐渐分化后形态也是畸形的。但随继代次数增多体胚逐渐分化,次生胚增殖活力变弱。体细胞胚胎继代培养的结果见表4。由表4 可知,低浓度的NAA、6−BA 添加量有助于次生胚增殖,增殖倍数随着6−BA、NAA 浓度的降低有所升高。含外源添加物5 %土豆泥的培养基中次生胚增殖倍数略高于添加5 %香蕉泥和添加5 % 水解酪蛋白的处理,但香蕉泥、土豆泥、水解酪蛋白的加入对三叶木通次生胚增殖有轻微的抑制作用。当6−BA 浓度为0.1 mg/L,NAA 浓度为0.05 mg/L 时,次生胚增殖倍数最高,为19.84,该组处理与其他处理间存在显著性差异。
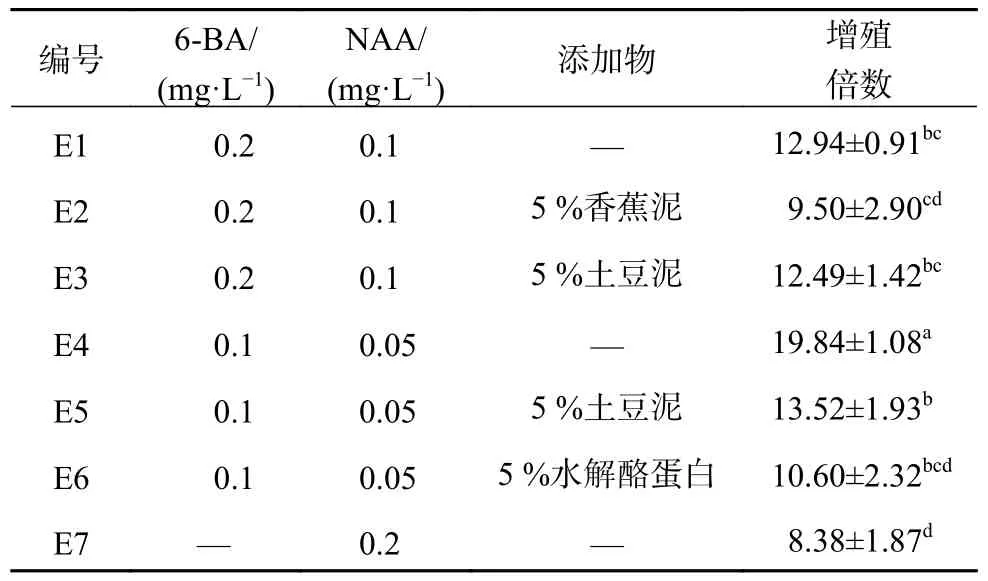
表4 不同植物生长调节剂、浓度及添加物对体胚继代的影响Table 4 Effects of different hormones,concentrations and additives on somatic embryos subculture
2.5 植株再生
成熟的体胚分化后大部分停留在图3a 状态,成苗率及再生苗生根率较低,已生根的再生苗转入MS 中可稳定生长。再生苗株高、叶片明显长大,相当于起到壮苗作用。待再生苗根长至3~5 cm左右,放置人工气候箱中炼苗3~5 d 后转入V(泥炭土)∶V(蛭石)∶V(珍珠岩)为2∶1∶1 的基质中,再生植株的形态正常,并能稳定成活。

图3 体胚分化及植株再生Fig.3 Somatic embryo differentiation and plant regeneration
3 结论与讨论
获得无菌且具有生长活性的外植体是组织培养取得成功的重要因素,植物组培常用的灭菌剂是0.1 % HgCl2溶液,能有效杀灭外植体表面的细菌与真菌,它同时有较强的毒害作用,使用过度会造成外植体严重损伤,需把握灭菌时间。本试验外植体灭菌后培养污染现象较为严重,尤其是霉菌污染。造成污染的可能因素有培养环境空气较为湿润,操作不当,在探索出较为合适的升汞灭菌时间,明显改善污染率后,污染现象仍存在,污染率依旧较高,分析原因可能是种子内部存在内生菌。本试验三叶木通种子最佳灭菌处理方式是75 % 乙醇消毒30 s,再用0.1 % HgCl2溶液消毒18 min,培养基中添加0.05 % 的PPM 有效控制了污染率,升汞灭菌时间的合理把握以及PPM 的添加将污染现象控制在了极少数范围内,使得诱导愈伤组织时污染率非常低。
本试验以三叶木通幼胚为外植体时诱导出胚性愈伤组织,继而诱导体细胞胚胎间接发生,且在愈伤组织诱导阶段,外植体直接接种在不添加植物生长调节剂的MS 基础培养基中无法长出愈伤组织,直接成苗,而Zou 等[28]的研究中以三叶木通未成熟合子胚在不含植物生长调节剂的MS 则是直接诱导了体细胞胚胎发生,这一不同结果可能是二者所用材料的取样时期、材料所处的地点海拔等环境因素、基因型等造成,外植体生理状态不同内源激素水平则不同。本试验三叶木通愈伤组织的形成需要植物生长调节剂的刺激诱导。李前[31]研究蒙古栎(Quercus mongolica)体细胞胚胎发生时,利用未成熟合子胚诱导愈伤组织得出的最佳培养基为MS 培养基,不需添加植物生长调节剂。2,4−D 作为生长素类似物,有助于促进外植体脱分化形成愈伤组织[32]。在本试验2,4−D 对三叶木通幼胚诱导愈伤组织也是必需因素,当浓度适宜时可得到较高诱导率,浓度过高或过低诱导率都偏低。水稻成熟胚诱导愈伤组织的研究中得出,当培养基中添加2,4−D 浓度为2 mg/L 时,愈伤诱导率最高[33],这与本试验中愈伤组织诱导率最佳时添加的的2,4−D 浓度一致。6−BA 的作用主要是促进细胞分裂,芽和愈伤形成。Lei 等[34]在研究植物生长调节剂对山茱萸(Cornus officinalis)愈伤组织和不定芽诱导的影响中发现,低浓度6−BA 有助于形成松散型愈伤组织,本试验添加6−BA 的处理中形成的愈伤组织状态较为疏松。2,4−D 和 NAA 组合(2.0 mg/L和0.2 mg/L)对三叶木通幼胚诱导愈伤组织较好。
在组织培养中,细胞分裂素和生长素的比例影响着植物器官分化,二者常以组合形式添加影响某一生长过程。周婵[35]在优化香樟胚性愈伤组织诱导、增殖体系的试验中以6−BA 与2,4−D 的不同配比得出分别适宜香樟(Cinnamomum camphora)胚性愈伤诱导、增殖,体胚诱导的培养条件。本试验愈伤诱导阶段,2,4−D 和NAA 的组合与2,4−D 与6−BA 的组合均能得到较高的愈伤诱导率结果,前者略高于后者,2,4−D 和KT 的组合则明显低于前两种组合,当2,4−D 浓度一定时,添加KT 的处理同样低于添加6−BA、NAA 的处理,三叶木通幼胚诱导愈伤时,6−BA、NAA 的效果优于KT。本试验愈伤诱导最佳组合是2,4−D 2 mg/L,NAA 0.2 mg/L,这与苏慧慧等[27]研究三叶木通试管苗下胚轴诱导愈伤的最适培养基一致,其愈伤组织诱导率略高于本试验,但未诱导出体胚,且后期愈伤分化并未得到生根幼苗。在诱导体细胞胚时,通常去除2,4−D辅以少量其他植物生长调节剂[36],本试验适宜浓度的 6−BA 和NAA(0.2 mg/L 和0.1 mg/L)能够诱导体胚发生;低浓度的6−BA 和 NAA(0.1 mg/L 和 0.05 mg/L)可促进次生胚增殖;分化的体胚在MS 中可直接再生成完整植株。
外源有机添加物在组织培养中一直有广泛应用,例如香蕉、土豆、苹果、椰汁、蛋白胨等,其中含有丰富的氨基酸、植物生长调节剂等复杂成分,可为植物某一生长过程提供特定的营养成分及生理活性物质,但具体何种成分如何影响有待进一步探索[37]。马生健等[38]在对卡特兰(Cattleya hybrida)组织培养研究中添加椰汁、香蕉泥、马铃薯、水解酪蛋白、苹果汁、椰乳,发现这6 种有机添加物对卡特兰原球茎增殖均有促进作用,其中添加15 %椰乳增殖效率最佳,分化率最低。本研究在体细胞胚胎继代培养过程添加香蕉泥、土豆泥、水解酪蛋白这几种有机添加物,对次生胚增殖并未有促进作用,在相同条件下添加香蕉泥、土豆泥反而起到一定程度的抑制作用,这可能与其复杂的成分和含量不稳定有关,说明在三叶木通次生胚生长增殖培养中不适合添加香蕉泥、土豆泥、水解酪蛋白这几种添加物。
综上所述,本试验通过间接方式建立了三叶木通体细胞胚胎发生及植株再生体系,但体细胞胚随继代次数增多逐渐分化,次生胚增殖活力也减弱,若能通过外源添加物或其他外在胁迫使体胚一直保持增殖活力或更长的继代次数,将会增加该体系的效率,另一方面体胚虽能再生出完整植株,但再生率及生根率都较低,因此有待进一步优化探索。
