花榈木人工种子胶囊制作及其萌发效果研究
2022-06-16吴高殷韦小丽
吴高殷 韦小丽 王 晓 桂 平
(1.贵州大学林学院,贵州 贵阳 550025;2.贵州省森林资源与环境研究中心,贵州 贵阳 550025;3.贵州师范大学生命科学学院,贵州 贵阳 550025)
花榈木(Ormosia henryi)为国家二级重点野生保护植物,珍贵用材树种,具有较高的经济和生态价值[1],其种子种皮坚硬、透水性差和不易吸水[2],存在繁殖障碍。作者在前期的研究中已建立了花榈木体细胞胚胎发生体系[3−4],获得的子叶胚可作为人工种胚,可包被在富含营养物质的人工胚乳中制作成人工种子,解决花榈木因种子稀缺和因硬实而导致的萌发障碍问题。当前人工种子的制作方法较多,常见的有单层包埋法[5−6]、双层包埋法[7]和空心珠法[8],而密封端法因制作工序繁琐、生产成本较高鲜有报道[9−10],但对不同方法制作的人工种子物理性质的了解甚少,仅发现谷睿智[7]采用单层包埋法对添加纳米材料人工种皮的保水能力和力学属性展开研究,尚未报道哪种制作方法和附加物的人工种子具有更加优良的物理性质。良好物理性质的人工种子可起到防菌、阻止营养外渗和保水等作用,为人工种子的萌发提供物质基础,且方便贮藏、处理、运输和播种[5,11−12]。
因此,本试验选取3 种人工种子胶囊制作方法和5 种附加物,通过检测它们的物理性质,筛选出物理性质良好的人工种子胶囊,进一步对花榈木体细胞胚进行包埋,并探讨不同植物生长调节剂和低温贮藏时间对花榈木人工种子萌发的影响,为花榈木人工种子制作、技术改良和播种提供参考。
1 材料与方法
1.1 试验材料
花榈木体细胞胚胎发生的诱导参考Wu 等[3]的方法,其方法获得的子叶胚作为本试验的人工种胚。
1.2 试验方法
1.2.1 人工种子胶囊制作方法
试验设计了3 种人工种子胶囊的制作方法,参考 Patel 等[8]方法并适当改进。
1)单层包埋法:分别用5 mL,直径6 mm 的滴管吸取质量分数为0.1 g/L 海藻酸钠(SA)溶液、0.2 g/L SA 和0.3 g/L SA 后滴入装有200 mL 0.2 g/L CaCl2溶液的烧杯中络合10 min,分别得到人工种子胶囊A1、A2、A3。
2)双层包埋法:将单层包埋法获得的人工种子胶囊A1、A2、A3,分别放入0.1、0.2、0.3 g/L SA 溶液后,再滴入2% CaCl2溶液中络合10 min,分别得到人工种子胶囊B1、B2、B3。
3)空心珠法:用5 mL,直径6 mm 的滴管吸取0.15 g/L 羟甲基纤维素CM+0.1 g/L CaCl2混合液或0.3 g/L CM+0.1 g/L CaCl2混合液后,分别滴入0.1、0.2、0.3 g/L SA 溶液中络合20 min,分别得到人工种子胶囊C1、C2、C3或D1、D2、D3。
1.2.2 人工种子胶囊物理性质的测定
上述12 组人工种子胶囊络合结束后,蒸馏水清洗,滤纸吸干水分,每组人工种子胶囊数量为60 粒。观察它们颜色、形状和测定其物理性质(硬度、失水率和复水率)。
在室温下(17~22 ℃,空气湿度80%),MNT−150T 游标卡尺(精确到0.01 mm,美耐特,德国)测定人工种子胶囊直径、长径,SH−50 硬度计(精确到0.1 N,思为,中国)测定硬度,每组重复测定3 次。每组包含10 个人工种子胶囊装入90 mm 培养皿中,每组重复3 次,分别于0 h(M0h)和24 h(M24h)称量,24 h 后向每组培养皿中加入50 ml 蒸馏水,进行复水24 h(m24h)并称重,并按公式(1)~(2)计算24 h 失水率和24 h 复水指数。
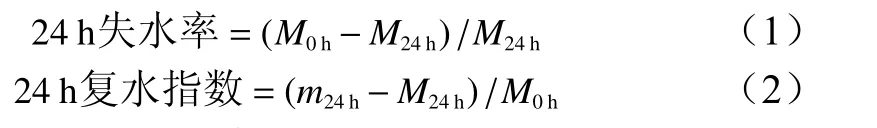
1.2.3 人工种子胶囊附加物
0.3 g/L SA 溶液中分别加入5 种附加物,每种附加物3 个浓度,分别为活性炭AC[1 g/L(a1)、3 g/L(a2)、7 g/L(a3)],保水剂WRA[10 g/L(b1)、20 g/L(b2)、30 g/L(b3)],TiO2[10 g/L(c1)、20 g/L(c2)、30 g/L(c3)],SiO2[10 g/L(d1)、20 g/L(d2)、30 g/L(d3)],壳 聚糖CHS[10 g/L(e1)、20 g/L(e2)、30 g/L(e3)],采用1.2.1 双层包埋法中的B3组(0.3 g/L SA 溶液滴入0.2 g/L CaCl2溶液中络合10 min)进行人工种子胶囊的制作,以B3组人工种子胶囊作为空白(CK),参考1.2.2 的方法测定其物理特性。
1.2.4 植物生长调节剂对人工种子的萌发诱导
采用1.2.3 中b2组(20 g/L WRA)的双层包埋法对子叶胚进行包埋。人工种子胶囊中添加B5培养基、30 g/L 蔗糖和不同植物生长调节剂(MF1:1.0 mg/L 6−BA+0.1 mg/L NAA;MF2:2.0 mg/L 6−BA+0.1 mg/L NAA;MF3:0.5 mg/L TDZ+0.2 mg/L NAA;MF4:1.0 mg/L 6−BA+0.1 mg/L NAA+1.0 mg/L GA3),制备的人工种子接种至无植物生长调节剂的培养基中进行萌发诱导。每组20 粒人工种子,重复实验 3 次。培养条件:光照强度20 μmol/(m2·s),16 h/18 h(昼/夜),(25±2)℃。培养4 周后,统计人工种子的萌发率。
1.2.5 低温贮藏时间对人工种子萌发的影响
采用1.2.4 中方法对子叶胚进行包埋,人工种子胶囊中添加B5培养基、30 g/L 蔗糖、1.0 mg/L 6−BA+0.1 mg/L NAA+1.0 mg/L GA3制作人工种子,置于240 mL 组培瓶中,盖上盖子,贮藏在4 ℃冰箱中0、7、14、21、28 d 后,分别接种至无植物生长调节剂的培养基中进行萌发诱导。每组20 粒人工种子,重复实验3 次。
1.3 分析方法
所有数据使用SPSS 18.0 进行单因素方差分析,使用Turkey 检验进行显著性分析,对人工种子胶囊的物理性质进行KMO 检验,并对KMO值0.6 以上的物理指标进行主成分分析。
2 结果与分析
2.1 制作方法对人工种子胶囊物理性质的影响
3 种制作方法获得的人工种子胶囊质地和形状差异较大,颜色均呈透明、乳白色(图1)。单层包埋法和双层包埋法人工种子胶囊饱满,轮廓规整,均为圆球形,偶伴有短尾。空心珠包埋法中C1和D1呈蝌蚪形、圆锥形,C2、C3、D2和D3均呈半帽形状,其中,D2和D3粘结现象严重。
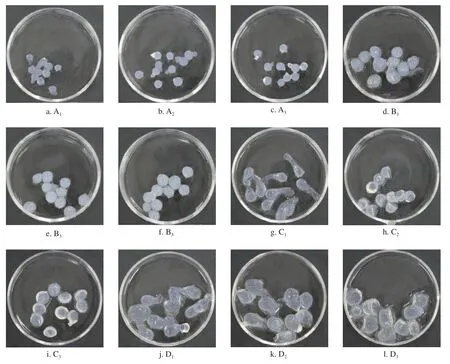
图1 3 种不同制作方法制作的人工种子胶囊Fig.1 Artificial seed capsule prepration with 3 different methods
12 组人工种子胶囊的物理性质差异显著(P0.05)(图2)。空心珠法D3组初始质量和直径最高,显著高于单层包埋法和双层包埋法(P0.05)。12 组人工种子胶囊硬度随着SA 浓度的升高而升高,其中,以双层包埋法中的B3组最大;人工种子胶囊长径以C1组最大,与D1组差异不显著,但显著高于其他组(P0.05),这表明C1和D1组长尾明显。单层包埋法24 h 失水率较高,其中以A1组最高,显著高于双层包埋法和空心珠法(P0.05),其24 h 复水指数相应地较低,相反,空心珠法中的D1~D3组人工种子胶囊失水率低,且复水指数较高,具有良好的保水和复水性能。综合评价可得,双层包埋法B3组最佳。
2.2 附加物对人工种子胶囊物理性质的影响
5 种附加物的人工种子胶囊在形状上差异较小,均呈圆球形和椭圆形,偶伴有短尾,而颜色差异较大,这与添加的附加物种类有关(图3)。它们的物理性质差异显著((P0.05,图4),人工种子胶囊初始质量和长径在添加SiO2和TiO2中较低,添加保水剂b2和b3组中较高;其硬度随附加物浓度的增加大体呈增加的趋势,均高于CK,其中以30 g/L CHS(e3组)最高;它们24 h失水率无差异,而24 h 复水指数和直径差异显著,均在添加30 g/L WRA(b3组)中最高。综合评价和整体分析可得,添加20 g/L WAR(b3组)人工种子胶囊的物理性质最优。
图3 双层包埋法添加不同附加物的人工种子胶囊Fig.3 Artificial seed capsules with different additions by double-layer embedding method
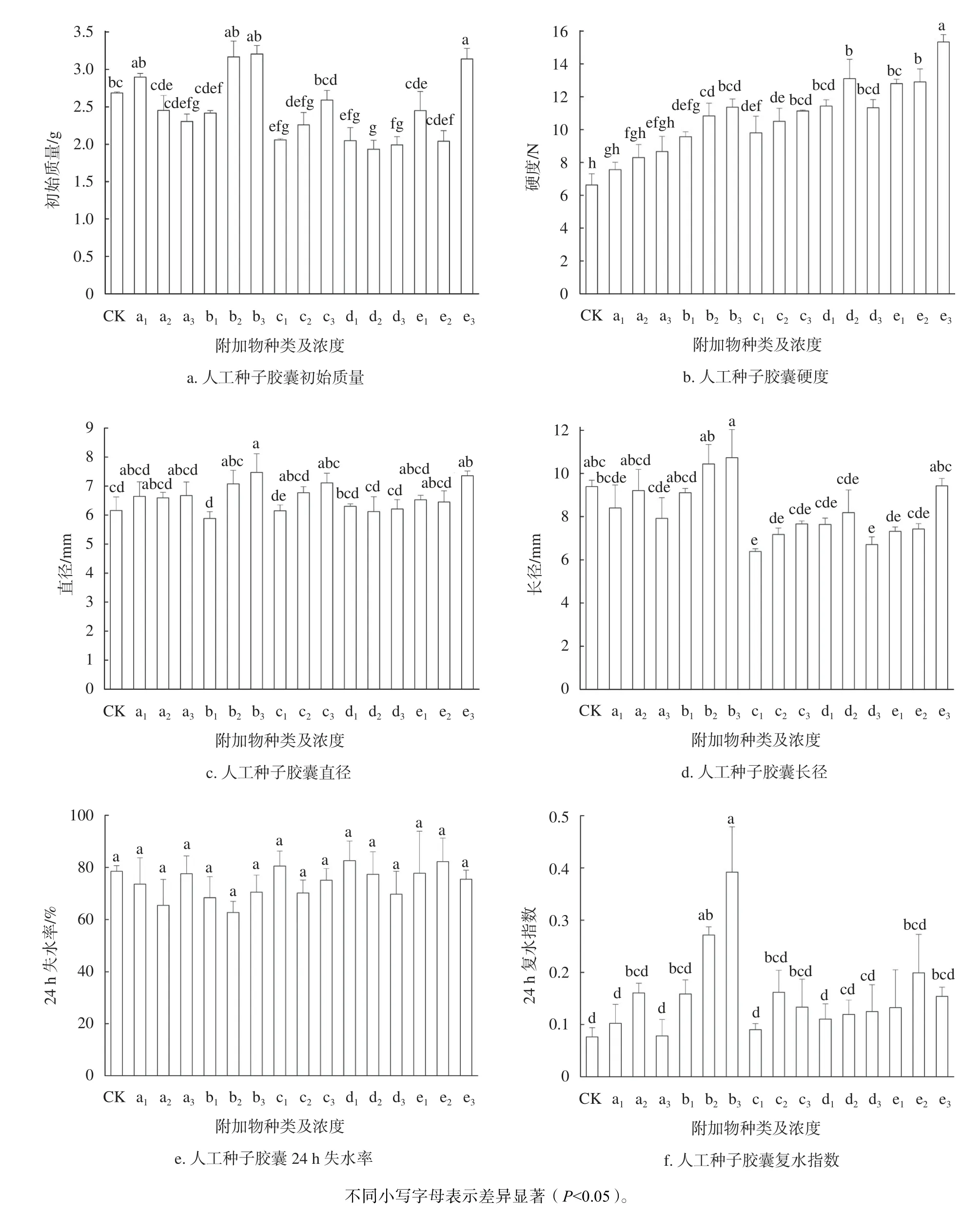
图4 16 组人工种子胶囊的物理性质Fig.4 Physical properties of 16 artificial seed capsules
2.3 植物生长调节剂对人工种子的萌发效果
花榈木人工种子培养1 周后,子叶胚(图5a)突破人工种皮,陆续萌发(图5b),但生长缓慢,很难发育形成完整的再生植株,而包埋合子胚的人工种子能够形成健壮的再生植株(图5c)。

图5 花榈木人工种子的萌发效果Fig.5 Germination of artificial seeds in O.henryi
人工种子萌发率在4 组培养基中无差异(图6),均高于60%,其中以MF4组培养基(1.0 mg/L 6−BA+0.1 mg/L NAA+1.0 mg/L GA3)最 高(96%),分别比第MF1、MF2、MF3组高35%、17%、33%。
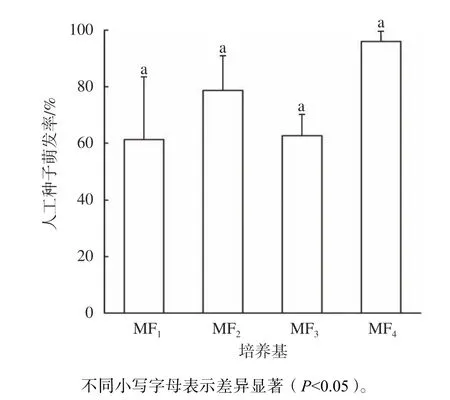
图6 植物生长调节剂对人工种子萌发的影响Fig.6 Effects of plant growth regulator on artificial seed germination
2.4 低温贮藏时间对花榈木人工种子萌发的影响
人工种子在4 ℃贮藏期间,无明显褐化现象。贮藏第7 天和第14 天,均观察到1 粒人工种子突破人工种皮。不经低温贮藏的人工种子(0 d)萌发率较高,随贮藏时间的增加,其萌发率逐渐下降(表1),贮藏第21 天后其萌发率为0。
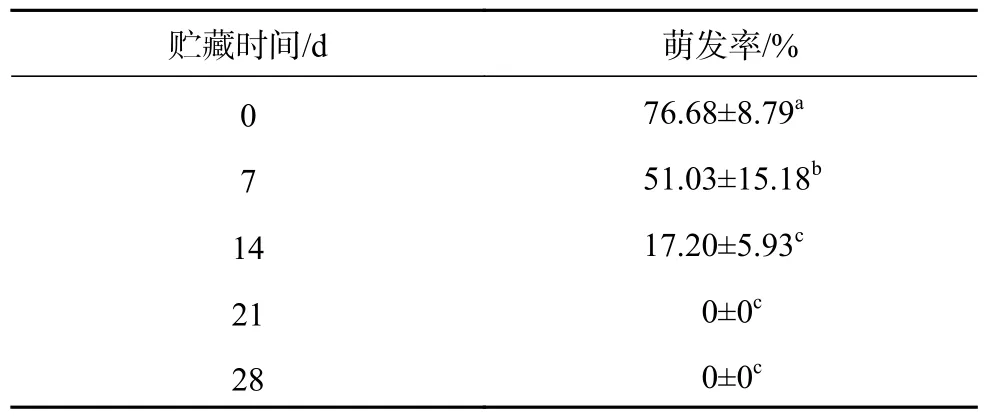
表1 低温贮藏时间对人工种子萌发的影响Table 1 Effects of low temperature storage time on artificial seed germination
3 结论与讨论
目前,人工种子的制作方法有干燥法[13]、密封端法[9]、水合法[14]和空心珠法[8]。水合法方便快捷、所用材料少、体积小、成本低、利于管理和运输等[15],被广泛运用到人工种子的研究中。本研究发现水合法中双层包埋法制作的人工种子胶囊物理性质优于单层包埋法,这与谷睿智[7]研究结果一致。空心珠法在防止人工种子水分散失和提高复水指数效果较好,但其形状不规则,粘连现象严重,因此,继续完善空心珠法的研究,其应用前景广阔。
人工种子胶囊类似于天然种子的子叶或胚乳,其除了为人工胚胎生长发育提供所需的营养物质、植物生长调节剂外[16],可根据需求添加渗透剂、保水剂、活性炭和抗菌剂等,为人工种子低温储藏提供保护[15]、减缓水分散失[7]、防止营养物质外渗[17]和降低微生物感染[18−19]。本研究得出人工种子胶囊中添加不同附加物对其物理性质具有较大的影响,其中以添加20 g/L 保水剂效果最优,这与保水剂能够降低人工种子胶囊失水率和提高人工种子胶囊复水指数有关。人工种子胶囊添加活性炭经失水后复水,其复水指数仍较低,甚至不能复水,张铭等[20]也发现人工种子干燥到一定程度后是不能吸水回胀的。所以,保水剂为未来人工种子在干旱环境中的使用提供一种可能。
通常情况下,高比例细胞分裂素/生长素促进人工种子和芽的萌发[16,21−23]。本研究发现,GA3可提高花榈木人工种子萌发率,这可能与GA3对体细胞胚的萌发具有促进作用有关[24]。花榈木人工种子萌发率随贮藏时间延长逐渐下降,这可能与人工种胚的质量低,人工种子胶囊含水量高、不透气以及长时间低温贮藏等诸多因素共同影响有关。因此,人工种子的推广运用还需开展大量的试验研究。
人工种子胶囊的物理性质受制作方法和附加物的影响,在人工种子制作方法中,双层包埋法较单层包埋法和空心珠法是制作人工种子胶囊较好的方法。双层包埋法在人工种子胶囊中添加20 g/L 保水剂的人工种子胶囊物理性质最好;花榈木人工种子胶囊中添加B5 培养基、1.0 mg/L 6−BA、0.1 mg/LNAA、1.0 mg/L GA3、30 g/L 蔗糖,其萌发率最高为96%,其含水量高、不透气和长时间低温贮藏可能是造成其萌发率低的原因。
