米粉中蛋白组分对陈化后淀粉颗粒间解聚的影响
2022-06-15董鹏郭玉宝朱世民许子鑫
董鹏,郭玉宝,朱世民,许子鑫
(安徽工程大学 生物与食品工程学院,安徽 芜湖,241000)
中国是世界稻米产量最高的国家,平均年产量超过2亿t,占全球的35%[1]。稻米不仅是世界65%以上人口的主食,还可以加工成其他食品。为了保证稻米的周年供应,需要对稻米进行储藏。而稻米储藏过程中容易陈化,品质发生劣变,引起经济损失,但陈化机制目前仍不清楚。
蛋白质和脂肪是大米中最主要的成分,与大米品质有着密切关系[2]。陈化过程中蛋白质含量基本不变,但蛋白质中巯基减少,二硫键增多,这使得米饭的硬度增大,黏性减小[3-5]。有研究指出,大米中清蛋白、球蛋白、谷蛋白和醇溶蛋白对淀粉的糊化特性影响不同:添加清蛋白后,淀粉的糊化参数值均有所提高[6],而球蛋白的添加却出现相反的现象[7];谷蛋白的添加使成糊温度升高,峰值黏度和衰减值降低[7];醇溶蛋白的添加导致衰减值增加(P<0.05)[8]。WU等[9]研究发现大米中的脂质氧化产物会促使蛋白质氧化,引起大米品质劣变。越来越多的研究表明,陈化过程中蛋白质和脂肪的变化是引起大米品质变化的最主要原因[10-11],但证据仍不充分,特别是陈化中蛋白质影响淀粉糊化的途径仍不明确。
本实验通过剥蚀碾磨获得富含蛋白的米粒外层米粉,然后依次脱脂、脱清蛋白、脱球蛋白、脱谷蛋白和脱醇溶蛋白,将每一组分脱除后所得各样品进行储藏陈化。以陈化前各对应样品为对照,考察各样品陈化后糊化粒度分布和显微形态变化,揭示各蛋白对淀粉糊化产生影响的微观机制,为阐明大米陈化机理提供依据。
1 材料与设备
1.1 材料与试剂
粳型新谷新米,苏果超市,初始含水量为(14.08±0.07)%。正己烷、NaCl、NaOH、无水乙醇、盐酸,均为分析纯,国药集团化学试剂有限公司。
1.2 主要设备
JGMJ8090稻谷精米检测机,上海嘉定粮油仪器有限公司;MS2000激光粒度分析仪,英国马尔文仪器有限公司;RVA-TechMaster快速黏度分析仪,瑞典Perten有限公司;LW200CA光学显微镜,上海测维光电技术有限公司;LGJ-12真空冷冻干燥机,北京松源华兴科技发展有限公司。
1.3 实验方法
1.3.1 蛋白脱除及样品储藏陈化
利用精米机对新米进行剥蚀碾磨,获得米粒外层米粉(碾削质量占米粒质量的15%,记为F0),过40目筛,筛下物装自封口袋在4 ℃下贮存备用。为减少脂肪对脱蛋白的影响,预先用4倍正己烷在室温下脱脂1 h,抽滤,自然挥发残留溶剂24 h[12],得脱脂米粉(记为F1)。根据溶解性差异,参考Osborne经典方法,分别选用蒸馏水、5%(质量分数)NaCl、0.1 mol/L NaOH和70%(体积分数)乙醇从脱脂米粉中逐一脱除清蛋白、球蛋白、谷蛋白和醇溶蛋白[13-14],经洗涤、中和和冻干后,用研钵碾成粉末,所得各样品分别记为F2(脱清蛋白样品)、F3(脱球蛋白样品)、F4(脱谷蛋白样品)和F5(脱醇溶蛋白样品,即粗淀粉),如图1所示。

图1 脱脂脱蛋白流程图Fig.1 Flow chart of lipid and protein removal
将米粉及脱脂和脱各蛋白后所得各样品(F0~F5)分成2份,1份在4 ℃下储藏保鲜作为对照,1份在37 ℃恒温培养箱中储藏陈化12个月。
1.3.2 粒度分布的测定
在试管中加入0.200 g样品,加10 mL蒸馏水,用涡旋仪使其混匀后静置5 min,然后置于75 ℃恒温水浴锅中加热5 min(过高温度会黏连成胶凝化状态),取出后放置在50 ℃的恒温水浴锅中保温,防止其老化。采用激光粒度分析仪测定粒度,分析条件:分散剂为水,仪器转速为1 800 r/min,超声分散,加样使遮光度达10%~20%,每个样品平行测定5次,取平均值[15]。
1.3.3 组分陈化效应及陈化贡献率的计算
大米各组分自身的基质效应[16]及其在陈化过程中的变化均会对淀粉粒度分布产生影响,排除组分自身的基质效应,分离出各组分在陈化过程的变化对淀粉粒度分布的影响。参照GUO等[12]的方法,计算脂肪和各蛋白对陈化后粒度分布的陈化效应及各组分的陈化贡献率。
1.3.4 糊化形态光镜观察
光学显微镜制样方法与粒度分布相同。观察时,先将试管中样品用涡旋仪混匀1 min,用吸管取样滴在载玻片上,盖上盖玻片,在光学显微镜下观察并拍照记录[10]。
1.3.5 糊化特性的测定
采用快速黏度分析仪(rapid viscosity analyzer,RVA)并参照美国谷物化学家协会AACC61-02的方法测定各样品的黏度变化。提取RVA谱特征参数:峰值黏度(peak viscosity,PV)、衰减值(BD)、最终黏度(final viscosity,FV)、回生值(setback,SB)和成糊温度(paste temperature,PaT)[13]。
1.3.6 数据处理
使用SAS 8.01进行单因素方差分析(analysis of variance,ANOVA)及邓肯多重比较(Duncan’s multiple range test,P<0.05),结果以“平均值±标准差”表示。
2 结果与讨论
2.1 脱蛋白对陈化后粒度分布变化的影响
由图2-A可知,米粉陈化后的粒度分布发生明显变化,小粒径峰降低而大粒径峰升高。研究表明淀粉单粒粒径约为3~8 μm[17],淀粉复粒约为7~39 μm[18]。图2-A中小粒径峰的范围为2~30 μm,说明米粉糊化后出现的小粒径峰是由解聚分散出来的淀粉颗粒形成的,包括淀粉单粒和淀粉复粒。米粉陈化后小粒径峰降低,表明陈化使淀粉颗粒间更难于解聚。当从米粉中逐一脱除脂肪及清蛋白、球蛋白、谷蛋白和醇溶蛋白后,得到粗淀粉,其陈化后粒度分布与陈化前并无差异(图2-A′),说明米粉中脂肪和各蛋白的存在是引起米粉陈化后粒度分布变化的根本原因。
某组分被脱除前后粒度分布的变化,代表该组分对淀粉颗粒间解聚集的影响。某组分被脱除后进行陈化,与该组分被脱除前进行陈化之间粒度分布的差异,代表该组分陈化对淀粉颗粒间解聚集的影响。脂肪和各蛋白对粒度分布的影响见图2-B~图2-F′。图2-B和图2-B′表明,不论是否陈化,脱脂后的小粒径峰均降低,同时大粒径峰升高且峰位右移,只是陈化后的变化幅度更大,表明脂肪的存在对淀粉颗粒间的解聚具有一定促进作用。脱除清蛋白使陈化前的小粒径峰明显增大,同时大粒径峰消失(图2-C、图2-C′),但陈化后的小粒径峰在一定程度上变矮变宽,说明清蛋白的存在对陈化后淀粉颗粒间的解聚具有显著的抑制作用。脱除球蛋白对未陈化样品的粒度分布没有影响,但陈化后的脱球蛋白样品比脱除前的小粒径峰变得高而窄(图2-D、图2-D′)。脱谷蛋白和脱醇溶蛋白对粒度分布影响不大,且陈化前后基本一致,只是峰位粒径略有提高(图2-E、图2-F′)。这些表明,球蛋白、谷蛋白和醇溶蛋白对淀粉颗粒间的解聚影响不大,只是略微影响了淀粉颗粒的溶胀。

A~F-米粉及其依次脱脂、脱清蛋白、脱球蛋白、脱谷蛋白和脱醇溶蛋白样品,未陈化; A′~F′-米粉及其依次脱脂、脱清蛋白、脱球蛋白、脱谷蛋白和脱醇溶蛋白样品,陈化(下同)图2 米粉中脂肪和各蛋白对淀粉糊化粒度分布的影响Fig.2 Effect of lipid and proteins in rice flour on particle size distribution of starch in residue during heating
上述结果说明,米粉中的脂肪和清蛋白明显影响了淀粉颗粒间的解聚,而且这种影响在陈化后增大。但各组分对米粉陈化后淀粉颗粒间解聚变化的贡献程度需进一步分析。脂肪和各蛋白对糊化粒度体积分数的影响见表1。脱脂使得小粒径峰体积分数明显减小,而脱清蛋白使小粒径峰体积分数明显增大,而且后者增大的幅度远大于前者减小的幅度,表明了清蛋白的存在对抑制淀粉颗粒间的解聚作用远超过了脂肪存在时对淀粉颗粒间解聚的促进作用。而脱球蛋白、谷蛋白和醇溶蛋白对小粒径峰体积分数没有明显影响。因此,米粉储藏陈化后淀粉颗粒间解聚集的变化主要由脂肪的促进解聚作用和清蛋白的抑制解聚作用决定,且后者远超过前者,清蛋白被脱除后淀粉颗粒间完全解聚。
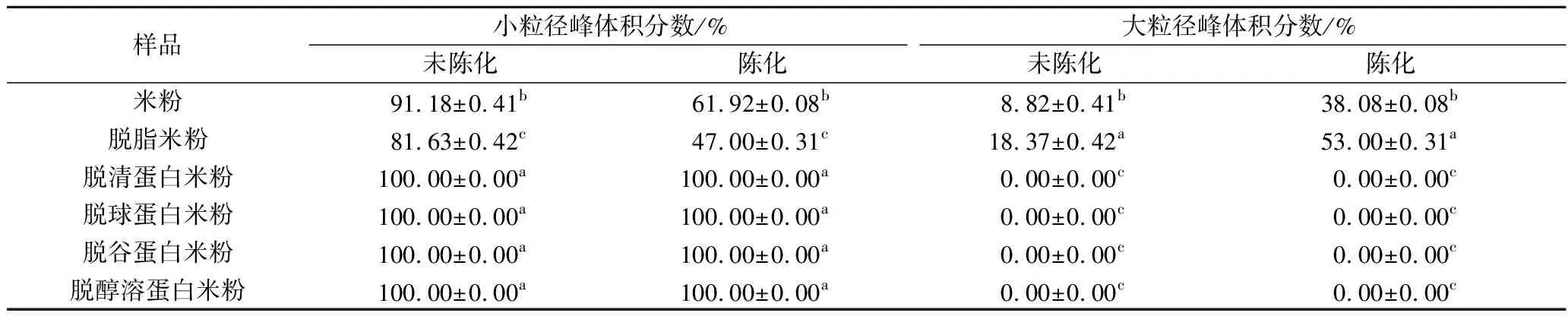
表1 米粉中脂肪和各蛋白对淀粉糊化粒度体积分数的影响Table 1 Effect of lipid and proteins in rice flour on particle size volume fraction of starch in residue during heating
但脂肪和清蛋白对米粉陈化后淀粉颗粒间解聚集的贡献程度,需要在排除各组分自身对淀粉颗粒解聚集的基质效应基础上分离出来[12],见表2。清蛋白对米粉陈化后淀粉颗粒间解聚影响的陈化贡献率最大,为118%,而脂肪陈化贡献率为-18%,更加明确了清蛋白对淀粉颗粒间解聚集的显著抑制作用,而脂肪则对陈化后淀粉颗粒间的解聚具有一定促进作用。球蛋白、谷蛋白和醇溶蛋白对淀粉颗粒间解聚的陈化贡献率均为0。因此,米粉中淀粉颗粒间难于解聚,关键在于清蛋白,陈化后这种影响更加明显。
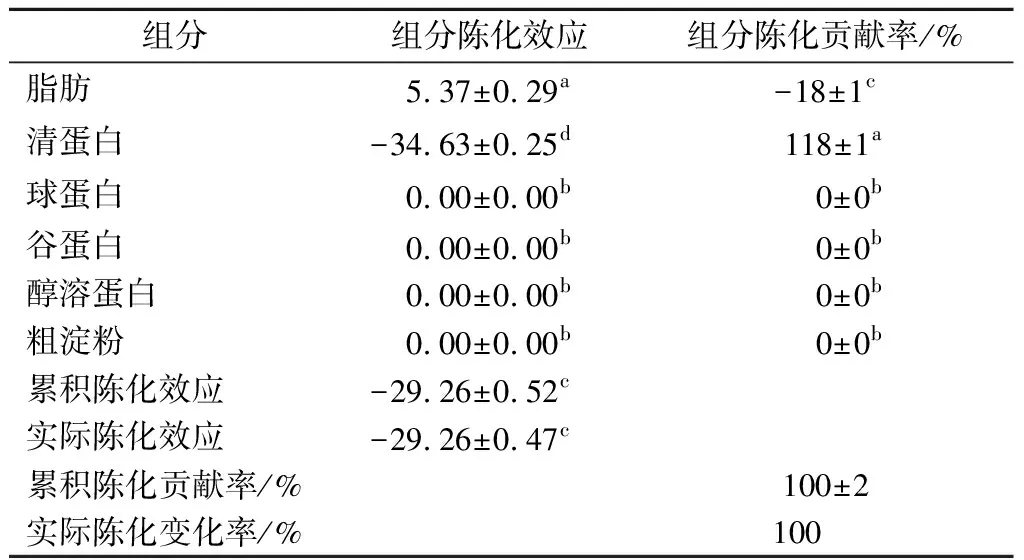
表2 大米陈化过程中各组分的陈化效应及陈化贡献率Table 2 Aging effect and contribution rate of each component in rice aging
2.2 脱蛋白对陈化后光学显微形态的影响
米粉及其脱脂、脱各蛋白前后样品在陈化前后的糊化形态如图3所示。
米粉陈化后仍有很多大颗粒保留,淀粉颗粒间解聚程度比陈化前明显降低(图3-A、图3-A′),体现出陈化使淀粉颗粒间难于解聚。米粉脱脂后未陈化时,保留下来的颗粒比脱脂前大(图3-A、图3-B),而米粉脱脂并陈化后可见更大的颗粒存在(图3-A′、图3-B′),说明脂肪的存在有助于糊化中淀粉颗粒间的解聚,进而分散成更小的颗粒;而且仍然是陈化后比陈化前的颗粒更大(图3-B、图3-B′),这与粒度分析结果相一致。而脱清蛋白后,不论是否经过陈化,未见大颗粒保留,淀粉颗粒间解聚较完全(图3-C、图3-C′),这也印证了粒度分析结果,即脱除清蛋白后大粒径峰完全消失。

图3 脂肪和各蛋白对淀粉糊化光学显微形态的影响Fig.3 Effects of lipid and proteins on microscopic morphology of starch in residues during heating
脱除球蛋白后,不管陈化前后,在形态上均无明显变化(图3-D、图3-D′)。脱谷蛋白和脱醇溶蛋白的样品陈化后形态变化也不明显,见图3-E~图3-F′,可以清晰地看出,脱除谷蛋白和醇溶蛋白后,不论陈化前还是陈化后,淀粉颗粒间已完全解聚,彼此间呈分散状态。这些结果都与粒度分布的结果高度一致,表明储前脱除清蛋白即可使淀粉颗粒间完全解聚,米粉陈化中清蛋白的存在是造成陈化后淀粉颗粒间难于解聚的主要原因,这可能对改善米制品的品质具有重要意义。
2.3 脱蛋白对陈化后糊化特性的影响
储前脱脂和脱清蛋白对陈化后糊化特性的影响见表3。陈化后,米粉的PV明显降低,脱脂并没有改变这种变化趋势,然而脱清蛋白并陈化后PV却明显提高,说明脱清蛋白后淀粉颗粒间解聚有助于峰值黏度的提高。米粉陈化后BD值明显降低,脱脂不但没有改变降低的趋势,而且降低的幅度更大,而脱清蛋白并陈化后BD降低的幅度明显减小,表明脱清蛋白后淀粉颗粒间解聚促进了淀粉颗粒的溶胀和破裂,脱清蛋白使得陈化后FV和SB的增加幅度降低也说明了这一点。特别是PaT,米粉陈化后提高了9.47 ℃,脱脂米粉陈化后提高了2.10 ℃,而脱清蛋白样品陈化后与陈化前无明显提高,这充分说明脱清蛋白后淀粉颗粒间解聚有助于成糊温度的降低。另外,与脱脂米粉(脱清蛋白前)陈化后相比,脱清蛋白样品陈化后PV、BD明显提高,PaT明显降低。这些结果都表明,脱清蛋白使得陈化后的糊化特性得到明显改善。

表3 脂肪和清蛋白对糊化特性的影响Table 3 Effects of lipid and albumin on starch pasting properties
3 结论
储前脱除米粉中脂肪和各蛋白,将所得样品进行陈化。糊化后粒度分析表明,陈化中清蛋白的存在明显抑制了淀粉颗粒间的解聚,而脂肪的存在则在一定程度对淀粉颗粒间解聚具有促进作用,这2种组分对米粉陈化后淀粉颗粒间解聚变化的陈化贡献率分别为118%和-18%,微观形态有力地支持了粒度分析结果。脱清蛋白使得陈化后PV明显提高,BD降低幅度及FV和SB升高的幅度缩小,PaT降低到与陈化前无显著差异(P<0.05),糊化特性得到明显改善。因此,米粉中清蛋白的存在使得陈化后淀粉颗粒间难于解聚是米粉陈化后糊化特性变化的主要原因。这一发现,对于揭示稻米陈化变化的微观机制具有重要意义,对于调控米制品品质也具有一定的指导作用。
