基于UPLC-MS/MS技术测定大鼠血浆中的氨甲环酸
2022-06-15杨玉婷赵立春赵小峪高学旺高云华张锁慧
王 雪,杨玉婷,赵立春,廉 洁,赵小峪,高学旺,高云华,4,张锁慧,4*
(1. 中国科学院理化技术研究所,北京 100190;2. 广西中医药大学 药学院,广西 南宁 530200;3. 中国人民公安大学,北京 100038;4. 中科微针(北京)科技有限公司,北京 102600)
黄褐斑是一种常见的慢性色素沉积性疾病,临床表现为患者皮肤表面呈对称性和不规则的色素沉着棕褐色斑纹[1-2],目前确切的黄褐斑发病机制尚未明确,中医学认为黄褐斑的病因病机主要与肝、脾、肾三脏密切相关[3]。氨甲环酸(Tranexamic Acid, TA)是一种纤溶酶抑制剂,结构见图1,其能通过抑制纤维蛋白的溶解发挥止血功效,常用于预防和治疗出血[4-5]。TA是赖氨酸的合成衍生物,能抑制纤溶酶原激活物(PA)转化为纤溶酶,其机制是通过与赖氨酸结合位点的可逆相互作用竞争性从而抑制PA的激活[6]。从1979年Nijosadako发现TA能淡化黄褐斑开始,TA便作为一种治疗黄褐斑的药物引起人们关注[7-8]。
分析生物基质中氨甲环酸的方法最常用的为高效液相色谱法[9-10],但考虑到TA为末端吸收,其结构中不具有发色团或荧光团,因此常需要衍生化处理以提高检测灵敏度,无形中繁琐化了氨甲环酸分析程序,并且可能造成较大的分析差异。气相色谱-质谱联用法可获得高效液相色谱法衍生化后的检测限,然而所需血浆样品体积大[11-12]。本工作拟基于色谱技术与质谱技术的联用[13],建立简单、快捷、灵敏度高的分析方法用于测定血浆中TA的含量,并将应用于治疗黄褐斑的临床口服TA片剂在大鼠体内的药物代谢动力学研究。
图1 氨甲环酸结构式Fig.1 Structure of tranexamic acid
1 实验部分
1.1 仪器
UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱联用Dionex Ultimate 3000 RS 快速高效液相色谱系统(美国Thermo Fisher公司,配有电喷雾离子源(ESI)及Xcalibur1.2数据处理系统);AB1040N分析天平(瑞士Mettler Toledo公司);MS3涡旋振荡器(德国 IKA公司);3K15冷冻离心机(德国Sigma公司);超低温冰箱(中科美菱公司产品);pH酸度计(杭州市奥立龙有限公司产品)。
1.2 试剂
氨甲环酸对照品(含量:100%,中国食品药品检定研究院);顺式-4-氨基环己烷羧酸(含量:98%,北京伊诺凯公司产品);微针制剂(中国科学院理化技术研究所生物材料与应用技术中心研制,批号:20200118);甲醇(色谱纯,百灵威试剂公司);甲酸铵(色谱级,上海麦克林试剂公司);乙腈(色谱纯,美国Fisher公司);甲酸(质谱级,美国Fisher公司);超纯水(色谱级,美国 Thermo Fisher 公司产品)。
1.3 动物
SPF 级健康 SD 大鼠,雌性,体质量为(250±10) g,购买于北京金牧阳动物技术有限公司。
1.4 LC-MS/MS分析方法
1.4.1 色谱条件
色谱柱:Nano Hilic柱(150 mm × 2.1 mm,3 μm);流动相: 10 mmol/L甲酸铵(pH 3.8)-乙腈(95∶5,体积比);流速为0.2 mL/min;柱温为30 ℃,进样量为2 μL;采集时间为 2 min;洗针液为50 % 甲醇溶液。
1.4.2质谱条件
ESI+离子源,扫描模式为 Targeted-MS2-正离子,检测离子对分别为 TAm/z158.117 4 → 95.085 9,内标物(I.S.)m/z144.101 9 → 81.070 4,其他质谱方法相关参数见表1。

表1 质谱参数
1.5 标准储备液和标准工作液的配制
精准称取 TA 标准品100 mg于100 mL 容量瓶中,用流动相溶解并定容至刻度线,此储备液的质量浓度为1 000 mg/L。再分别精确吸取0.02、0.05、0.15、0.5、1、2、5、7 mL的 TA 储备液于10 mL容量瓶中,加入流动相定容至刻度,得2、5、15、50、100、200、500、700 mg/L系列 TA 标准品溶液。将 TA 系列标准品溶液再分别用大鼠空白血浆稀释 10 倍,配制成相当于 TA 血浆浓度为0.2、0.5、1.5、5、10、20、50、70 mg/L的加标血浆工作液。精密吸取100 μL空白血浆,分别向其加10 μL TA 标准溶液5、50和500 mg/L,配制成相当于氨甲环酸血浆浓度为0.5、5和50 mg/L的低、中、高3个浓度样品,按“1.6”方法操作得质控样品(quality control, QC)。
称取10 mg 顺式-4-氨基环己烷羧酸对照品于10 mL容量瓶中,用流动相溶解并定容至刻度;应用时再用流动相稀释上述溶液至25 mg/L,得内标溶液。
1.6 血浆样品的处理
精密吸取100 μL加标血浆样品于1.5 mL离心管中,加入质量浓度为25 mg/L 的内标溶液10 μL,3 500 r/min涡旋30 s,再加入500 μL甲醇,3 500 r/min涡旋1 min,13 000 r/min离心15 min,取上清液2 μL于装有洁净内衬管的进样瓶中分析测试。
取空白血浆,加入500 μL甲醇,3 500 r/min涡旋1 min,13 000 r/min高速离心15 min。
1.7 稳定性考察
1.7.1 样品的室温稳定性
平行制备3份质控样品(0.5、5、50 mg/L),于室温下放置 12 h 后,按照“1.6”样品处理方法进行处理并依“1.4”法进行测定,主要考察样品浓度的变化情况,以此评价血样的室温稳定性。
1.7.2 样品的冻融稳定性
平行制备3份质控样品(0.5、5、50 mg/L),将3 种浓度的质控样品置于-20 ℃低温冰箱使其充分冷冻,然后再取出至室温使其融化,重复3次上述冻融步骤,按照“1.6”样品处理方法进行处理并依“1.4” 法进行测定,主要考察测定浓度的变化情况,以此评价血样的冻融稳定性。
1.7.3 样品处理后的室温放置稳定性
将低、中、高(0.5、5、50 mg/L)3 种浓度的质控样品按“1.6” 法处理后,将处理后的质控样品转入至洁净液相进样瓶中,用封口膜依次密封进样瓶瓶口,室温放置12 h 后进样,以此评价提取后血浆样品于室温放置后的血样稳定性。
1.8 药代动力学研究
大鼠于SPF级动物房下适应性饲养一周,根据TA治疗黄褐斑的临床口服单次给药剂量按照人与大鼠剂量关系进行换算。使用生理盐水作为溶媒,配制0.9%的TA溶液,使用灌胃针输送0.5 mL的0.9%TA溶液至大鼠胃部(平行6只),给药开始记录给药时间,每只大鼠在给药前及给药后预定的时间点(0.5、1、2、3、4、5、6、10、13、16、24、30 h)对大鼠用割尾法进行尾静脉采血,每次采血0.4 mL左右,将收集的大鼠血液置于预先经过抗凝处理的肝素管中,4 ℃、 5 000 r/min下离心15 min,取200 μL上层血浆保存于-20 ℃冰箱中。按照 “1.6” 血浆样品处理法进行血样处理,并行 “1.4” 法进行血浆样品中 TA 的含量测定。
2 实验结果
2.1 血浆样品处理方法优化
本文试验了不同蛋白沉淀剂,包含乙腈[14-15]、甲醇[16-18]、高氯酸[19],对TA血浆样品的提取效率,经比较色谱谱图观察甲醇作为沉淀剂对TA的提取效果最佳。本试验也曾尝试对甲醇处理后的上清液进行吹干后流动相复溶[20],结果显示此前处理方法可极大地提高TA检测灵敏度,但极易引起基质抑制效应过大,故综合考虑本文选择甲醇作为最终沉淀剂。本文考察了溶剂效应对峰型的影响,分别试验了水、流动相、50%甲醇及50%乙腈水作为溶媒对TA及内标物出峰的影响,结果显示含盐流动相作为溶媒可促进目标物的电离,获得更强的信号,起到离子增强作用。同时可以向流动相中加入甲酸,提高TA与I.S.的离子化强度,并且可以起到改善峰型的作用。
2.2 方法学验证
2.2.1 特异性
分别配制100 μg/L 的TA溶液与内标溶液,进样质谱,首先用全扫描(Full scan)模式确定两种化合物的分子离子峰后,再选用 AIF - MS / MS模式优化出TA与I.S. 碰撞能量分别为 20、50 eV,继而确定出了二者的分子离子峰。TA 和 I.S. 的二级扫描质谱图分别如图2、图3所示。其中TA 分子离子峰为m/z158.117 4,以m/z158.117 4为母离子进行二级质谱分析,图谱中出现m/z95.080 9;内标物分子离子峰为m/z144.107 9,以m/z144.107 9为母离子进行二级质谱分析,图谱中出现m/z81.070 4。
2.2.2 方法学专属性
取大鼠的空白血浆分别配制标准样品进行高效液相色谱联用质谱分析,按照“1.6” 的血样前处理方法及 “1.4” 的LC- MS / MS分析方法进行测定,流动相、空白血浆、空白血浆加标样品及实际血样的LC- MS / MS提取离子流色谱图如图4所示。图4中A、B、C、D分别为流动相、大鼠空白血浆、空白血浆加标样品及给药后大鼠血浆样品的提取离子流色谱图。其中1和2分别是TA 的提取离子流色谱图和 I.S. 的提取离子流色谱图。在本分析方法中 TA 和 I.S. 的保留时间分别为 1.72 min 和 1.70 min,实验结果证明TA 和 I.S. 的测定不受血浆中内源物质干扰,方法的专属性良好。

图2 氨甲环酸分子离子峰Fig.2 Product ion mass spectra of TA

图3 内标物分子离子峰Fig.3 Product ion mass spectra of I.S.


图4 流动相(A)、大鼠空白血浆(B)最小定量限(C)和给药后大鼠血浆样品(D)的提取离子流色谱图,1为 TA ,2为I.S.Fig.4 Extracted ion chromatograms of mobile phases(A) blank rat plasma(B) limit of quantification(LOQ)(C) and rat plasma after TA microneedle are applied(D). 1 is for TA and 2 is for I.S.
2.2.3 标准曲线及线性范围
按照 “1.5” 的方法与 “1.6” 的方法分别配制加标血浆工作液并处理,进行标准曲线的测定,以待测物浓度即血浆中 TA 浓度为横坐标,以待测物 TA 与内标物的峰面积比值为纵坐标,进行回归运算,求得的直线回归方程即为标准曲线,见图 5,线性方程为Y= 0.088 2X+ 0.018 8,R2= 0.999 6,TA 的线性范围为0.2~70 mg/L,定量下限为 0.2 mg/L,在此范围内线性关系良好。

图5 标准曲线Fig.5 Standard curve
2.2.4 精密度考察
取空白血浆,配制 TA 低、中、高3个浓度(0.5、5、50 mg/L)的质量控制样品,对每一浓度的5个样品进行分析,并与标准曲线同批于1 d内和连续2 d测定,根据当日的标准曲线计算QC样品的浓度,再根据QC浓度结果与配制的标准浓度作对照,计算本法的精密度,结果见表2。血浆中各浓度样品的RSD在5.5%以下,表明仪器精密度良好。
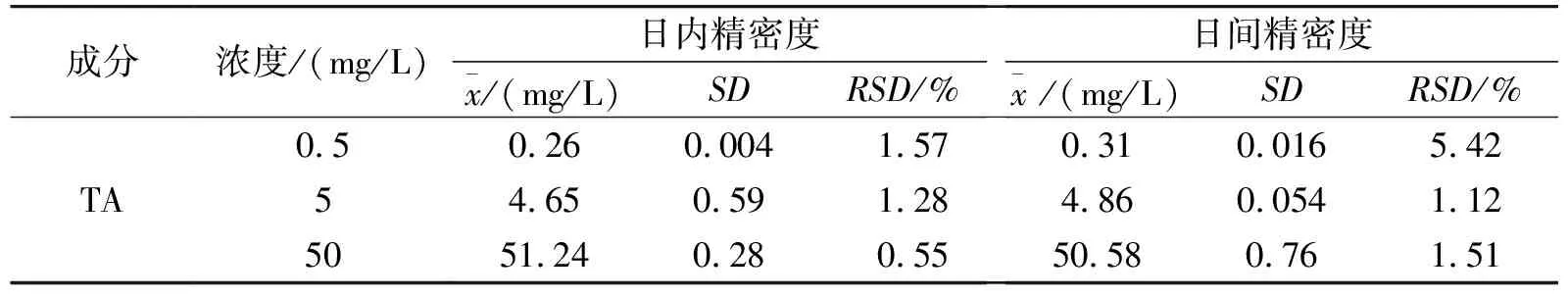
表2 精密度考察结果(n=5)
2.2.5 提取回收率和基质效应
取空白血浆,按 “1.5” 项下方法制备TA低、中、高3个浓度(0.5、5、50 mg/L)的质控样品,对每一浓度的样品进行5个样本分析,进样2 μL,获得 TA 相应峰面积A1(5次测定的平均值)。
取低、中、高3个浓度(0.5、5、50 mg/L)的 TA 系列标准品溶液(即100 μL流动相中加入10 μL内标溶液与10 μL TA标准品溶液),对每一浓度的样品进行5个样本分析,进样2 μL,获得 TA 相应峰面积A2(5次测定的平均值)。
照 “1.6” 法处理血浆样品,吸取100 μL上清液,加入相应的标准溶液和内标溶液各10 μL,配制TA低、中、高3个浓度(0.5、5、50 mg/L)的样品,对每一浓度的样品进行5个样本分析,进样2 μL,获得 TA 相应峰面积A3(5次测定的平均值)。以A3/A1计算提取回收率;以A3/A2计算基质效应,见表3。结果可知,TA 的基质效应在(82.16±15.5)%~(86.47±5.6)%之间,基质效应不会影响 TA 的测定;TA 的提取回收率在(83.90±12.6)%~(110.20±3.3)%之间。
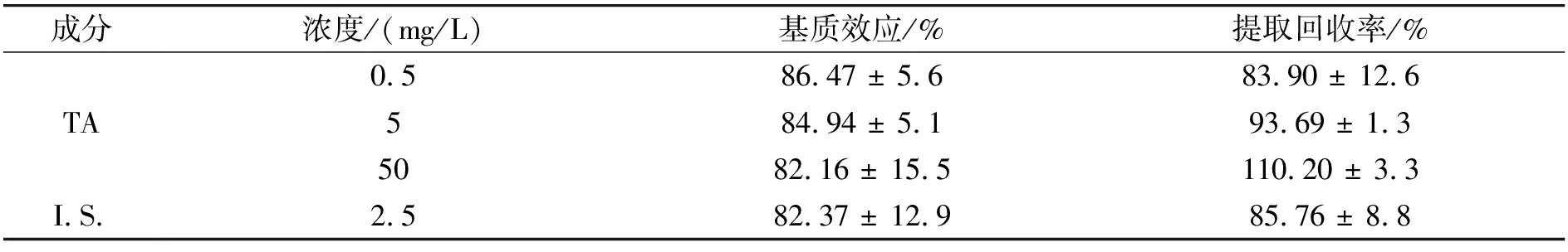
表3 基质效应及提取回收率结果(n=5)
2.2.6 稳定性考察
照“1.7.2” 法考察低、中、高(0.5、5、50 mg/L)3 种浓度质控样品的室温稳定性、冻融稳定性以及处置后室温稳定性,其结果见表4。由表4结果可知,血浆样品在经室温放置12 h、-20 ℃反复冻融3次、处理后室温放置12 h后,血浆中 TA 测定浓度占添加浓度的百分率分别在(89.97±2.3)% ~(102.10±1.1)%、(89.03±3.7)% ~(98.19 ± 0.6)%、(81.60 ± 3.3)% ~(101.16 ± 1.5)%之间,RSD值均小于10%,说明在上述3种条件下样品的稳定性良好。
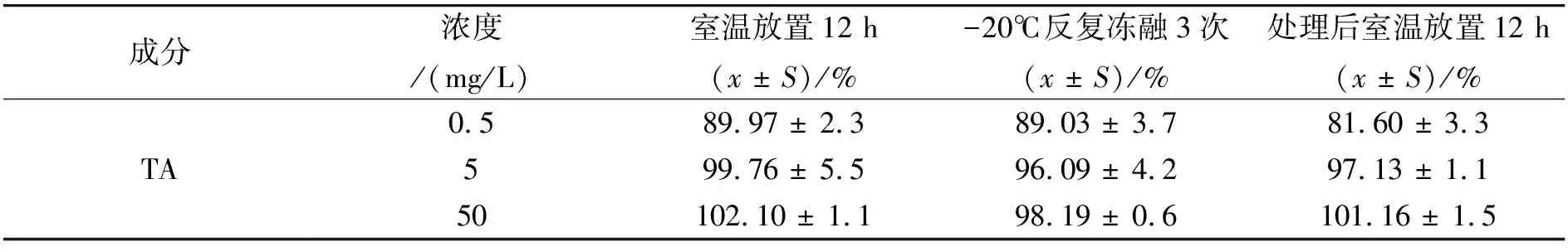
表4 血浆样品稳定性测试(n=3)
2.3 药代动力学研究
照“1.8”法采集血浆样品并进行检测,以采血时间为横坐标,以测得的 TA 血药浓度为纵坐标,使用 Origin 8软件绘制药时曲线,计算最大血药浓度(Cmax)、达峰时间(tmax)以及根据梯形法计算药时曲线下面积 AUC。图6为氨甲环酸灌胃给药的药时曲线,表5为给药后的药代动力学参数,在给药1 h,血浆中TA浓度达峰值,峰值浓度为(2.52 ± 0.77) mg/L,随后下降,给药30 h后,血浆中TA浓度基本已达检测定量限,TA的药时曲线下面积AUC为(18.8 ± 10.38) mg·h/L,说明该方法成功应用于TA在大鼠体内的药代动力学研究。
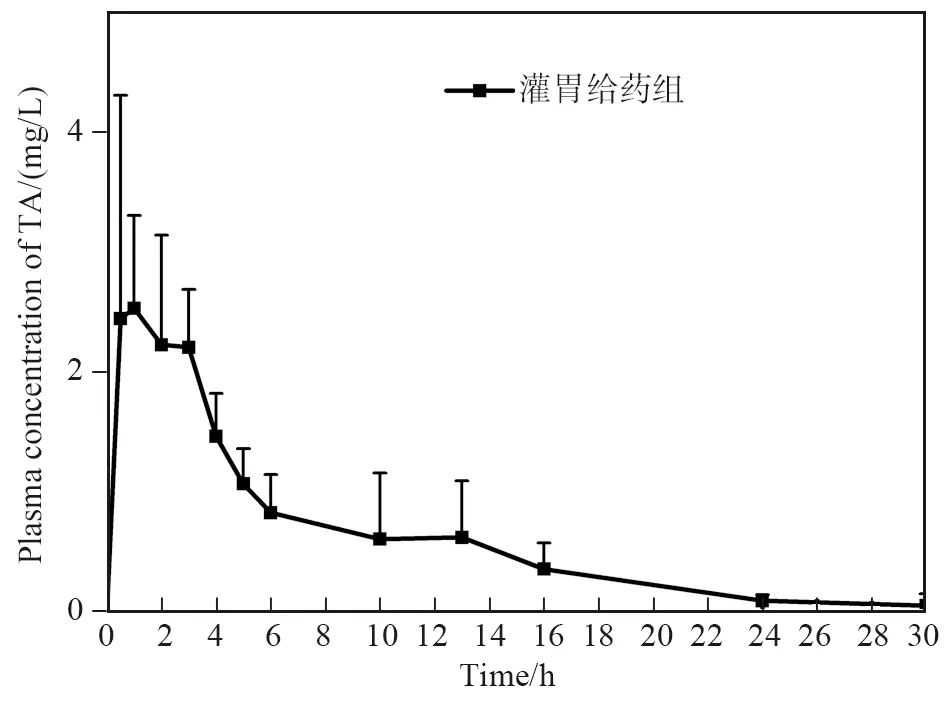
图6 TA经大鼠灌胃后的血药浓度-时间曲线图Fig.6 Blood concentration-time graph of TA after gavage in rats

表5 给药后大鼠血浆TA的药代动力学参数(n=6)
3 结论
建立了可以用于血浆中TA含量测定,简便快捷、专属性强的UPLC-MS/MS分析方法,并进行方法学验证,结果显示该方法稳定性、专属性良好,精密度和提取回收率符合要求,而且该方法比现有的高效液相色谱法精密度更好。分析方法经过完整验证后,成功应用于TA血浆样品的分析,并且报道了用于治疗黄褐斑的TA口服制剂在大鼠体内的药代动力学研究,以期为TA治疗黄褐斑的临床应用提供一定的参考。
