过表达过氧化物酶体增殖物激活受体γ基因对小鼠缺氧性肾损伤的影响▲
2022-06-15邹家森朱仕群韦君雨韦金双陈秀奇覃远汉
邹家森 朱仕群 韦君雨 韦金双 陈秀奇 覃远汉
(广西医科大学第一附属医院儿科,南宁市 530021,电子邮箱:jianyeyu@outlook.com)
肾脏是对缺氧环境极度敏感的脏器,肾脏缺氧与急性肾损伤和慢性肾脏病都有着密切的联系:急性缺氧可以导致急性肾损伤的发生[1],急性肾损伤后肾脏的不完全性修复又会导致肾脏纤维化和慢性肾脏病[2-3]。转化生长因子β(transforming growth factor β,TGF-β)是一种纤维化因子,能反映肾脏的纤维化程度,可作为评估慢性肾脏损伤的标志物[4-5]。研究显示,肾脏的缺氧损伤可能与细胞坏死性凋亡有关[6-7]。坏死性凋亡是一种兼具坏死的形态学特征与可受多种基因调控双重特点的细胞死亡形式,而混合谱系蛋白激酶结构域样蛋白(mixed lineage kinase domain-like protein,MLKL)是其关键执行因子[8]。由此可见,MLKL也与缺氧性肾损伤密切相关。
过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPAR)属于配体激活的核转录因子超家族,有α、β/δ、γ三种亚型,其中PPARγ与肾脏发育、代谢以及多种病理改变相关[9]。我们的前期研究发现,体外培养的肾小管上皮细胞经PPARγ激动剂罗格列酮干预后,可通过减少细胞的坏死性凋亡来减轻缺氧造成的损伤[10]。但在体内过表达PPARγ基因对缺氧性肾损伤的影响如何,尚无相关研究报告。为此,我们通过建立低压低氧小鼠肾损伤模型,利用腺相关病毒载体过表达PPARγ基因,探讨过表达PPARγ基因对小鼠缺氧性肾损伤的干预效果及作用机制。
1 材料和方法
1.1 实验动物 15只4周龄雄性C57BL/6小鼠,体重15~20 g,购买于长沙市天勤生物技术有限公司[许可证号:SCXK(湘)2019-0014],饲养于广西医科大学实验动物中心的无特定病原体动物饲养间,室温20℃~25℃,湿度50%,明暗交替周期12 h,标准饲料喂养,自由进水、进食。本研究动物实验操作均符合广西医科大学动物伦理委员会审查标准。
1.2 实验分组与处理 按抽签法将15只小鼠随机分为对照组、缺氧组和过表达组,每组5只。适应性喂养1周后,以尾静脉注射的方式给予过表达组小鼠单次注射过表达PPARγ基因的腺相关病毒200 μL,缺氧组和对照组注射等体积生理盐水,实验所用过表达PPARγ基因的腺相关病毒由和元生物技术(上海)股份有限公司设计和构建。注射3周后将缺氧组和过表达组小鼠置于低压低氧动物实验舱(上海塔望智能科技有限公司,型号:ProOx-810L)。参照Chhabra等[11]的研究设置条件,即模拟海拔高度为7 500 m(氧分压约8 kPa)的环境,舱内设置充足饮水和食物,持续缺氧环境喂养7 d;对照组无特殊处理,常压环境喂养7 d。7 d后即刻以5%水合氯醛按0.1 mL/10 g麻醉小鼠并取双侧肾脏,一部分置于4%多聚甲醛,用于制作病理切片、HE染色、过碘酸希夫(periodic acid-Schiff,PAS)染色、Masson染色以观察病理学变化;另一部分置于-80℃冰箱中保存,用于蛋白质印迹实验和实时荧光定量PCR实验。取材完毕后颈椎脱臼处死小鼠。
1.3 肾组织病理学观察 将多聚甲醛固定至少1 h的肾组织依次经过脱水、透明、浸蜡、包埋、切片,制成石蜡切片。将石蜡切片分别按HE染色试剂盒(北京索莱宝公司、批号:G1120)、PAS染色液试剂盒(北京索莱宝公司、批号:G1281)、Masson三色染色试剂盒(北京索莱宝公司、批号:G1340)染色并脱水封片,于光学显微镜下观察各组小鼠肾组织病理改变。
1.4 mRNA表达检测 取各组小鼠肾脏组织磨碎,按RNA提取试剂盒(南京诺唯赞公司,批号:RC112-01)以离心柱法提取总RNA,以此为模板分别用引物扩增,引物序列物由生工生物工程(上海)有限公司设计并合成,序列见表1。按逆转录试剂盒说明书(南京诺唯赞公司,批号:R333-01)逆转录成cDNA,在ABI 7500型PCR仪上进行实时荧光定量PCR扩增,检测荧光强度并计算相对表达量。PCR反应体系包括2×ChamQ Universal SYBR qPCR Master Mix 10.0 μL、上下游引物(10 μmol/L)各0.4 μL、cDNA 2.0 μL、无酶水7.2 μL。反应程序:95℃预变性30 s;95℃、10 s,60℃、34 s循环40次;95℃、15 s,60℃、1 min,95℃、15 s熔解曲线。采用2-ΔΔCt计算目的基因相对表达量。

表1 基因引物序列
1.5 蛋白表达检测 取各组小鼠肾组织磨碎,按十二烷基硫酸钠蛋白裂解液说明书(上海碧云天公司,批号:P0013G)提取总蛋白,二喹琳甲酸法(赛默飞世尔公司,批号:23235)检测蛋白浓度。添加上样缓冲液并煮沸变性后行12.5%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,湿转法转印至聚偏氟乙烯膜后用5%脱脂奶粉室温封闭1.5 h,放入分别含兔抗小鼠的PPARγ(Signalway Antibody公司,批号:49371)、MLKL(Abcam 公司、批号:ab184718)、TGF-β(Signalway Antibody公司,批号:48569)、β-肌动蛋白抗体(Signalway Antibody公司、批号:21800)4℃摇床过夜,一抗稀释倍数均为1∶1 000,用TBST洗膜3次,10 min/次;再用辣根过氧化物酶标记的山羊抗兔IgG抗体(Signalway Antibody公司,批号:L3012)常温避光摇床孵育1 h,二抗稀释倍数为1∶5 000,TBST洗膜3次,10 min/次。在FluorChem M成像系统上用增强化学发光法测定条带灰度值,以β-肌动蛋白为内参并用AlphaView软件分析计算目的蛋白相对表达量。
1.6 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用SNK-q法。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组小鼠肾组织病理切片染色情况得比较 (1)HE染色显示:与对照组比较,缺氧组小鼠肾组织中部分肾小管管腔变形、闭塞、堵塞,管腔内出现透明均染物质,肾小管细胞肿胀,部分颗粒变性;与缺氧组比较,过表达组小鼠肾组织病变程度较低,肾小管无明显狭窄,部分肾小管细胞肿胀。(2)PAS染色显示:与对照组比较,缺氧组小鼠肾组织中肾小管管腔内有坏死细胞碎片,部分肾小管管腔内基底膜消失;与缺氧组比较,过表达组肾小管管腔未见明显碎片。(3)Masson染色显示:与对照组比较,缺氧组小鼠肾间质有明显纤维组织增生;与缺氧组比较,过表达组小鼠肾间质纤维增生不明显。见图1。
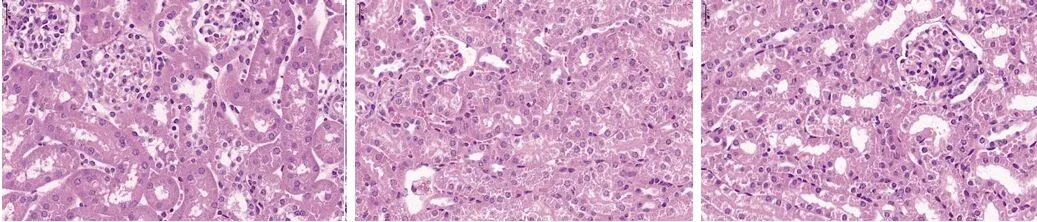
对照组HE染色 缺氧组HE染色 过表达组HE染色
2.2 3组小鼠肾组织PPARγ、MLKL、TGF-β mRNA相对表达量的比较 与对照组相比,缺氧组小鼠肾组织PPARγ mRNA相对表达量下降,MLKL、TGF-β mRNA相对表达量均升高(均P<0.05);与缺氧组相比,过表达组小鼠肾组织PPARγ mRNA相对表达量升高,MLKL、TGFβ mRNA相对表达量均下降(均P<0.05)。见表2。
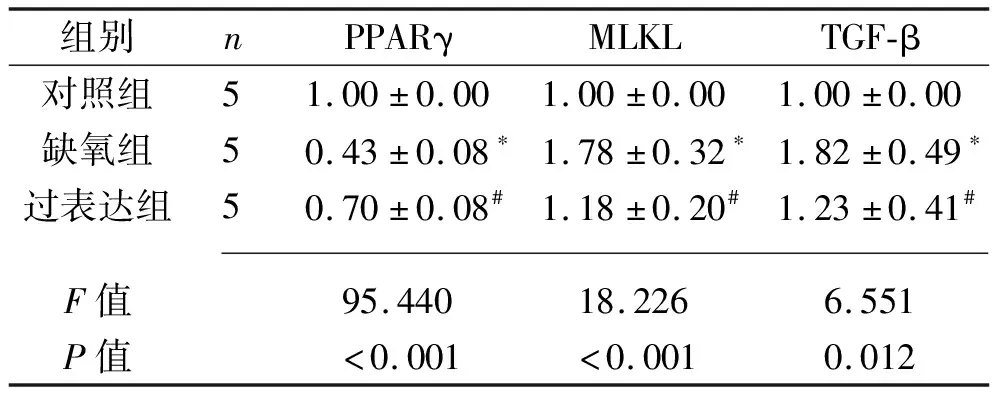
表2 3组小鼠肾组织PPARγ、MLKL、TGF-β mRNA相对表达量的比较(x±s)
2.3 3组小鼠肾组织PPARγ、MLKL、TGF-β蛋白相对表达量的比较 与对照组相比,缺氧组小鼠肾组织中PPARγ蛋白相对表达量下降,MLKL、TGF-β蛋白相对表达量升高(均P<0.05);与缺氧组相比,过表达组小鼠肾组织PPARγ蛋白相对表达量升高,MLKL、TGF-β蛋白相对表达量均下降(均P<0.05)。见表3和图2。
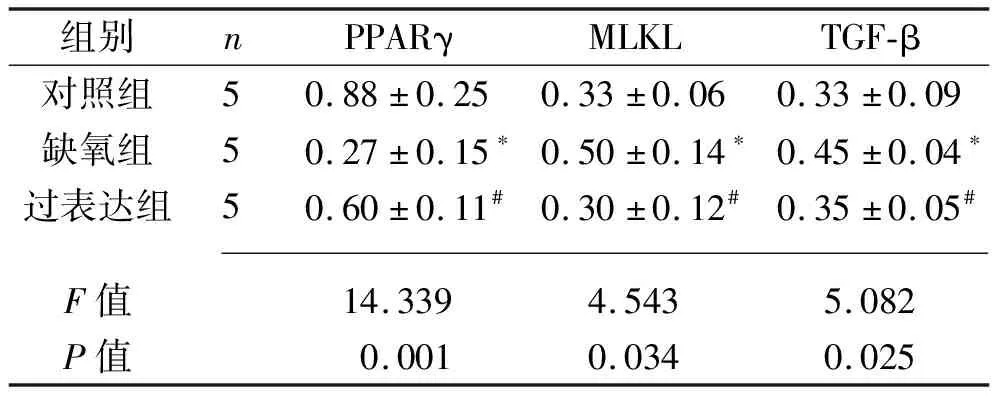
表3 3组小鼠肾组织中PPARγ、MLKL、TGF-β蛋白相对表达量的比较(x±s)

图2 蛋白电泳图
3 讨 论
由于自身解剖特点,肾脏极易发生缺氧性损伤[2]。肾脏的急性缺氧损伤主要是由肾灌注不足导致的,表现为肾小球滤过率骤然降低;急性肾损伤后毛细血管稀疏进一步加重了肾组织缺氧程度,缺氧又会进一步导致肾小管上皮损伤、成纤维细胞活化以及炎症细胞的浸润,从而导致肾小管间质纤维化[3,12],这是急性肾损伤发展成为慢性肾脏病的标志[13]。本实验中,我们利用低压低氧动物实验舱人为制造低氧环境,建立小鼠系统性缺氧模型,结果显示缺氧组小鼠肾组织中肾小管狭窄闭塞、肾间质纤维化增生,肾脏损伤标志物TGF-β的表达明显增高,这提示小鼠缺氧性肾损伤模型建立成功。
PPARγ的基本功能是调节脂肪和糖代谢[14-15],但近年来越来越多的研究显示PPARγ对缺氧缺血性脑损伤、动脉粥样硬化、肺纤维化等疾病均有保护作用[16-18]。在肾脏疾病方面,PPARγ不仅可以通过上调解偶联蛋白1的表达以抑制缺血再灌注或顺铂诱导的急性肾损伤[19],还可以通过活化磷酸酶-张力蛋白同源物以抑制肾间质成纤维细胞活化而减轻肾纤维化[20]。我们的前期研究显示,缺氧诱导的肾小管上皮细胞损伤模型中PPARγ表达明显降低[21]。本研究中,缺氧组小鼠肾组织中的PPARγ mRNA与蛋白相对表达量均较对照组明显降低(均P<0.05)。上述研究表明,PPARγ表达水平与肾损伤密切相关。因此,我们推测过表达PPARγ或许对缺氧性肾损伤具有干预作用。本研究结果显示,过表达组小鼠肾小管狭窄闭塞程度明显减轻,未见明显的肾间质纤维化,且肾组织中的TGF-β表达明显降低,这提示过表达PPARγ基因可减轻小鼠缺氧性肾损伤。
在肾脏缺氧损伤的过程中,细胞坏死性凋亡扮演了重要角色,Shen等[6]研究发现,坏死性凋亡特异性抑制剂Necrostatin-1可以使人肾皮质近曲小管上皮HK2细胞抵抗缺氧损伤,也可减轻大鼠缺血再灌注损伤。Liao等[7]研究发现,抑制坏死性凋亡可以减轻缺血再灌注后的急性肾损伤。我们的前期研究也发现,缺氧诱导的肾小管上皮细胞会高表达受体交互作用蛋白3等坏死性凋亡特异性标志物[10]。本研究中,缺氧组小鼠肾脏组织MLKL的mRNA与蛋白相对表达量较对照组均明显增高,这提示缺氧性肾损伤可能是通过肾脏细胞坏死性凋亡所导致。而关于PPARγ的表达变化对坏死性凋亡的影响,不少学者对此进行了探讨,Peng等[22]研究发现,PPARγ激动剂罗格列酮可降低心肌细胞坏死性凋亡,从而减轻盲肠结扎穿刺引起的败血症性心肌功能障碍;Huang等[23]研究报告,在低糖诱导的脑损伤中,PPARγ抑制剂可以通过抵抗二十二碳六烯酸的神经保护作用而增加神经细胞坏死性凋亡。本研究结果显示,相比于缺氧组,过表达组小鼠肾组织PPARγ的mRNA与蛋白相对表达量升高,而MLKL的mRNA与蛋白相对表达量降低,这提示过表达PPARγ基因或可减少肾脏细胞坏死性凋亡,从而减轻小鼠的缺氧性肾损伤。
综上所述,过表达PPARγ基因可减轻小鼠的缺氧性肾损伤,其机制可能与减少肾脏细胞坏死性凋亡有关。因此,PPARγ有望成为缺氧性肾损伤新的治疗靶点。
