miR-136-5p靶向P4HB抑制肾癌细胞增殖、迁移和侵袭的研究
2022-06-15李晓璐
李晓璐
肾癌是我国10种最常见的癌症之一,其中90%是由肾细胞癌引起的。早期或局部的肾癌患者在接受部分或根治性肾切除术治疗后的5年生存率为92.6%[1]。但是,有近30%的肾癌患者在确诊时已发生转移,此时即使患者接受肾切除术仍会复发[2]。尽管可以使用药物来治疗转移性肾癌,但大多数患者最终仍会死亡。因此,为了获得更好的肾癌早期诊断、治疗策略,迫切需要对肾癌发生转移的机制进行更深入的探究。微小RNA(MicroRNAs,miRNAs)在癌症中的作用已得到世界的普遍认可,但仍有部分新发现的miRNA在生物中的功能有待开发。miR-136-5p在多种癌症中的功能均有报道[3],但是其在肾癌中的功能研究有待丰富。脯氨酰4-羟化酶,β-多肽(Prolyl 4-hydroxylase,β-polypeptide,P4HB)是一种内质网分子伴侣蛋白,其在多种肿瘤中高表达,参与癌症的恶性进展过程和患者的不良预后[4]。但是笔者发现其在肾癌中发挥功能是否与miR-136-5p存在相关性尚未清楚。本研究将以肾癌细胞为研究对象,观察过表达miR-136-5p、P4HB对肾癌细胞增殖、迁移和侵袭的影响,揭示miR-136-5p与P4HB之间的靶向关系,以期为肾癌的早期诊断、治疗提供新靶点。
1 材料与方法
1.1 材料 组织样本来自本院2019年1月至2021年2月行手术切除的30例肾癌患者的癌组织及正常组织。所有患者及家属签署知情同意书。正常肾细胞(HK2)、肾癌细胞(ACHN)、786-O、769-P和Caki-1细胞均购自美国菌种保藏中心;侵袭实验(Transwell)小室购自美国Corning;细胞计数试剂盒(CCK8)试剂盒购自日本同仁化学研究所;荧光素酶报告基因检测试剂盒购自美国Promega公司;流式细胞仪购自美国贝克曼公司。
1.2 方法
1.2.1 细胞培养:HK2、ACHN、786-O、769-P和Caki-1细胞培养所用培养基为混有15%胎牛血清的DMEM培养基;环境条件为:5%CO2,95%空气,饱和湿度的37℃恒温。每2天传代1次。
1.2.2 细胞处理与分组:将组织块无菌条件下充分研磨,分装,分别标记为正常组织组合癌组织组,-20℃保存备用;将培养48 h的HK2、ACHN、786-O、769-P和Caki-1细胞分别标记为HK2组、ACHN组、786-O组、769-P组和Caki-1组,筛选最合适的细胞用于实验研究。将miR-NC、miR-136-5p mimics、pcDNA、pcDNA-P4HB、miR-136-5p mimics+pcDNA、miR-136-5p mimics+pcDNA-P4HB用脂质体法分别转染至ACHN细胞,标记为miR-NC组、miR-136-5p mimics组、pcDNA组、pcDNA-P4HB组、miR-136-5p mimics+pcDNA组、miR-136-5p mimics+pcDNA-P4HB组。所有实验独立重复3次,每次做3个重复。
1.2.3 RT-qPCR实验:将待检测的细胞培养至48 h后,收集细胞,提取各组细胞的总RNA,并逆转录成cDNA。以cDNA为模板,用RT-qPCR试剂盒,检测其中miR-136-5p、P4HB的表达情况。所用引物为:miR-136-5p,上游引物ACTCCATTTGTT TTGATGATGGA,下游引物CCAGTGCAGGGTCCGAGGT;P4HB,上游引物GGAATGG AGACACGGCTTC,下游引物TTCAGCCAGTTCACGATG TC;U6、GAPDH为通用引物。所有实验独立重复3次,每次做3个重复。
1.2.4 CCK8实验:收集待检测的细胞,将细胞调至2×105个/ml。取100 μl置于酶标板孔中,再加入CCK8溶液充分混合,避光反应。结束后,将酶标板置于490 nm波长的酶标仪下检测细胞的吸光值。细胞增殖率(%)=OD实验/OD对照×100%。所有实验独立重复3次,每次做3个重复。
1.2.5 Transwell实验:将需要检测的各组细胞转染或培养48 h后,用无血清的DMEM培养基使细胞饥饿培养12 h。用胰酶消化并用含10%胎牛血清的DMEM培养基悬浮细胞,以1 000 r/pm离心5 min,除去上清液,再将细胞浓度调节至1×105个细胞/ml。在每个Transwell小室的上层中用含有1%胎牛血清的DMEM培养基的细胞悬液(100 μl),在下层中添加10%胎牛血清的DMEM培养基(600 μl),在5%CO2、95%空气、37℃的饱和湿度恒温培养箱中放置12 h。用甲醇固定、结晶紫染色后,对迁移、侵袭的细胞数进行计数。注意用含有基质胶的Transwell小室检测细胞的侵袭能力,不含基质胶的小室检测细胞的迁移能力。所有实验独立重复3次,每次做3个重复。
1.2.6 荧光素酶报告实验:将含有野生型(WT或突变体MUT)的miR-136-5p结合位点的P4HB 3’UTR核苷酸克隆到pGL3荧光素酶报道质粒载体。将ACHN细胞接种在24孔板中,培养24 h,然后将细胞与WT或MUT报告质粒共转染。转染后48 h后,使用荧光素酶报告基因检测试剂盒检测细胞的荧光素酶活性,完成荧光素酶的测定。所有实验独立重复3次,每次做3个重复。

2 结果
2.1 miR-136-5p在肾癌组织、细胞中的表达 运用RT-qPCR法检测组织和细胞中miR-136-5p的表达情况,与正常组织比较,肾癌组织中 miR-136-5p的表达显著降低(P<0.05);与HK2细胞比较,ACHN、786-O、769-P、Caki-1细胞中miR-136-5p的表达均显著降低(P<0.05)。可见,miR-136-5p在肾癌中低表达。见表1、2。

表1 miR-136-5p在肾癌组织中的表达
2.2 过表达miR-136-5p对肾癌细胞增殖和侵袭的调节 通过CCK8实验和Transwell实验检测细胞的增殖、迁移和侵袭,与miR-NC组比较,miR-136-5p mimics组ACHN细胞中miR-136-5p的表达量显著升高(P<0.05),细胞增殖率、迁移个数和侵袭个数均显著降低(P<0.05)。见图1,表3。
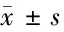
表2 miR-136-5p在肾癌细胞中的表达

图1 ACHN细胞的迁移侵袭图(结晶紫染色×200)

表3 过表达miR-136-5p的ACHN细胞增殖、侵袭
2.3 miR-136-5p靶向P4HB 通过在线预测网站http://starbase.sysu.edu.cn中预测到miR-136-5p与P4HB之间存在连续的6个互补结合位点。荧光素酶报告实验显示,miR-136-5p与P4HB 3’UTR WT之间的荧光素酶活性显著降低(P<0.05),其他处理组细胞的荧光素酶活变化不显著。miR-136-5p与P4HB在肾癌组织中的表达关系式为Y=-3.477·X+3.522,二者呈负相关(P<0.01)。见表4,图2。

表4 荧光报告基因检测实验结果

图2 miR-136-5p与P4HB的结合位点及二者在肾癌组织中表达的关系;A miR-136-5p与P4HB存在的互补结合点;B miR-136-5p与P4HB在肾癌组织中的相关性
2.4 P4HB在肾癌细胞中的表达 与正常组织比较,癌组织中 P4HB的表达显著升高(P<0.05);与HK2细胞比较,ACHN、786-O、769-P细胞中P4HB表达均显著升高(P<0.05)。可见,P4HB在肾癌中高表达。见表5、6。

表5 P4HB在肾癌组织中的表达
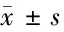
表6 P4HB在肾癌细胞中的表达
2.5 过表达P4HB对肾癌细胞增殖和侵袭的调节 与pcDNA组比较,pcDNA-P4HB组ACHN细胞中P4HB表达显著升高(P<0.05),细胞增殖率、迁移数量和侵袭数量均显著升高(P<0.05)。见图3,表7。

图3 过表达P4HB的ACHN细胞迁移侵袭图(结晶紫染色×200)

表7 过表达P4HB的肾癌细胞的增殖、迁移和侵袭
2.6 过表达P4HB部分逆转过表达miR-136-5p对肾癌细胞增殖侵袭的作用 与miR-NC组比较,miR-136-5p mimics组ACHN细胞中miR-136-5p的表达量显著升高,细胞增殖率、迁移数量和侵袭数量均显著降低(P<0.05);与miR-136-5p+pcDNA组比较,miR-136-5p+pcDNA-P4HB组ACHN细胞中miR-136-5p的表达量显著降低,细胞增殖率、迁移数量和侵袭数量均显著升高(P<0.05)。可见,过表达P4HB可部分逆转过表达miR-136-5p对ACHN细胞增殖、迁移侵袭的调控作用。见图4,表8。

图4 ACHN细胞的迁移侵袭图(结晶紫染色×200)

表8 过表达P4HB联合过表达miR-136-5p的肾癌细胞的增殖、侵袭
3 讨论
关于miRNA在肿瘤中的调控机制的研究已成为该领域的热点。miR-136-5p在多种癌症中发挥抑制癌症恶化的作用,如胃癌、口腔鳞状细胞癌、乳腺癌、肺癌和肾癌等[5-8]。但是miR-136-5p在肾癌中的功能及调控机制的探究仍处于初级阶段,有待进一步研究。Chen等[9]在对肾癌的研究中报道,与邻近的非肿瘤组织和细胞相比,miR-136-5p在肾癌组织和细胞中的表达明显降低,说明miR-136-5p还与肾癌细胞的增殖、迁移、侵袭和凋亡有关,即miR-136-5p以自身的功能在肾癌的恶性进展中发挥抑制作用,暗示miR-136-5p具有作为肾癌早期诊断和预后的生物标志物的潜力。Li等[10]在研究中报道,miR-136-5p可作为circTLK1的吸附剂,还可靶向CBX4基因,调控肾癌细胞的细胞表型变化,揭示circTLK1通过吸附miR-136-5p上调CBX4表达从而在肾癌的恶性进程中发挥关键作用,再次证明miR-136-5p在肾癌的发生发展中的重要作用。
本研究检测了肾癌组织和正常组织、肾癌细胞和HK2细胞中miR-136-5p的表达,结果发现miR-136-5p在癌组织和癌细胞中的表达水平均异常的降低,并且过表达miR-136-5p后,肾癌细胞的增殖、迁移和侵袭能力均发生明显的抑制,这与Chen等[9]的研究结果完全一致。进一步研究,通过荧光素酶报告实验发现,miR-136-5p与P4HB之间存在靶向结合位点,并且miR-136-5p在肾癌组织中的表达水平与P4HB的表达水平呈负相关,推测这可能与miR-136-5p在肾癌中发挥作用的机制有关。
P4HB是脯氨酰4-羟化酶β亚基中的中枢基因之一,属于蛋白质二硫键异构酶家族。P4HB是一种高度丰富的多功能酶,可充当内质网分子伴侣以抑制错误折叠的蛋白质聚集[11,12]。P4HB在多种癌症中表达异常升高,与患者的不良预后、存活率低和放化疗抗性有关[13],但是其在肾癌中的功能及上有调控机制尚未清楚。Xie等[14]研究发现,P4HB的表达水平在肾癌组织和肾癌细胞中存在异常上调,并且与肾癌患者较差的总体生存率具有明显的相关性。
Zhu等[15]报道,P4HB和蛋白在透明细胞肾细胞癌中的表达均明显高于临近的正常组织,并且这种异常的高表达还与患者的不良预后显著相关。本研究检测了肾癌组织和肾癌细胞中P4HB的表达发现,P4HB的表达水平均明显上调,这与Xie等[14,15]的实验结果相吻合。此外,本研究还通过构建过表达P4HB的肾癌细胞检测其增殖、迁移、侵袭情况发现,过表达P4HB明显抑制肾癌细胞的增殖、迁移和侵袭,这为探究P4HB在肾癌中发挥致癌作用的具体机制奠定了基础,有助于P4HB用于肾癌的早期诊断、预后。深入探究发现,过表达P4HB还逆转miR-136-5p对肾癌细胞增殖迁移侵袭的抑制作用。
综上所述,miR-136-5p抑制肾癌细胞的增殖、迁移和侵袭,产生这种作用的机制与靶向抑制P4HB有关,为肾癌的精准治疗提供新的潜在靶点。
