基于45S rDNA-FISH的异源三倍体‘银中杨’小孢子母细胞减数分裂染色体行为追踪*
2022-06-15王律几张晓晓
王律几 张晓晓 王 君
(北京林业大学林木育种国家工程实验室 林木花卉遗传育种教育部重点实验室 北京林业大学生物科学与技术学院 北京 100083)
植物三倍体在减数分裂过程由于复杂的染色体联会,往往出现染色体不平衡分离、染色体落后甚至丢失等高度异常的染色体行为,对配子育性造成严重影响(Sergioetal., 1999; Asano, 1982; Limetal., 2000)。在百合(Liliumbrownii)、矮牵牛(Petuniahybrida)、黄瓜(Cucumissativus)等植物的三倍体物种小孢子母细胞减数分裂中期I均有单价体、二价体和三价体共存的现象(封紫等, 2012; 魏跃等, 2020; 刁卫平等, 2009)。吕晔等(2018)在三倍体‘赞皇大枣’(Ziziphusjujuba‘Zanhuang Dazao’)小孢子母细胞中观察到一定比例落后染色体、微核、姊妹染色单体提前分离等现象,这些异常的染色体行为可能导致配子遗传物质缺失。然而,对于整体染色体行为的观察已不满足植物细胞遗传学研究的发展需要,探讨特定染色体在减数分裂过程中的行为更具研究价值。随着分子细胞遗传学的发展,荧光原位杂交技术(Fluorescenceinsituhybridization, FISH)可实现染色体的识别和定位,逐渐被应用于植物减数分裂过程染色体行为的研究。Zhao等(2019)利用FISH技术发现二倍体黄瓜杂种(HC,2n= 2x= 19)存在H染色体组非同源染色体间发生配对现象,且异源四倍体黄瓜(Cucumis×hytivus, HHCC,2n= 4x= 38)的H染色体组比C染色体组具有更高频的单价体和落后染色体。在甘蔗与斑茅草杂交种(Saccharumofficinarum×Erianthusarundinaceus)中5S rDNA所在染色体在减数分裂过程中分离不平衡,导致四分体子核中可能存在2~5个信号,并且在第二次减数分裂过程中发现有45S rDNA信号丢失的现象(Lietal., 2021)。显然,FISH技术已成为追踪植物减数分裂过程中特定染色体行为的可靠手段。
‘银中杨’(Populusalba×P.berolinensis‘Yinzhong’, 2n = 3x = 57)是以银白杨(P.alba)为母本,中东杨(P.berolinensis)为父本,人工杂交选育的优良三倍体雄性无性系(沈清越等, 1985; 陈成彬, 2004),因其生长迅速、抗逆性强而广泛栽种于我国东北、西北和华北等地区(范竹珊等, 2000)。Wang等(2017a)利用常规压片法对‘银中杨’小孢子母细胞减数分裂过程的染色体行为进行了观察,发现染色体提前分离、落后染色体、微核和纺锤体定向紊乱等大量染色体异常行为,然而对于特定染色体在减数分裂过程中的行为仍不明确。因此,本研究以‘银中杨’为材料,在筛选其小孢子母细胞最适酶解制片条件的基础上,通过45S rDNA探针的FISH定位,对45S rDNA探针信号在减数分裂过程的分布进行了详细统计与分析,为杨树异源三倍体减数分裂染色体配对和分离的行为追踪提供了研究思路和技术支撑。
1 材料与方法
1.1 材料
‘银中杨’花枝采集于内蒙古通辽市,运至北京林业大学温室(10~20 ℃)水培。用卡诺固定液(V(乙醇):V(乙酸)= 3∶1)分批固定花芽,浸于70%乙醇中,-20 ℃保存。
1.2 方法
1.2.1 小孢子母细胞染色体制片 将小孢子母细胞处于减数分裂过程的花药用镊子取下,蒸馏水清洗3次,每次5 min,移至不同浓度纤维素酶(Cellulase R-10)与果胶酶(Pectolyase Y-23)混合酶液(表1)中,酶解2.5 h,常规醋酸洋红染色压片法制片观察以筛选最适酶液组合。在此基础上,再以最适酶液组合将花药分别酶解1.5、2、2.5、3、3.5 h,以筛选最佳酶解时间。以筛选的最适酶液组合和酶解时间进行酶解处理,压片法制片,经冰冻揭盖片后,-20 ℃保存备用以作原位杂交分析。
1.2.2 原位杂交 将冻存的玻片置于100 μg·mL-1RNA酶中37 ℃处理1 h; 转入5 μg·mL-1胃蛋白酶溶液中37 ℃处理40 min; 2×SSC洗脱3次,每次3 min,移至4%多聚甲醛中室温处理10 min; 2×SSC洗脱3次,每次3 min; 70%、90%、100%乙醇梯度脱水各3 min,气干。
含有45S rDNA基因重组质粒的大肠杆菌(Escherichiacoli)来源于北京市农林科学院王桂香老师馈赠,通过地高辛缺口平移试剂盒(Roche, No. 11745816910)标记。
FISH方法参考Cao等(2019)并略作修改。探针杂交液包含50%去离子甲酰胺(Deionized Formamide, FAD)、10%硫酸葡聚糖(Dextran Sulfate, DS)、2×SSC、0.25%十二烷基硫酸钠(Sodium Dodecyl Sulfate, SDS)和0.5 ng·μL-1的DNA探针。经20 μg·mL-1Anti-digoxigenin-fluorescein(Roche, No. 11207741910)处理后,用DAPI(4′, 6- diamidino- 2- phenylindole)复染。在Olympuc BX53荧光显微镜下观察,并用蔡司Meta Systems Isis荧光成像分析系统拍照。每个时期统计50个细胞以上。
2 结果与分析
2.1 ‘银中杨’花粉母细胞染色体制片技术优化
将‘银中杨’花药置于16种不同配方的酶液中酶解2.5 h后,制备细胞悬液,采用常规压片法进行制片观察,比较细胞解离情况(表1)。其中,第1至6号处理制片中存在大块未被酶解的花药组织,与部分小孢子母细胞杂糅交叠,难以获得游离的小孢子母细胞。第7和8号处理制片中存在部分未被彻底酶解的花药细胞团,小孢子母细胞解离情况一般,细胞质较厚,染色体分散程度差(图1a—g)。第10至12号处理制片中存在少部分花药细胞团,小孢子母细胞交叠情况偶有发生,细胞质较薄,染色体分散程度一般。第14号处理的酶解效果较好,制片中小孢子母细胞解离良好且细胞质较薄,染色体较清晰。尽管第15和16号处理制片中细胞解离程度良好,但小孢子母细胞酶解过度,从而细胞破裂,导致染色体不完整(图1h)。
为获得更好的制片效果,利用第14号酶液组合对酶解时间进行了进一步研究。结果表明,酶解1.5 h制片中有较多大块花药组织,大部分花粉母细胞存在重叠现象,游离的花粉母细胞较少。酶解3 h时制片效果最佳,细胞解离程度良好,细胞质薄,背景干净,染色体形态清晰而分散(图1i—p)。酶解3.5 h时花粉母细胞破裂,染色体丢失。
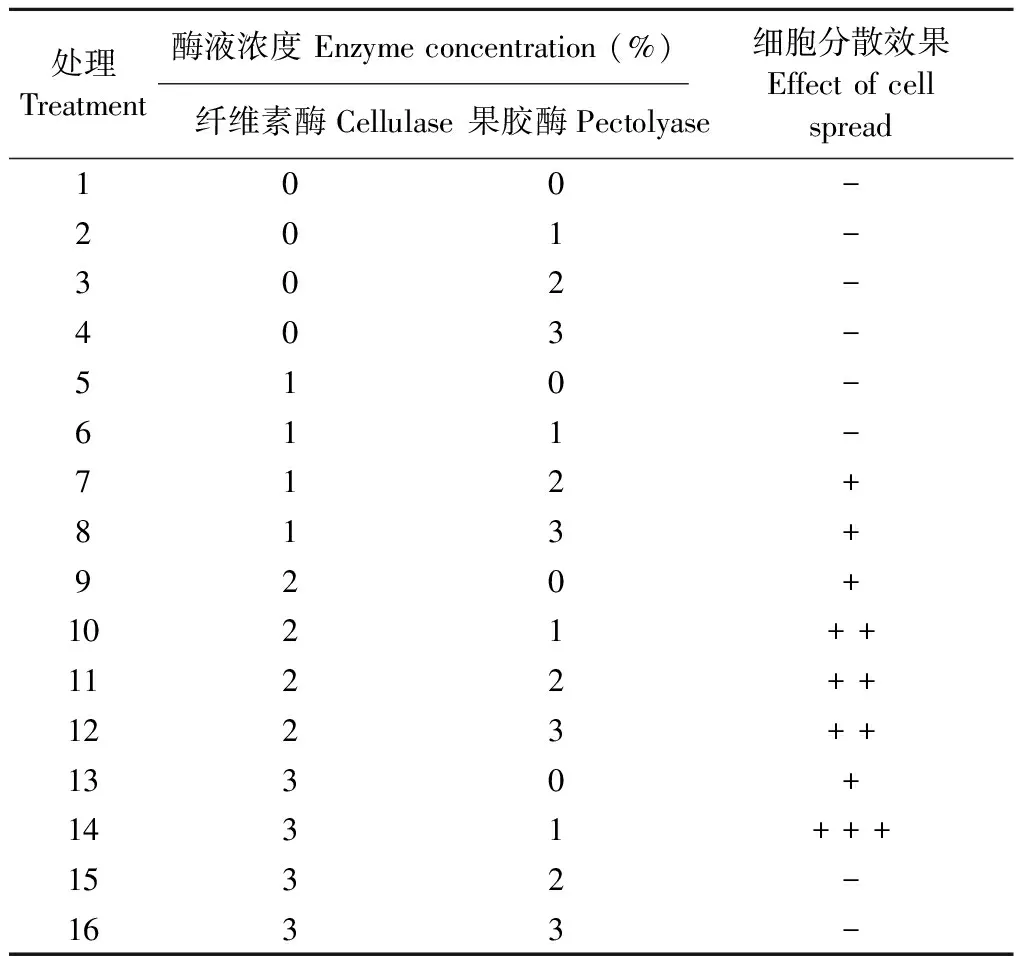
表1 不同酶液配方对‘银中杨’花药的酶解效果①Tab.1 Enzymatic hydrolysis effects of different cellulase and pectinase concentrations on the anthers of Populus alba × P. berolinensis ‘Yinzhong’
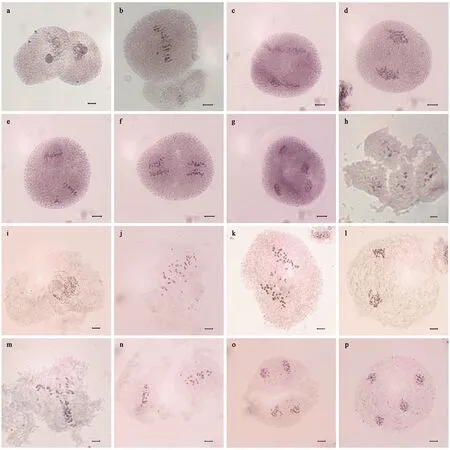
图1 不同酶解处理的‘银中杨’小孢子母细胞减数分裂染色体制片比较Fig.1 Meiotic chromosome preparation of Populus alba × P. berolinensis ‘Yinzhong’ pollen mother cells (PMCs) treated with different enzymesa—g: 37 ℃下在1% 纤维素酶+2% 果胶酶混合酶液中处理2.5 h后的小孢子母细胞; h: 酶解过度而破裂的小孢子母细胞; i—p: 37 ℃下在3% 纤维素酶+1% 果胶酶混合酶液中处理3 h后的小孢子母细胞。标尺等于10 μm。a-g: Pollen mother cell were digested with 1% cellulase +2% pectinase at 37 ℃ for 2.5 h; h: Pollen mother cell ruptured by excessive enzymolysis; i-p: Pollen mother cells were digested with 3% cellulase+1% pectinase at 37 ℃ for 3 h. Bars are equal to 10 μm.
因此,‘银中杨’花药在37 ℃下以3%纤维素酶+1%果胶酶混合液酶解3 h可获得良好的制片效果,适于进行FISH分析。
2.2 45S rDNA探针信号在减数第一次分裂过程的分离规律
通过FISH技术对‘银中杨’小孢子母细胞减数分裂各时期染色体上的45S rDNA探针信号进行了定位和统计(表2)。在粗线期细胞中探针信号清晰可见(图2a)。在中期I细胞中,可观察到3个45S rDNA探针信号分布于3条同源染色体上。基于153个中期I分裂相的信号定位统计,发现此3条同源染色体的配对主要呈现为三价体形式(图2b),约占69.28%; 此外,在28.10%的细胞中,表现为II+I的配对形式(图2c),在2.61%的细胞中表现为I+I+I的3个单价体存在的形式(图2d)。
45S rDNA探针信号所在染色体在‘银中杨’小孢子母细胞减数分裂后期I呈现出复杂的不平衡分离模式,主要包括5种类型: 第一种为2/1分离类型,即两个45S rDNA探针信号定位到纺锤体的一极,一个信号定位在另一极(图2e),表明有一极有2条同源染色体,另一极只有1条同源染色体,约占所观察细胞的83.90%; 第二种为3/0分离类型,即3个探针信号定位在同一极(图2g),表明3条同源染色体在后期I未发生分离,约占3.39%; 第三种为2/0+1分离类型,即两个45S rDNA探针信号定位到一极,另一个信号位于落后染色体上(图2f),表明两条同源染色体移动到了同一极,另一条同源染色体未能及时移动而成为落后染色体,该类型约占3.39%; 第四种为1/1+1分离类型,即两极各存在1个探针信号,另一个信号位于落后染色体上,表明两极各具有1条同源染色体,另一条同源染色体在分离时成为落后染色体,该类型约占5.93%; 第五种为1/0+2分离类型,即1个探针信号位于纺锤体一极,另一极无信号,有2个信号位于落后染色体上,表明只有1条同源染色体正常移动到一极,其余2条同源染色体均成为落后染色体,该类型约占3.39%。45S rDNA探针信号在末期I的2个子核中呈现松散弥散状态(图2 h; 图2i),信号在子核中数目除了正常的2/1型分离(约占93.44%)外,还存在1/1(图2i)、2/0、1/0等分离类型,分别占3.28%、1.64%和1.64%。

表2 ‘银中杨’小孢子母细胞减数分裂各时期的45S rDNA探针信号分布统计①Tab.2 Distribution of 45S rDNA signals in different stages of meiosis in pollen mother cells (PMCs) of Populus alba × P. berolinensis ‘Yinzhong’
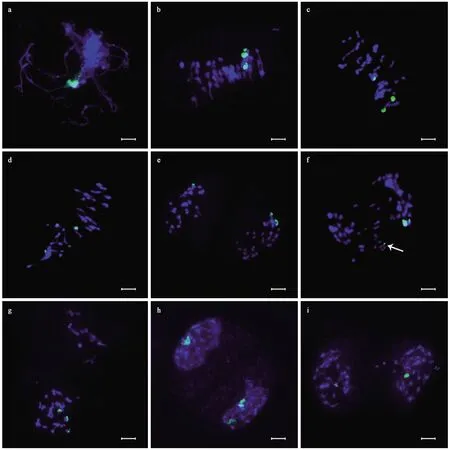
图2 45S rDNA信号在‘银中杨’小孢子母细胞减数第一次分裂各时期的分布Fig. 2 Distribution of 45S rDNA signals in different stages of meiosis I in pollen mother cells (PMCs) of Populus alba × P. berolinensis ‘Yinzhong’a: 粗线期; b—d: 中期I; b: 信号在三价体上; c: 信号定位于1个单价体和1个二价体上; d: 信号定位于3个单价体; e—g: 后期I; e: 2个信号定位在一极,1个定位在另一极; f: 2个信号在一极,另一个信号定位于落后染色体上; g: 3个信号定位在同一极,另一极无信号; h—i: 末期I; h: 一个子核中具有2个信号,另一个子核中具有1个信号; i: 2个子核中各具有1个信号。绿色为45S rDNA信号。白色箭头所指为信号所定位的落后染色体。标尺等于10 μm。a: Pachytene; b-d: Metaphase I; b: Signals localized on a trivalent; c: Signals localized on 1 univalent and 1 bivalent; d: Signals localized on 3 univalents; e-g: Anaphase I; e: 2 signals localized on one pole and 1 on the other; f: 2 signals on one pole and the other on a lagging chromosome; g: 3 signals are localized on the same pole and the other is no signal; h-i: Telophase I; h: 2 signals on 1 daughter nucleus and 1 signal on the other; i: 1 signal in each of the two daughter nuclei. 45S rDNA signal in green. The white arrow indicates the lagging chromosome where the signal is located. Bars are equal to 10 μm.

图3 45S rDNA信号在‘银中杨’小孢子母细胞减数第二次分裂各时期的分布Fig. 3 Distribution of 45S rDNA signals in different stages of meiosis II in pollen mother cells (PMCs) of Populus alba × P. berolinensis ‘Yinzhong’a—c: 中期II; a: 2个信号位于一组染色体上,1个信号位于另一组染色体上; b: 2组染色体上各具有1个信号,另一个信号位于细胞质中的微核染色体上; c: 2个信号位于一组染色体上,1个信号位于另一组染色体上,具有三极纺锤体的中期II细胞; d—f: 后期II; d: 4个纺锤体极分别有2个信号、2个信号、1个信号和1个信号; e: 2个信号定位于纺锤体一极,其余3个纺锤体极各具有1个信号,1个信号位于落后染色体上; f: 每一极各有1个信号; g—l: 末期II; g: 每个子核中分别有2个、2个、1个和1个信号; h: 每个子核中分别有2个、1个、1个和1个信号; i: 每个子核中分别有1个信号; j: 每个子核中分别有2个、1个、1个和1个信号,另一个信号位于微核上; k: 两个子核中各有3个信号; l: 3个子核中分别有3个、2个和1个信号。绿色为45S rDNA信号。白色箭头所指为信号所定位的落后染色体或微核。标尺等于10 μm。a-c: Metaphase II; a: 2 signals on one set of chromosomes and 1 on another; b: Each of the 2 sets of chromosomes has 1 signal, and the other signal is located on the micronucleus chromosome in the cytoplasm; c: 2 signals on 1 set of chromosomes, 1 signal on another set of chromosomes, metaphase II cells with tripolar spindle; d-f: Anaphase II; d: 4 spindles have 2 signals, 2 signals, 1 signal and 1 signal respectively; e: 2 signals are located at one pole of the spindle, the other three spindle poles each have 1 signal, and 1 signal is located on the backward chromosome; f: Each pole has 1 signal; g-l: Telophase II; g: There are 2, 2, 1 and 1 signals in each daughter nucleus; h: There are 2, 1, 1 and 1 signals in each daughter nucleus; i: There is 1 signal in each daughter nucleus; j: There are 2, 1, 1 and 1 signals in each subnuclei, and the other signal is located on the micronucleus; k: 3 signals in each of the two daughter nuclei; l: 3, 2 and 1 signals in each of the three daughter nuclei. Green is the 45S rDNA signal. The white arrow indicates the lagging chromosome or micronucleus where the signal is located. Bars are equal to 10 μm.
2.3 45S rDNA探针信号在减数第二次分裂过程的分离规律
45S rDNA探针信号在小孢子母细胞减数第二次分裂中的分离较减数第一次分裂更加复杂。对107个中期II细胞的45S rDNA探针信号数量和分离情况进行观察,可分为9种同源染色体分离类型(表2): 约有80.37%的细胞呈现为2/1分离类型,即2个探针信号位于中期II细胞的一组染色体上,1个探针信号位于另一组染色体上(图3a); 约1.87%的细胞呈现3/0分离类型,即3个探针信号在同一组染色体上,另一组染色体上未显示信号; 约3.74%的细胞呈现1/1+1分离类型,即2组染色体上各有1个探针信号,另一个探针信号定位于细胞质中的微核染色体上(图3b); 约2.80%的细胞呈现2/0+1分离类型,即2个探针信号在同一组染色体上,另一个探针信号定位于细胞质中的微核染色体上; 此外,还存在1/1、2/0、1/0、0/0+2、1/0+1等分离类型,分别占3.47%、2.80%、2.80%、0.93%和0.93%。
随后期II姊妹染色单体的分离,位于姊妹染色单体上的2个45S rDNA探针信号也随之分离,大多数细胞呈现出2/2/1/1的分离类型(图3d),即4个纺锤体极分别包含2个、2个、1个和1个信号,占后期II观察细胞总数的约73.08%。同时,还存在部分3/1/1/1分离类型的细胞,推测可能有一对姊妹染色单体未正常分离,约占5.77%; 2/2/1/0+1和2/1/1/1+1(图3e)等1个信号定位于落后染色体上的分离类型各占5.77%,推测姊妹染色单体中的1条存在分离滞后的现象。此外,约有9.61%的后期II细胞中仅可观察到2~4个45S rDNA探针信号(图3f)。
在末期II细胞中,随染色体的逐渐解螺旋,45S rDNA探针信号也逐渐松散。通过对100个末期II细胞的观察统计发现,约63%的细胞中探针信号呈2/2/1/1分离类型(图3g),即在正常末期II细胞的4个分散的子核中分别包含1~2个探针信号。同时,也统计到一些特殊的染色体分离类型,其中2/2/2/0和3/2/1/0的分离类型各占约1%和2%; 在约5%的末期II细胞中,观察到部分45S rDNA探针信号定位于微核上(图3j),推测其可能由包含探针信号的落后染色体发育而来。此外,在约18%的末期II细胞中,仅观察到2~5个探针信号(图3h—i)。
‘银中杨’小孢子母细胞减数分裂末期II存在核融合的情况,经胞质分裂可能形成二分体和三分体。其中,在具2个融合核的二分体细胞中,探针信号呈现出4/2、3/3(图3k)、4/1和3/2+1的分离类型,分别占统计末期II细胞数的2%、3%、1%和1%。对于具1个融合核和2个非融合子核的细胞而言,探针信号的分离则包括了3/2/1(约占1%图3 l)、2/2/2(约占1%)、4/1/1(约占1%)和3/1/1(约占1%)等类型。显然,‘银中杨’减数分裂过程这些复杂的子核染色体分离将导致其配子染色体组成的丰富变异。
3 讨论
小孢子母细胞位于花粉囊内,细胞质浓厚,被胼胝质层所包裹,常规压片法获得的减数分裂染色体制片背景较深(辛昊阳等, 2016),因此开展减数分裂染色体FISH研究时,通常需要通过酶解途径释放细胞,以获得分散良好的染色体制片(Wangetal., 2017b; Xinetal., 2018; Azumietal., 2001)。Li等(2018)进行黄瓜减数分裂FISH研究时使用了4%纤维素酶+2%果胶酶混合液进行花药酶解,获得良好染色体制片。适用于犬蔷薇(RosaSect.Caninae)减数分裂染色体制片的条件是将花药置于1%纤维素酶+0.2%果胶酶+0.5%半纤维素酶中酶解2 h(Lunerovetal., 2020)。可见,不同植物花药酶解处理的适宜酶解条件有所差异。本研究筛选出适用于三倍体‘银中杨’小孢子母细胞减数分裂染色体制片的酶解条件为37 ℃下将花药置于3%纤维素酶+1%果胶酶混合液中酶解3 h,获得的制片染色体完整而分散,细胞质薄,有利于后续FISH分析时探针的渗入,从而降低了细胞质对杂交信号的遮挡,提高检测结果的准确性。
由于45S rDNA序列高度重复而保守,使其作为分子探针具有较高检出率和信号强度,易于追踪减数分裂期间染色体行为(赵洋, 2020; 王璐等, 2020)。本研究以45S rDNA作为探针对‘银中杨’小孢子母细胞减数分裂各时期的染色体行为进行跟踪分析,均产生了清晰明亮的荧光信号,充分证明了其适用性和有效性。Xin等(2020)利用FISH技术将45S rDNA探针定位在了大叶杨(P.lasiocarpa)、美洲黑杨(P.deltoides)和毛果杨(P.trichocarpa)8号与14号染色体,毛白杨(P.tomentosa)14号染色体以及胡杨(P.euphratica)的9号染色体上,为杨属植物染色体识别提供了重要信息。‘银中杨’作为白杨派和黑杨派树种的远缘杂种,中期I细胞中45S rDNA探针信号仅定位于3条染色体上,但具体位于第几号染色体还不能做出判断,未来可结合基因组测序信息进一步设计特定染色体探针,通过体细胞FISH研究加以鉴定。
多倍体减数分裂过程中染色体配对方式体现染色体之间的异质性,在一定程度上反映了亲本间的亲缘关系(Luetal., 1997)。在两亲本物种亲缘关系较远的异源四倍体黄瓜中,同源染色体主要以二价体形式配对,单价体、三价体和四价体配对的情况少有发生(Wangetal., 2017b)。He等(2018)研究表明,同源四倍体马铃薯(Solanumtuberosum)减数分裂过程中有78.4%的7号染色体以四价体形式配对,仅1%的细胞中存在单价体和三价体。Wang等(2017a)通过常规醋酸洋红染色压片法分析了‘银中杨’减数分裂平均配对构型,为15.2I+14.0II+4.6III,可见其三价体的配对形式较少,基因组间杂合性较高。本研究利用45S rDNA为探针的FISH分析发现信号所在染色体在中期I存在III、II+I、I+I+I 3种形式,其中三价体(图2b)发生频率为69.28%,明显高于其他配对形式,表明虽然‘银中杨’基因组间杂合性较高,但45S rDNA探针信号所定位的染色体亲缘关系可能较近。
受杂交和多倍化的影响,‘银中杨’小孢子母细胞减数分裂后期I、后期II、末期II中染色体滞后和微核的现象高频发生(Wangetal., 2017a)。本研究发现45S rDNA探针信号同样可能定位到后期I、中期II、后期II、末期II细胞的1~2个落后染色体或微核上,但后期II细胞中具有落后染色体的比率(约11.54%)大于末期II形成微核的细胞比率(约6%),这表明并非所有落后染色体均形成微核。在末期II的部分细胞中,无论定位于子核还是微核,所观察到的探针信号总数未达到理论上的6个,推测减数分裂过程可能发生落后染色体或微核的降解或丢失。
三倍体物种尽管高度败育,但也可能产生少量具有功能的n= x配子、n= 2x配子甚至非整倍性配子,通过杂交获得不同倍性水平的新种质(Kohleretal., 2010; Kingetal., 1998; Zhangetal., 2009)。Wang等(2017a)发现‘银中杨’花粉育性仅为2.78%,并与二倍体毛新杨(P.tomentosa×P.bolleana‘TB03’)进行杂交获得了二倍体、三倍体、四倍体以及非整倍体后代。本研究在‘银中杨’末期II细胞的融合核中观察到3~4个45S rDNA探针信号,推测其形成的配子中将包含3~4条45S rDNA探针所对应的染色体,若这些配子具有活力,则杂交后可能形成包含4~5条该染色体的子代,从而为开展染色体工程育种提供丰富的种质材料。
4 结论
本研究通过对三倍体‘银中杨’花药最适酶解条件的探究,摸索出适用于其小孢子母细胞减数分裂FISH研究染色体制片的酶解条件为用3%纤维素酶+1%果胶酶混合液在37 ℃下酶解3 h,表明仅通过优化酶解条件即可充分释放小孢子母细胞,获得高质量减数分裂染色体制片。进一步利用45S rDNA探针开展FISH研究结果表明三倍体‘银中杨’小孢子母细胞减数分裂过程染色体行为复杂。45S rDNA探针信号定位于3条同源染色体上,在中期I呈现的三种配对形式中III发生频率最高,表明信号所定位的染色体亲缘关系可能较近。大多数探针信号在后期I至中期II为2/1分离,在后期II至末期II呈现2/2/1/1的分离模式,表明探针信号所定位的染色体在大部分细胞中遵循正常的分离规律,但部分细胞中探针信号所对应的1~2条染色体在后期I、中期II、后期II、末期II发生分离滞后或形成微核,进而可能在后续发育过程中丢失。末期II细胞中存在3~4个45S rDNA探针信号的融合核可能形成具有2 n甚至超数染色体的配子。相关研究结果表明,利用FISH技术可对杨树减数分裂过程的特定染色体行为进行定位和精准分析,显著推动林木细胞遗传学研究进展。
