胆南星拮抗热性惊厥模型小鼠脑组织损伤及炎症的作用研究
2022-06-15曾平闫玉梅郁红礼吴皓陶兴宝谢雨薇程砚秋王彩霞王贺鹏陈劲松
曾平,闫玉梅,郁红礼,3,4,吴皓,3,4,陶兴宝,谢雨薇,程砚秋,王彩霞,王贺鹏,陈劲松
(1.南京中医药大学药学院,江苏 南京 210023;2.精华制药集团股份有限公司,江苏 南通 226000;3.江苏省中药炮制重点实验室,江苏 南京 210023;4.国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023;5.四川仟源中药饮片有限公司,四川 广汉 618304)
胆南星(Arisaema cum Bile)是天南星的常用炮制品之一,由制天南星的细粉与牛、羊或猪胆汁加工而成,或由生天南星细粉与牛、羊或猪胆汁发酵加工而成,具有清热化痰、息风定惊之功,临床常用于治疗中风痰迷、癫狂惊痫等症[1]。《本草汇言》有云:“如小儿惊风惊痰,四肢搐搦,……非胆星不能疗也”[2]。现代临床文献亦显示胆南星常用于治疗小儿热性惊厥[3]。热性惊厥是儿童常见疾病,现代药理研究认为该病发生与免疫炎症过程密切相关,炎症因子大量释放引起机体发热,进而引起下丘脑及海马等脑区神经元兴奋,形成异常放电,导致热性惊厥发生[4]。长时间反复发作的热性惊厥可引起海马神经元细胞损伤,诱发脑内炎症反应,进一步导致惊厥发作、神经元细胞损伤等[5]。文献显示胆南星具有抗炎[6]、镇静[7]等药理作用。课题组前期研究发现胆南星具有显著的抗惊厥作用[8],但其抗热性惊厥药效作用及其机制不明。本研究基于热性惊厥发病机制构建热性惊厥小鼠模型[9],考察胆南星拮抗热性惊厥模型小鼠脑组织损伤、炎症的影响,为胆南星抗热性惊厥效应物质基础研究提供科学依据。
1 材料
1.1 试药与仪器
胆南星(四川仟源中药饮片公司,批号:190401);戊四氮(上海麦克林生化科技有限公司,货号:P815563-5g);丙戊酸钠(上海源叶生物科技有限公司,货号:S60377-5g);阿司匹林肠溶片(拜耳医药保健有限公司,货号:68469);异氟烷(深圳市瑞沃德生命科技有限公司,货号:902-0000-522);COX-2、iNOS抗体(成都正能生物技术有限公司,货号:R23971、340668);γ-氨基丁酸A型受体(GABAAR)、胶质纤维酸性蛋白(GFAP)、β-actin、GAPDH抗体(武汉三鹰生物技术有限公司,货号:12410-1-AP、16825-1-AP、23660-1-AP、10494-1-AP);电子体温计[欧姆龙(大连)有限公司,货号:MC-246];干酵母(安琪酵母股份有限公司,批号:CF20200324W2F33);液体石蜡(山东德新康医疗科技有限公司,批号:200603);PGE2、cAMP ELISA试剂盒(上海酶联生物科技有限公司,货号:ml037542、ml057902)。
多功能酶标仪(美国Molecular Devices公司,型号:SpectraMax i3X);实时荧光定量PCR仪(美国ABI公司,型号:ABI7500);组织研磨仪(上海净信实业发展有限公司,型号:Tiss-24);垂直凝胶电泳及电转印仪(美国Bio-rad公司,型号:Mini P-4);全自动化学发光图像分析系统(上海天能科技有限公司,型号:Tanon 5200);超微量紫外分光光度计(美国Thermo Fisher公司,型号:NanoDrop OneC)。
胆南星水提物制备:取适量饮片于8倍量水中浸泡1 h,煮沸后小火煎煮30 min,放冷后,4 000 r·min-1离心5 min,取上清液;再次将残渣加6倍量水煎煮,煮沸后小火煎煮20 min,放冷后,4 000 r·min-1离心5 min,取上清液,合并2次上清液,置于蒸发皿上挥至合生药量0.5 g·mL-1。
1.2 动物
SPF级ICR小鼠,雄性,体质量22~24 g,购自南京市青龙山动物养殖场,许可证号:SCXK(苏)2019-0002,动物实验通过南京中医药大学伦理委员会审查,伦理号:202005A022。SPF级屏障环境饲养,自由饮水、进食,室温22~25 ℃,湿度40%~70%。
2 方法
2.1 造模、分组及给药
ICR小鼠适应性喂养7 d后,先适应性测量肛温2 d,随后对小鼠进行连续3 d的肛温测量,每天2次。筛选测温温差≤0.5 ℃的小鼠作为实验对象,随后按照随机数表进行分组。60只小鼠分为空白组,模型组,阳性药组(300 mg·kg-1丙戊酸钠与200 mg·kg-1阿司匹林联合给药),胆南星低剂量组(0.5 g·kg-1)、中剂量组(1.0 g·kg-1)、高剂量组(2.0 g·kg-1),每组10只。实验前12 h禁食不禁水,空白组和模型组灌胃给予等体积的0.5%羧甲基纤维素钠(CMC-Na)溶液,其余给药组以20 mL·kg-1给予相应药物,每日1次,连续给药7 d。末次给药后除空白组外,其余各组皮下注射20%干酵母混悬液(10 mL·kg-1)致发热模型,8 h后测量肛温。随即除空白组外,其余各组腹腔注射戊四氮溶液(60 mg·kg-1)。记录30 min内各组小鼠惊厥表现,然后眼眶静脉丛取血,离心取血清备用,同时,分别在冰上解剖小鼠,取出脑组织、海马组织及其他脏器,放于液氮中备用。
2.2 小鼠行为学观察
惊厥行为学观察[10]:记录30 min内小鼠的惊厥表现,惊厥判断标准见表1。惊厥潜伏期:末次腹腔注射戊四氮溶液至小鼠首次出现2级反应。惊厥持续时间:首次出现2级反应至末次出现2级反应之间的时间。

表1 惊厥行为学表现判断评级
2.3 HE染色
每组随机选择3只小鼠吸入异氟烷麻醉后,心脏灌流,首先注入一定体积生理盐水进行灌流,清除血液,待肝脏等器官转呈灰白色后,缓慢注入4%多聚甲醛,待小鼠四肢僵硬,停止灌注,取下大脑,固定,备用。通过HE染色评估海马神经元损伤病理表现。
2.4 ELISA法检测血清中cAMP、PGE2水平
血液室温自然凝固20 min,于4 ℃、3 000 r·min-1离心20 min,收集上清,按试剂盒说明书以ELISA法检测血清中cAMP、PGE2水平。
2.5 Western blot法检测小鼠脑组织COX-2、iNOS、GFAP、GABAAR蛋白表达水平
冰上称取一定量脑组织置于含有蛋白酶和磷酸酶抑制剂的预冷RIPA中匀浆并离心,然后使用BCA法测定上清液的蛋白质浓度。用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,然后将其转移到聚偏二氟乙烯(PVDF)膜上。封闭后,将每个PVDF膜与一抗[兔抗COX-2(1∶1 000)、iNOS(1∶500)、GFAP(1∶5 000)、GABAAR(1∶1 000),鼠抗β-actin(1∶3 000)、GAPDH(1∶3 000)]在4 ℃下孵育过夜。次日洗涤PVDF膜,然后与相应的二抗(1∶3 000)孵育2 h。洗涤PVDF膜后使用ECL试剂在曝光机下拍摄蛋白条带,并使用Image J软件分析数据。
2.6 qPCR法检测小鼠海马组织炎症因子IL-1β、IL-6、TNF-α mRNA表达水平
采用Trizol法从小鼠海马组织中提取总RNA,使用Nano-Drop超微量紫外分光光度计测量RNA浓度。使用Hieff®qPCR SYBR Green Master Mix预混液制备样品及扩增。扩增条件为:95 ℃预变性5 min,95 ℃变性10 s,退火/延伸60 ℃ 34 s,共40个循环。使用2-ΔΔCt方法计算mRNA相对表达水平,选择β-actin作为内参。引物序列见表2。
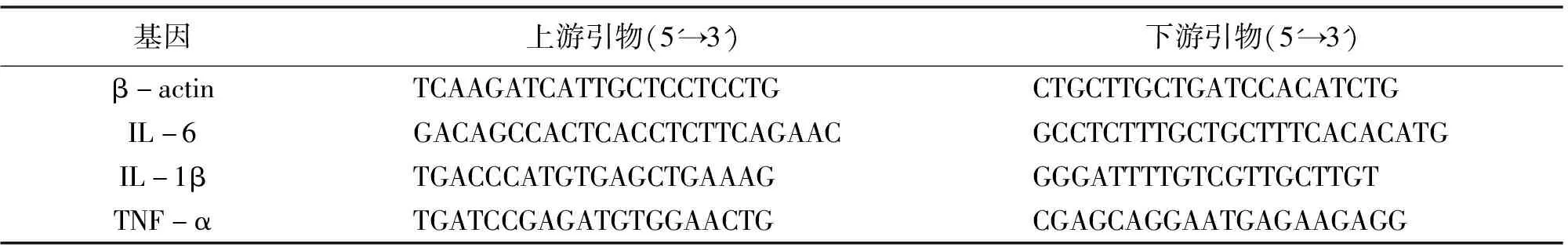
表2 目的基因的引物序列
2.7 统计学方法

3 结果
3.1 胆南星水提物对热性惊厥小鼠肛温变化的影响
各组小鼠的基础肛温没有显著性差异。皮下注射20%干酵母混悬液造模8 h后,与空白组比较,模型组小鼠肛温显著升高(P<0.05),表明发热小鼠模型造模成功。与模型组比较,阳性药组及胆南星高剂量组小鼠肛温均显著降低(P<0.05),表明胆南星具有解热作用。见图1。
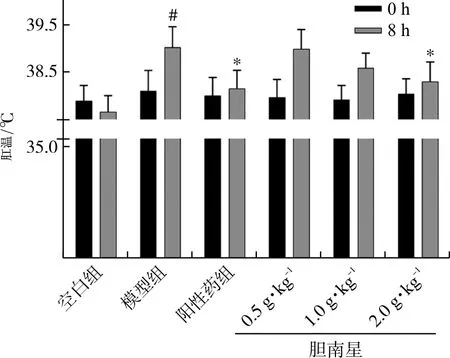
注:与空白组比较,#P<0.05;与模型组比较,
3.2 胆南星水提物对热性惊厥小鼠惊厥发作潜伏期、惊厥持续时间及脑组织GABAAR蛋白表达的影响
空白组与阳性药组未发生惊厥表现,模型组发现惊厥表现。与模型组比较,胆南星高剂量组可显著延长惊厥潜伏期(P<0.05),缩短惊厥持续时间(P<0.01),显著上调脑组织GABAAR蛋白表达(P<0.05),表明胆南星具有抗惊厥作用,见图2。

注:与空白组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01。±s,n=10。
3.3 胆南星水提物对热性惊厥小鼠血清cAMP、PGE2水平的影响
ELISA结果显示,与空白组比较,模型组小鼠血清cAMP、PGE2水平均显著升高(P<0.05);与模型组比较,阳性药组及胆南星高剂量组小鼠血清cAMP、PGE2水平均显著降低(P<0.01),表明胆南星发挥解热作用的机制可能与抑制小鼠血清cAMP、PGE2等内源性介质释放有关。见图3。
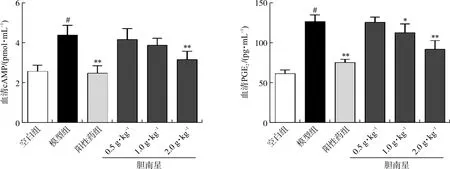
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01。±s,n=6。
3.4 胆南星水提物对热性惊厥小鼠海马区神经元细胞形态的影响
HE染色病理切片结果显示,与空白组比较,模型组小鼠的脑组织海马整体结构异常,海马区神经元数量异常,锥体细胞形态异常,可见神经元细胞核固缩深染,排列不规整,表明长时间的惊厥发作破坏了神经元细胞的正常形态结构。与模型组比较,胆南星高剂量组海马神经元形态明显改善,锥体细胞表现正常,排列相对整齐,核仁清晰,表明胆南星能有效改善海马神经元细胞形态,保护其免受惊厥诱发的神经元损伤,具有一定的神经保护作用,见图4。
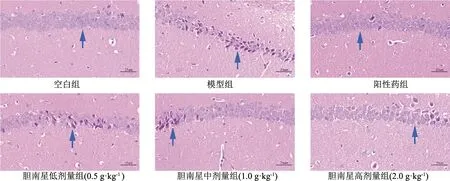
注:蓝色箭头代表海马区神经元细胞形态。
3.5 胆南星水提物对热性惊厥小鼠海马组织炎症因子IL-1β、IL-6、TNF-α mRNA表达的影响
qPCR法结果显示,与空白组比较,模型组小鼠海马组织IL-1β、IL-6、TNF-α mRNA相对表达量显著升高(P<0.05);与模型组比较,胆南星高剂量组小鼠海马组织IL-1β、IL-6、TNF-α mRNA相对表达量显著降低(P<0.05),表明胆南星可降低海马组织炎症因子释放,具有拮抗脑组织炎症的作用,见图5。
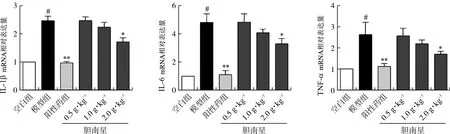
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01。±s,n=3。
3.6 胆南星水提物对热性惊厥小鼠脑组织iNOS、COX-2、GFAP表达的影响
Western blot分析结果显示,与空白组比较,模型组小鼠脑组织COX-2、iNOS、GFAP蛋白相对表达量显著升高(P<0.05);与模型组比较,胆南星高剂量组小鼠脑组织COX-2、iNOS、GFAP蛋白相对表达量显著降低(P<0.05),表明胆南星能够下调相关蛋白的表达,缓解脑内炎症反应的发生,降低脑组织损伤,见图6。

注:与空白组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01。±s,n=3。
4 讨论
胆南星功效为清热化痰,息风定惊,对《中国药典》2020年版收载的含有胆南星中成药的分析表明胆南星临床主要用于治疗小儿高热惊风、小儿支气管炎、小儿风热感冒等疾病[1]。小儿急惊风现代病理表现通常为热性惊厥,由于炎症反应诱发的机体发热及惊厥发生通常是热性惊厥的发病机制之一[11]。
热性惊厥是儿童常见的一种惊厥性疾病,现代研究认为该病发生与免疫炎症过程密切相关。当热性惊厥发生时,机体的炎症反应促进cAMP、PGE2等炎症介质的释放,进而导致发热反应,可引起下丘脑及海马等脑区神经元兴奋,异常放电导致惊厥发生[4]。文献显示,神经元细胞的抑制和活化与惊厥的发生密切相关,抑制性神经递质GABA与GABA受体结合后可抑制突触后电位,进而降低神经元兴奋性[12],随即抑制惊厥的发生。此外,长时间的热性惊厥发作可引起海马神经元细胞损伤进而诱发脑内炎症反应,同时激活星形胶质细胞,此时GFAP大量表达[13],活化的星形胶质细胞可导致iNOS与COX-2的大量表达,并且促进大量炎症因子释放[14-15]。
本研究首次采用皮下注射20%干酵母混悬液再以戊四氮溶液为致惊剂构建热性惊厥模型[16-17]。相较于空白组,造模后的小鼠肛温及惊厥发生相关指标、小鼠脑组织炎症因子水平都有显著性差异(P<0.05),表明造模成功。与模型组比较,胆南星水提物高剂量组能有效延长热性惊厥的潜伏期(P<0.05),缩短惊厥持续时间(P<0.01),下调GABAAR蛋白的表达(P<0.05),同时降低模型小鼠肛温(P<0.05),降低血清cAMP、PGE2水平(P<0.01),表明胆南星具有解热、拮抗热性惊厥的作用。HE染色病理切片观察发现,模型组海马区神经元形态发生改变,受到损伤,胆南星组海马区神经元形态未见明显变化,表示胆南星能够保护海马区神经元。同时,模型组小鼠GFAP蛋白(主要存在于星形胶质细胞中)表达量显著上调(P<0.05),胆南星高剂量组GFAP蛋白表达下调(P<0.05)。GFAP是中枢神经系统应激后星形胶质细胞活化的最佳标志物之一,星形胶质细胞通常在神经系统中作出反应,表明胆南星具有抑制星形胶质细胞激活的作用。高剂量胆南星能够下调iNOS、COX-2蛋白的表达(P<0.05),同时下调海马组织炎症因子IL-1β、IL-6、TNF-α mRNA表达水平(P<0.05),表明胆南星在发挥抗惊厥药效的同时抑制了脑内炎症反应的发生。由于脑内炎症反应的发生可提高惊厥发作易感性[18],胆南星拮抗热性惊厥的作用一定程度可能与其抑制脑内炎症反应相关。上述研究表明,胆南星具有显著的抗热性惊厥、保护海马神经元免受损伤、抑制脑内炎症发生的作用。同时本研究发现胆南星通过上调GABAAR蛋白发挥抗惊厥作用,其机制也可能与调节神经递质系统有关,课题组后续将继续对胆南星抗热性惊厥机制开展进一步研究。
本实验研究结果表明胆南星具有抗热性惊厥的药效作用,但关于胆南星中的效应物质仍然有待深入探讨。课题组前期研究表明胆南星中含有大量胆酸类成分[19],Sun等[20]研究发现胆酸类成分抗热性惊厥的机制可能与抑制脑内炎症发生相关。因此,胆酸类成分是否作为胆南星拮抗脑组织炎症反应的主要物质基础,后续将基于本研究构建的动物模型及研究结果进行深入研究。
