基于液质联用技术的南北产地桔梗药材皂苷谱差异研究
2022-06-15许伟辰罗子宸何钰狄留庆郭青单进军
许伟辰,罗子宸,何钰,狄留庆,郭青,单进军
(1.南京中医药大学中医儿科学研究所,江苏省儿童呼吸疾病(中医药)重点实验室,江苏 南京 210023;2.江苏省食品药品监督检验研究院,江苏 南京 210019;3.江苏省中药高效给药系统工程中心,江苏 南京 210023)
桔梗是桔梗科植物桔梗Platycodongrandiflorum(Jacq.)A.DC的干燥根,性平,味苦、辛,归肺经,具有宣肺、利咽、祛痰和排脓的功效[1]。桔梗中化学成分以皂苷类为主,现代研究表明,桔梗中皂苷类成分具有多种药理作用,如桔梗皂苷D具有抗炎[2]、降脂[3]和保肝[4]作用;远志皂苷D与去芹糖桔梗皂苷D具有抗癌作用[5-6]等。目前《中国药典》2020年版规定桔梗按干燥品计算,桔梗皂苷D含量不得少于0.10%[1],但单一以桔梗皂苷D为含量测定标准无法满足桔梗质量控制要求。桔梗分布广泛,南北皆有产出,主产于安徽、河南、河北和内蒙等地[7]。桔梗产地与其质量密切相关,现皆以南桔梗(即华东产区)为较优品种[8]。皂苷由于缺乏共轭体系,紫外吸收差,因此常使用蒸发光散射检测器(ELSD)进行含量测定[9]。Lu等[10]收集了11省(市)23个地区的桔梗样品,采用HPLC-ELSD法建立了桔梗指纹图谱,确定了19个共有峰,但该检测方法依赖对照品。液相色谱联用高分辨质谱仪作为检测工具,检测物质时不受紫外吸收的限制,同时能给出物质的精准分子质量、二级碎片离子图谱进行匹对鉴定物质,从而提高了检测物质的通量。
本实验以秦岭-淮河为分界线划分桔梗的南、北产地,通过收集9个省(市)57批桔梗药材,采用UPLC-LTQ-Orbitrap-MS对其中皂苷成分进行鉴定及LC-MS/MS对其中10种皂苷成分进行定量,通过比较皂苷谱的差异对南北产地的桔梗药材加以区分,以期为桔梗药材质量控制提供参考。
1 材料
1.1 仪器
LTQ Orbitrap XL型串联质谱仪(美国Thermo Fisher公司),TSQ Vantage型串联三重四级杆质谱仪(美国Thermo Fisher公司),UltiMate 3000型超高效液相色谱(美国Thermo Fisher公司),CPA225D型电子天平(德国Sartorius公司),Allegra 64Rcentrifuge型离心机(美国Beckman Coulter公司),KQ-500B型超声波清洗器(昆山市超声仪器有限公司),Millipore Synergy型超纯水系统(德国Merck公司)。
1.2 试剂
桔梗皂苷D(批号:J-013120826)、桔梗皂苷D2(批号:19070306)、去芹糖桔梗皂苷D(批号:19070307)、去芹糖桔梗皂苷D2(批号:19070308)、远志皂苷D(批号:170623)均购自成都普菲德生物技术有限公司;桔梗皂苷E(批号:P06M10S81977)、桔梗皂苷D3(批号:P28M8F32837)、3-O-β-葡萄糖苷-桔梗皂苷元(批号:P27A9560106)均购自上海源叶生物科技有限公司;去芹糖桔梗皂苷E(批号:FY37239B0234)购自南通飞宇生物科技有限公司;去芹糖桔梗皂苷D3(批号:PB0761)购自成都普思生物科技有限公司;瓜子金皂苷V(批号:DST190302-016)购自成都德斯特生物技术有限公司。甲醇、乙腈(色谱纯,德国Merk);甲酸(色谱纯,美国ROE);水为超纯水,其他试剂为分析纯。
1.3 药材
收集安徽、河南、陕西、四川等产地共57批药材,经中国中医科学院首席研究员黄璐琦鉴定为桔梗科植物桔梗Platycodongrandiflorum(Jacq.)A.DC的根。根据秦岭-淮河线分为南桔梗和北桔梗,详见表1。

表1 桔梗样品来源
2 方法与结果
2.1 液质条件
UPLC-LTQ-Orbitrap-MS色谱条件:Hypersil Gold-C18色谱柱(50 mm×2.1 mm,1.9 μm);流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈(B),梯度洗脱:0~1 min(21%B),1~9 min(21%~23%B),9~15 min(23%B),15~25 min(23%~23.5%B),25~28 min(23.5%~40%B),28~29.5 min(40%~90%B),29.5~31 min(90%B),31~32 min(90%~21%B),32~35 min(21%B);流速0.3 mL·min-1;柱温35 ℃;进样量5 μL。
UPLC-LTQ-Orbitrap-MS质谱条件:ESI离子源,负离子模式扫描,m/z扫描范围120~1 600,气化管温度350 ℃,鞘气压力45 Arb,辅气压力10 Arb,毛细管温度270 ℃,喷雾电压负离子5 000 V,管状透镜电压100 V,毛细管电压-35 V。
LC-MS/MS色谱条件:Hypersil Gold-C18色谱柱(50 mm×2.1 mm,1.9 μm);流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈(B),梯度洗脱:0~5 min(22%~28%B),5~9 min(28%~80%B),9~10 min(80%B),10~11 min(80%~22%B),11~14 min(22%B);流速0.3 mL·min-1;柱温35 ℃;进样量5 μL。
LC-MS/MS质谱条件:ESI离子源,多反应监测,负离子模式扫描,气化管温度350 ℃,鞘气压力45 Arb,辅气压力25 Arb,毛细管温度270 ℃,喷雾电压负离子3 200 V;各化合物的具体参数见表2。
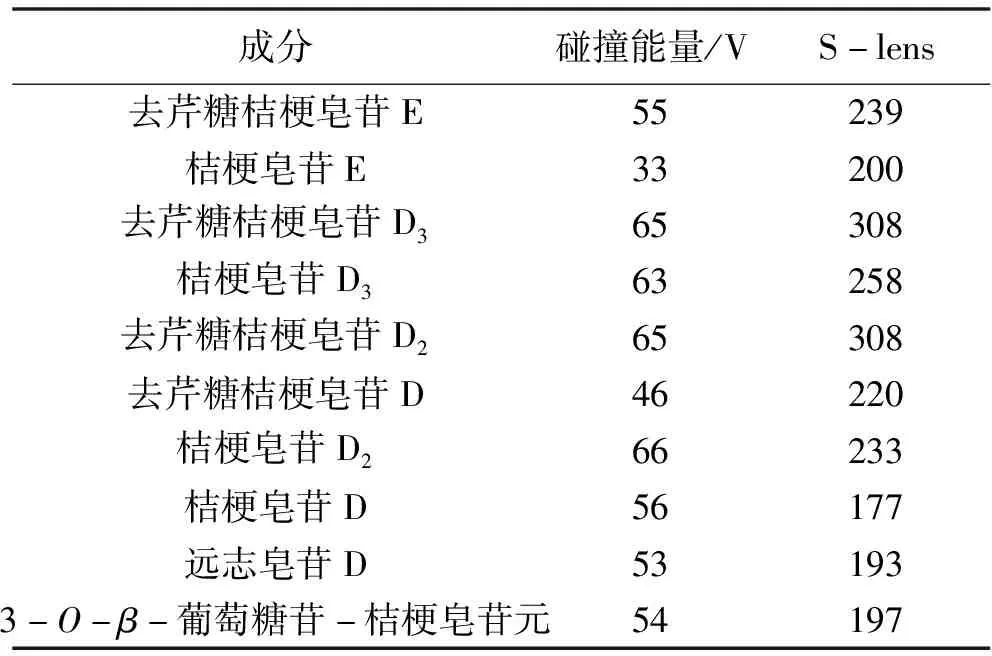
表2 质谱条件
2.2 样品溶液的制备
精密称定0.2 g桔梗样品,粉碎过筛(3号筛),精密加入水4 mL(含内标100 μg·mL-1),超声处理60 min(300 W,40 kHz),取上清18 000 r·min-1离心10 min后0.22 μm滤膜过滤,UPLC-LTQ-Orbitrap-MS进样分析,取10 μL加50%甲醇稀释至200 μL后LC-MS/MS进行定量分析,样品的提取离子流图见图1。
QC的制备:吸取各批次样本提取液10 μL后混合均匀,18 000 r·min-1离心10 min后0.22 μm滤膜过滤,UPLC-LTQ-Orbitrap-MS进样分析。
2.3 混合对照品溶液的制备
分别精密称取桔梗皂苷D、去芹糖桔梗皂苷D、去芹糖桔梗皂苷D2、去芹糖桔梗皂苷D3、去芹糖桔梗皂苷E、桔梗皂苷D2、桔梗皂苷D3、桔梗皂苷E、远志皂苷D和3-O-β-葡萄糖苷-桔梗皂苷元的对照品适量,加入50%甲醇溶解,得到质量浓度为1 mg·mL-1的对照品贮备液。分别精密吸取各对照品溶液适量混匀,取10 μL加入50%甲醇180 μL,涡旋混匀,配制成桔梗皂苷D、去芹糖桔梗皂苷D、去芹糖桔梗皂苷D2、去芹糖桔梗皂苷D3、去芹糖桔梗皂苷E、桔梗皂苷D2、桔梗皂苷D3、桔梗皂苷E、远志皂苷D和3-O-β-葡萄糖苷-桔梗皂苷元质量浓度分别为15.586、13.014、1.060、4.500、11.097、7.141、22.500、33.251、4.225、0.130 μg·mL-1的混合对照品溶液,混合对照品的提取离子流图见图1。

图1 样品和混合对照品的提取离子流图谱
2.4 皂苷成分鉴定分析结果
按“2.1”项下的UPLC-LTQ-Orbitrap-MS的色谱和质谱条件进样,得到负离子模式下的TIC图,根据精确相对分子质量、离子碎片及文献确定皂苷化合物共3种母核结构(桔梗皂苷型、远志皂苷型、桔梗二酸型)及48个成分,相关结果见图2~3和表3。

表3 桔梗负离子模式下的皂苷化合物的鉴定
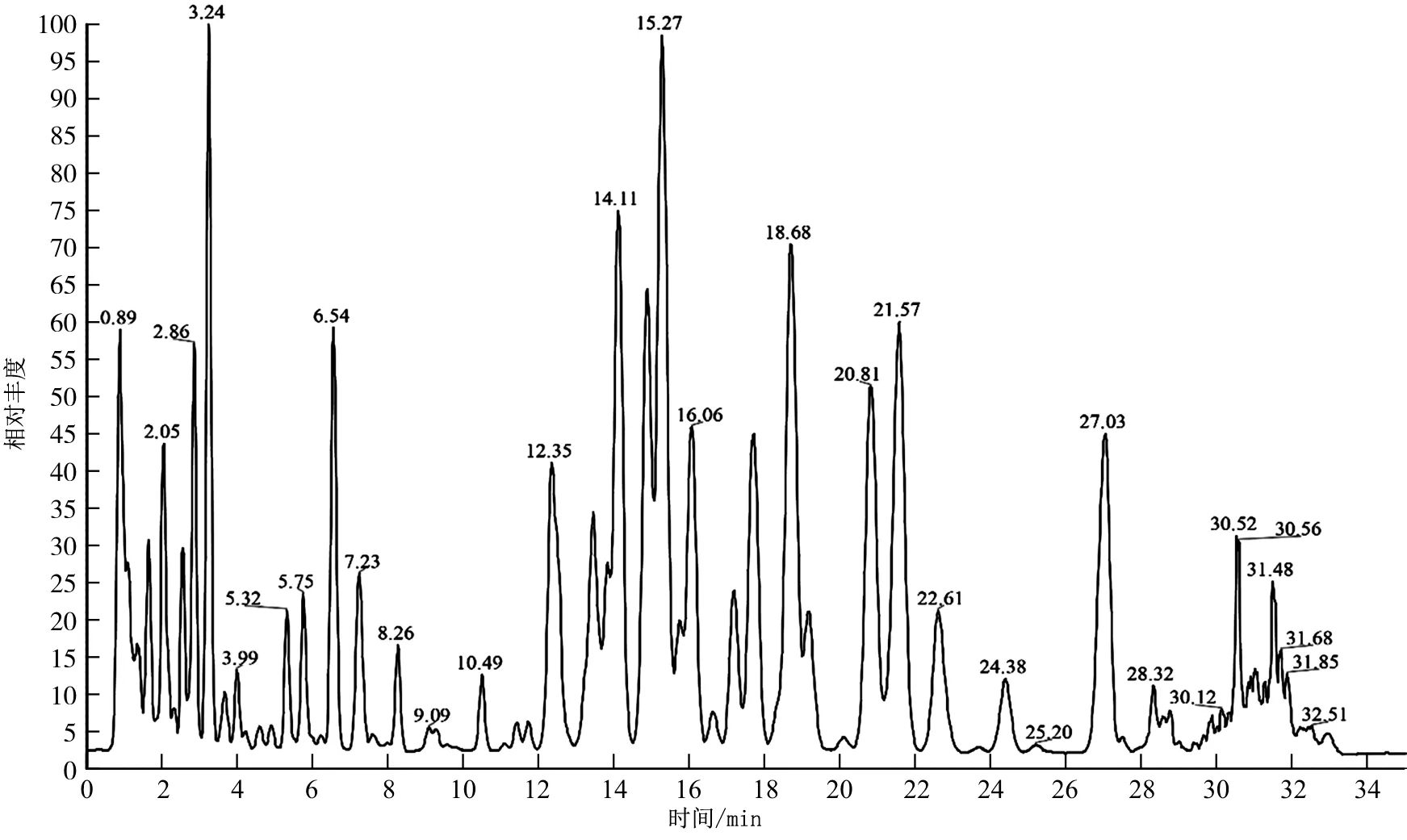
图2 负离子模式下总离子流图
2.5 LC-MS/MS方法学考察
2.5.1 线性关系考察 采用倍半稀释法配制成不同质量浓度的混合对照品系列溶液,结果见表4。
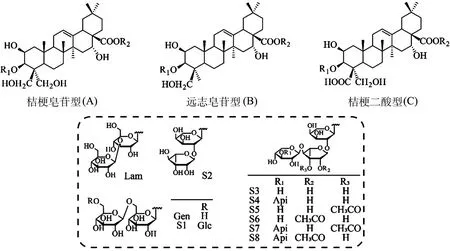
图3 皂苷化合物母核结构

表4 线性关系结果
2.5.2 精密度实验 精密吸取混合对照品溶液10 μL,加入甲醇90 μL稀释混匀,18 000 r·min-1离心10 min后取上清进样,进样体积为5 μL,重复进样6次。按“2.1”项的LC-MS/MS条件测得桔梗皂苷D、去芹糖桔梗皂苷D、去芹糖桔梗皂苷D2、去芹糖桔梗皂苷D3、去芹糖桔梗皂苷E、桔梗皂苷D2、桔梗皂苷D3、桔梗皂苷E、远志皂苷D和3-O-β-葡萄糖苷-桔梗皂苷元的RSD分别为3.3%、2.2%、2.6%、2.1%、4.4%、1.9%、3.8%、3.4%、1.8%和4.3%,表明本实验所用的仪器精密度良好。
2.5.3 稳定性实验 称取桔梗样品(AH6),按“2.3”项中的供试品溶液的制备方法进行制备,室温放置,分别于0、1、2、3、4、5、6、7、8 h进行测定,按“2.1”项的LC-MS/MS条件测得桔梗皂苷D、去芹糖桔梗皂苷D、去芹糖桔梗皂苷D2、去芹糖桔梗皂苷D3、去芹糖桔梗皂苷E、桔梗皂苷D2、桔梗皂苷D3、桔梗皂苷E、远志皂苷D和3-O-β-葡萄糖苷-桔梗皂苷元的RSD分别为4.3%、3.8%、3.7%、4.5%、2.3%、3.7%、4.5%、5.9%、4.5%和7.0%,结果表明样品稳定性良好。
2.5.4 重复性实验 称取同一批次(AH6)桔梗样品6份,按“2.3”项中的供试品溶液的制备方法,平行处理,并按“2.1”项的LC-MS/MS条件进行测定,计算桔梗皂苷D、去芹糖桔梗皂苷D、去芹糖桔梗皂苷D2、去芹糖桔梗皂苷D3、去芹糖桔梗皂苷E、桔梗皂苷D2、桔梗皂苷D3、桔梗皂苷E、远志皂苷D和3-O-β-葡萄糖苷-桔梗皂苷元的RSD分别为2.8%、4.8%、6.4%、3.8%、4.8%、5.5%、3.6%、4.8%、4.9%和7.9%,结果表明该方法重复性良好。
2.5.5 加样回收率实验 称取桔梗样品粉末0.2 g,精密称定,加入一定量的混合对照品溶液,按“2.3”项中的供试品溶液的制备方法处理,并按“2.1”项的LC-MS/MS条件进行测定,计算桔梗皂苷D、去芹糖桔梗皂苷D、去芹糖桔梗皂苷D2、去芹糖桔梗皂苷D3、去芹糖桔梗皂苷E、桔梗皂苷D2、桔梗皂苷D3、桔梗皂苷E、远志皂苷D和3-O-β-葡萄糖苷-桔梗皂苷元的回收率分别为102.1%、101.0%、96.9%、102.0%、102.9%、98.3%、103.4%、104.2%、102.2%和101.1%,RSD值为2.9%、4.5%、5.4%、3.9%、4.9%、4.5%、4.5%、4.4%、2.7%和6.9%。
2.6 样品测定
57批样品按“2.3”项进行制备,按“2.1”项的LC-MS/MS条件进行含量测定,测定结果见表5。

表5 样品中10种皂苷成分含量测定结果(mg·g-1,n=2)
2.7 不同产地桔梗药材测定结果分析
为了全面研究皂苷谱,将所有样品混合得到QC,根据QC样本的皂苷谱对所有样本中的桔梗皂苷进行鉴定和比对。将57批桔梗药材皂苷谱成分定性结果导入SIMCA-P14.1软件,通过主成分分析(PCA)和正交偏最小二乘法判别分析(OPLS-DA)进行聚类分析,得到桔梗南北产地聚集情况。从图4A可见每一个点代表一个样本,大部分点分布在95%置信区间内,显示南北桔梗药材聚集情况,发现皂苷谱有明显差异,2者间有明显区分,QC样本较为集中,表明仪器稳定性较好;图4B中OPLS-DA得分图的R2=0.7,Q2=0.728,表明数学模型的区分度与预测性较好,同时图4C中1 000次的Permutation结果显示OPLS-DA模型未过拟合,表明模型具有可靠性。根据图4B构建的OPLS-DA模型计算各变量的VIP值,并以VIP>1.0及P<0.05初步筛选差异物质,见表6,并对差异物质进行热图聚类分析,结果见图5,红色代表强度上升,蓝色代表强度下降。
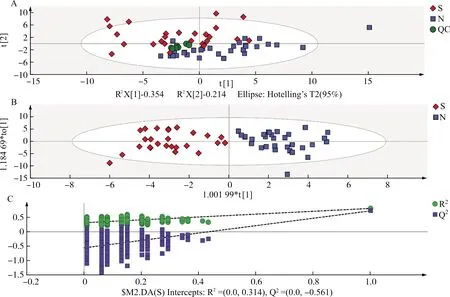
注:N.北桔梗;S.南桔梗

表6 桔梗差异皂苷成分

注:N.北桔梗;S.南桔梗
2.8 不同产地桔梗药材含量测定结果分析
如图6所示,靶标定量结果显示,桔梗皂苷D、去芹糖桔梗皂苷D、远志皂苷D和去芹糖桔梗皂苷D2的含量在南北桔梗中存在显著差异,南桔梗均显著高于北桔梗,差异皂苷结果与UPLC-LTQ-Orbitrap-MS测定结果相符,其余6种皂苷在南北产地中未见有显著差异。

注:N.北桔梗;S.南桔梗;与北桔梗组比较,*P<0.05。
3 讨论
本实验通过收集不同产地的57批桔梗药材,以秦岭-淮河为分界线划分桔梗的南北产地,对其中皂苷类成分进行分析,结果表明南北产地桔梗皂苷谱可明显区分,并找到23个差异性皂苷成分,并对其中部分皂苷使用LC-MS/MS进行靶标定量验证分析,桔梗皂苷D、去芹糖桔梗皂苷D、远志皂苷D及去芹糖桔梗皂苷D2靶标定量结果显示南桔梗中含量显著高于北桔梗,与UPLC-LTQ-Orbitrap-MS测定结果相一致。
皂苷是植物中的次生代谢产物,其形成与含量积累是一个复杂的过程,与生长环境等密切关联[21]。Zhao等[22]对桔梗皂苷D及远志皂苷D等桔梗皂苷对脂肪酶的抑制作用进行了探究,发现桔梗皂苷D抑制能力强于远志皂苷D。目前对于桔梗中皂苷成分的药效研究以桔梗皂苷D和桔梗总皂苷为主,对其他单一皂苷成分的药理作用未有较多研究,本课题组对中药桔梗的质量标志物曾进行初步分析,发现皂苷类成分是其发挥效用的关键成分,可划入质量标志物候选之中[23]。药典所规定的单一以桔梗皂苷D成分为质量标准无法全面评价桔梗药材的质量,因此需要尽可能增加有效成分的含量测定以进一步完善药材质量评价标准,同时有必要对桔梗中除桔梗皂苷D以外的皂苷成分进行研究,探究其药理作用。
