氨基甲酸乙酯水解酶异源表达及酶学性质分析
2022-06-14高孝高洁刘晓宇王中选刘庆涛桑亚新
高孝,高洁,刘晓宇,王中选,刘庆涛,桑亚新*
(1.河北农业大学食品科技学院,河北 保定 071000;2.安徽工程大学生物与食品工程学院,安徽 芜湖 241000)
氨基甲酸乙酯(ethyl carbamate,EC)是一种广泛存在于发酵食品和酒精饮料[1-3]中属于2A类的致癌物质[4],并且在食品的发酵及贮藏过程中均可由其前体物质所产生的一种有害物质[5-6]。目前,人们常常通过优化食品的发酵工艺[7-8]、对酿酒酵母进行基因改造[9-11]以及微生物酶法(包括脲酶[12-14]、氨基甲酸乙酯水解酶[15-17])实现对氨基甲酸乙酯的控制,由于微生物酶法可直接作用于底物,对底物的降解效率高并且不会对环境造成影响,从而使其在降解EC方面具有很好的优势[18-19]。脲酶可以通过水解EC的前体物质尿素从而实现对终产物EC含量的控制[20],但是EC一旦生成将很难在食品中消除[21],而氨基甲酸乙酯水解酶(urethanase,UH)可以直接作用于EC使其水解为无害的物质,因此其在实际的应用过程中具有良好的前景[22]。
2006 年,Akutsu-Shigeno等[21]从马红球菌(Rhod-ococcus equistrain TB-60)中发现了可以降解EC的蛋白质,并克隆了该蛋白的基因序列(GenBank:DD320008.1),成功实现了其在E.coli中的异源表达。卜攀攀等[23]在2013年从小鼠的胃部获得了一株具有UH活性的肺炎克雷伯氏菌(Klebsiella pneumoniae),验证该菌所产的EC水解酶对于氯化钠具有较好的耐受性。随后李京京等[24]在2014年从小鼠肠道筛选得到一株赖氨酸芽孢杆菌,证明其具有对EC进行降解的功能,并对所产的EC水解酶进行分离纯化,通过N端测序获得了该EC水解酶的基因序列(GanBank:KU353448.1),随后在大肠杆菌及枯草芽孢杆菌中均实现了该酶的活性表达,但该酶的耐酸性以及耐乙醇性较差。2019年,Masakik等[25]在Candida parapsilosis中获得了具有编码EC水解酶的基因序列(GanBank:LC511748.1),并实现了该基因在酿酒酵母中的表达,且该酶对乙醇具有一定耐受性。
本研究根据来源于长孢洛德酵母菌属的UH蛋白序列,并依据大肠杆菌系统的密码子偏好性来合成该UH蛋白的目的基因,转化到E.coli BL21(DE3)中进行异源表达,将得到的粗酶液进行细胞破碎后经镍柱亲和层析纯化,研究重组酶的酶学性质[26],以期为在实际应用中降解氨基甲酸乙酯提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
E.coli BL21(DE3)(过表达目的基因的宿主菌)、诱导型表达质粒pET-30a(+):由河北农业大学食品科技学院微生物实验室保存;含有氨基甲酸乙酯水解酶基因的E.coli DH5α:金唯智生物科技(苏州)有限公司。
1.1.2 试剂
质粒小提试剂盒:全式金生物技术(北京)有限公司;蛋白胨、酵母粉:英国Oxiod公司;氨基甲酸甲酯、氨基甲酸乙酯、丁基氨基甲酸酯、乙酰胺、丁酰胺、丙烯酰胺、甲基丙烯酰胺、烟酰胺:上海麦克林生化科技有限公司。以上化学试剂均为国产分析纯。
1.2 仪器与设备
SCIENTZ-IID型超声波细胞粉碎机:宁波新芝生物科技股份有限公司;Thermo Cel I恒温金属浴:杭州博日科技股份有限公司;BG-Power600型电泳仪:上海贝晶生物技术有限公司;1500酶标仪:赛默飞尔科技公司;TGL-16M台式高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;Tanon-4600SF凝胶成像系统:北京原平皓生物科技有限公司;DK-8D电热恒温水槽:上海精宏实验设备有限公司。
1.3 方法
1.3.1 表达载体的构建
参照NCBI数据库中来源于Lodderomyces elongisporus的UH的氨基酸序列(XP_001524600.1),在序列的5’端和3’端分别添加限制性内切酶NdeⅠ和XhoⅠ的酶切位点,在不改变氨基酸序列的前提下根据大肠杆菌密码子偏好性对序列进行优化后合成目的基因,随后连接至pET-30a(+)载体上,命名为pET-30a(+)-UH,并转化至克隆菌株E.coli DH5α中。
1.3.2 重组大肠杆菌的诱导表达
参照质粒小提试剂盒提取克隆菌株中的表达载体,将其转化至E.coli BL21感受态细胞中,随后涂布于含50 μg/mL卡那霉素的LB固体平板37℃过夜培养后,挑取重组菌接入LB液体培养基中过夜活化后,以1%的接种量将菌液接种至LB液体培养基中37℃培养,至OD600值约为0.6~0.8时,加入终浓度为0.1mmol/L的异丙基-β-D-硫代半乳糖苷溶液,在30℃条件下继续诱导培养。
1.3.3 氨基甲酸乙酯水解酶的分离纯化
将表达后的菌液以12 000 r/min离心10 min后收集发酵诱导的细胞,用磷酸盐缓冲液洗涤菌体后放于冰水浴上超声破碎,将破碎液于4℃、12 000 r/min离心30 min,收集上清液即为所需的粗酶液。使用镍柱亲和层析法纯化重组氨基甲酸乙酯水解酶,使用截留分子量为3.3 kDa的透析袋透析,随后经过截留分子量为10 kDa的超滤离心管离心后进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE) 检测分析,以确定洗脱蛋白是否为目的蛋白及其纯化程度。
1.3.4 重组氨基甲酸乙酯水解酶酶活的测定
根据Berthelot反应显色法,在波长625 nm下测定吸光值计算酶活。在0.2 mL含200 mmol/L氨基甲酸乙酯的磷酸盐缓冲液(对照组为磷酸盐缓冲液)中加入0.2 mL经过适当稀释的酶液,在37℃恒温水浴箱中反应20 min后,立即加入0.2 mL终止剂终止反应,混匀后依次加入0.2 mL显色剂Ⅰ、0.2 mL显色剂Ⅱ,摇匀,37℃水浴继续保持10 min。酶活定义:在37℃、pH7.4条件下每分钟分解底物EC产生1 μmol NH4+所需酶量为1个酶活力单位。
1.3.5 氨基甲酸乙酯水解酶酶学性质分析
1.3.5.1 最适反应温度和温度稳定性
将纯化后的酶液与底物分别在 20、25、30、37、40、45、50、55、60℃条件下测定酶活力,以测得的最高活力为100%,计算出其余温度下的相对酶活,确定该酶的最适反应温度。将纯化后的酶液分别于20、30、37、40、45、50℃条件下恒温放置1 h后测定残余酶活,以反应所测的最高酶活力为100%,探讨酶的热稳定性。
1.3.5.2 最适反应pH值及pH值稳定性
将等量的纯酶液置于不同 pH 值(4、5、6、7、8、9)的缓冲液中,于37℃反应测定酶活力,考察该酶在不同pH值条件下的酶活力,确定该酶的最适pH值。将等量的酶液分别与不同 pH 值(4、5、6、7、8、9)的缓冲液在4℃放置4 h后,测定残余的酶活力,考察酶在不同pH值下的稳定性。
1.3.5.3 酶的乙醇耐受性以及NaCl耐受性
将纯化的酶液加入含底物不同体积分数(0%~30%)的乙醇溶液中,于37℃反应后测定酶的活力,观察不同体积分数乙醇溶液对酶活力的影响。将酶液加入含底物不同质量浓度(0%~20%)的NaCl溶液中,反应结束后测定酶的残余酶活力,观察酶对NaCl的耐受性。
1.3.5.4 底物特异性
在最适的条件下,将酶液分别与不同底物(氨基甲酸甲酯、氨基甲酸乙酯、丁基氨基甲酸酯、乙酰胺、丁酰胺、丙烯酰胺、甲基丙烯酰胺、烟酰胺)反应测定酶活力,以酶对氨基甲酸乙酯的酶活为100%,换算得到酶对其他底物的降解活性。
1.3.5.5 金属离子与化学试剂对酶活力的影响
将酶液与终浓度为1 mmol/L的不同金属离子(Cu2+、Mg2+、Ba2+、Mn2+、Zn2+、Ca2+、Fe2+、Co2+、Fe3+) 以及终浓度为0.1 mmol/L(0.1%)的化学试剂混合,于37℃保温5 min后加入底物测定酶的残余酶活力,研究金属离子与化学试剂对酶活力的影响。
1.3.5.6 酶的反应动力学性质
将纯化后的酶液与不同终浓度(5mmol/L~50mmol/L)的氨基甲酸乙酯底物作用,在37℃磷酸盐缓冲液中测定酶反应的初速度,用Lineweaver-Burk双倒数作图法求出酶对底物的Km值和Vmax值。
2 结果与分析
2.1 重组表达载体的构建
本文采用pET-30a(+)质粒作为克隆及表达载体,克隆菌株为E.coli strain DH5α,因此挑取单菌落进行过夜培养后,提取质粒后用限制性内切酶NdeⅠ和XhoⅠ进行酶切处理,对目的基因的大小进行验证。取双酶切之后的反应产物经1%琼脂糖凝胶电泳进行检测,结果如图1所示。
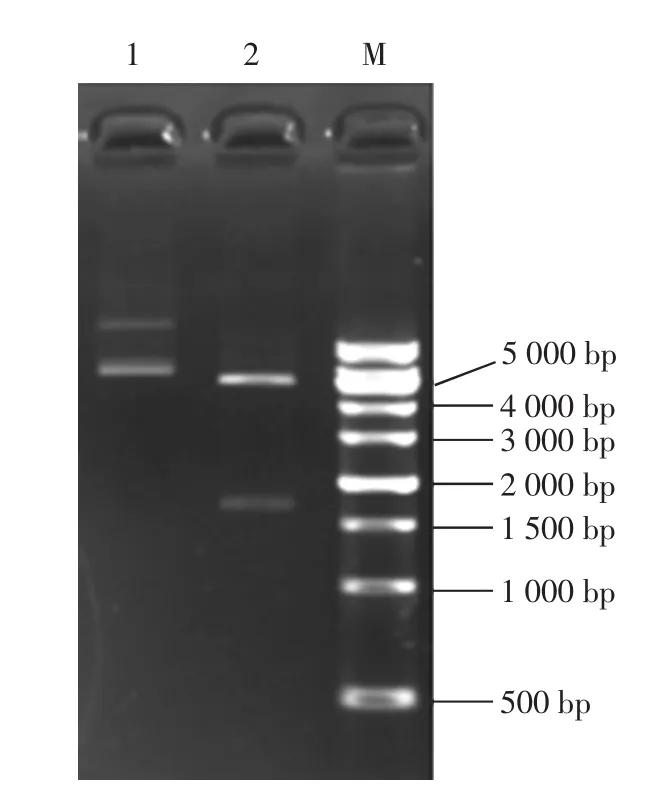
图1 重组质粒双酶切产物电泳图Fig.1 The electropherogram of recombinant plasmid double digestion product
如图1所示,1号泳道代表未经双酶切处理的重组质粒,2号泳道代表经过内切酶NdeⅠ和XhoⅠ处理的重组质粒,因此显示共有两条带,其中第一条为线性pET-30a(+)质粒,大小为5 231 bp,另外一条为目的基因,大小为1 703 bp,表明目的基因与载体质粒连接成功,可以进行后续的转化表达。
2.2 重组氨基甲酸乙酯水解酶的诱导表达及纯化
对重组菌诱导后的表达蛋白进行超声破碎,经SDS-PAGE进行蛋白条带检测,结果见图2。
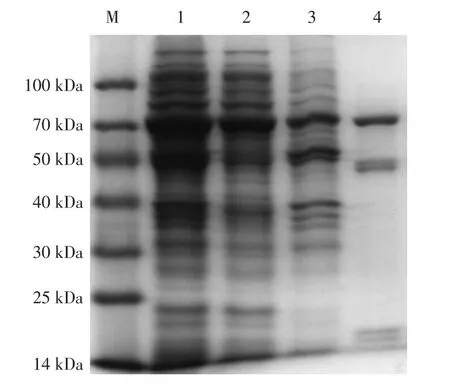
图2 重组氨基甲酸乙酯水解酶分离纯化过程SDS-PAGE分析Fig.2 SDS-PAGE analysis in the purification process of recombinant urethanase
从图2可以看出,在70 kDa附近有明显的目的条带,粗酶液经亲和层析柱纯化后得到目的蛋白条带,粗酶液的比活力为4.52 U/mg,纯化后的酶比活力达到9.86 U/mg,是纯化前的2.18倍。
2.3 温度与pH值对重组氨基甲酸乙酯水解酶酶活的影响
不同温度和pH值下的重组氨基甲酸乙酯水解酶酶活力结果如图3所示。
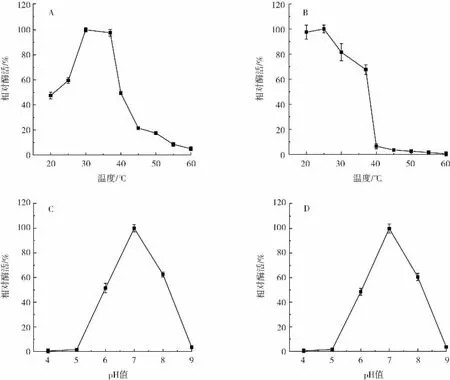
图3 温度和pH值对重组氨基甲酸乙酯水解酶的影响Fig.3 Effects of temperature and pH on the activity of recombinant urethanase
由图3A可知,重组水解酶的酶活随着温度的逐渐升高呈现先上升后下降的趋势,重组酶在20℃~40℃范围内相对活性在50%以上,最适反应温度为30℃;由图3B可知,重组酶在40℃以下处理1 h后,仍能保持70%以上的酶活力,高于40℃后,酶活力几乎完全丧失,结果表明,重组酶在20℃~40℃的情况下具有良好的反应活性以及热稳定性。
由图3C可知,在pH4~9条件下,随着pH值的升高,酶活力呈先上升后下降的趋势。在pH7时,酶活力最高,为UH的最适反应pH值,最适pH值范围为6~8,相对活力在50%以上。将该酶分别在pH值为4~9条件下,4℃放置4 h后测定酶活力,如图3D所示,当酶在pH值为6~8时,酶活力基本稳定,能维持50%以上的酶活力,当pH值低于6或大于8时,酶活力迅速下降。该结果表明,重组酶在中性范围内具有较好的反应活性以及稳定性。
2.4 乙醇与盐对氨基甲酸乙酯水解酶酶活的影响
乙醇体积分数和NaCl质量浓度对氨基甲酸乙酯水解酶的影响见图4。
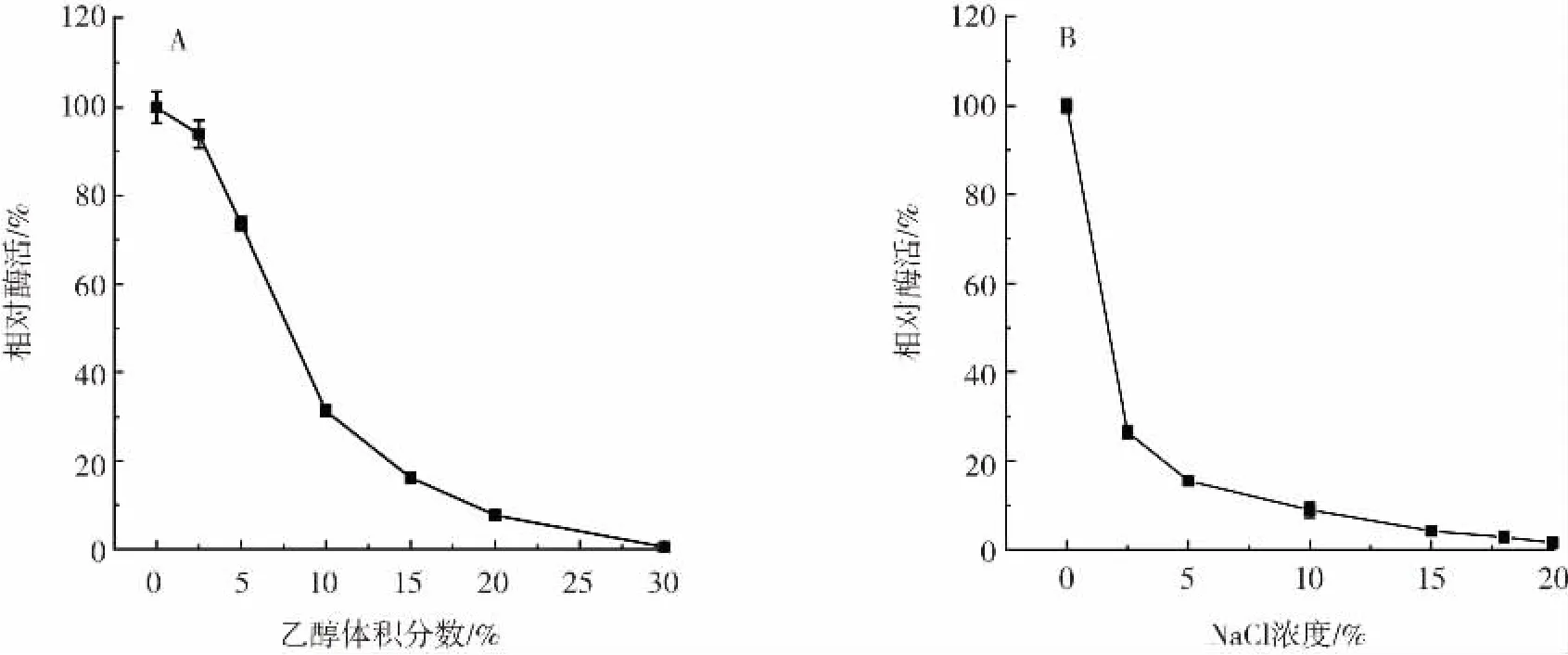
图4 乙醇体积分数和NaCl质量浓度对氨基甲酸乙酯水解酶的影响Fig.4 Effects of ethanol volume fraction and NaCl concentration on the activity of urethanase
由图4A可知,当乙醇体积分数为10%时,UH的相对酶活在30%左右,当乙醇体积分数大于20%时,残余酶活力不到原来的10%。由图4B可知,当NaCl质量分数为2.5%时,UH的酶活力只有初始酶活力的20%。结果表明,与已报道过的氨基甲酸乙酯水解酶[15-17]相比,UH对低质量分数的NaCl以及低体积分数乙醇具有一定耐受性。
2.5 金属离子与化学试剂对重组氨基甲酸乙酯水解酶酶活的影响
不同的金属离子与化学试剂对氨基甲酸乙酯水解酶的酶活影响见图5。
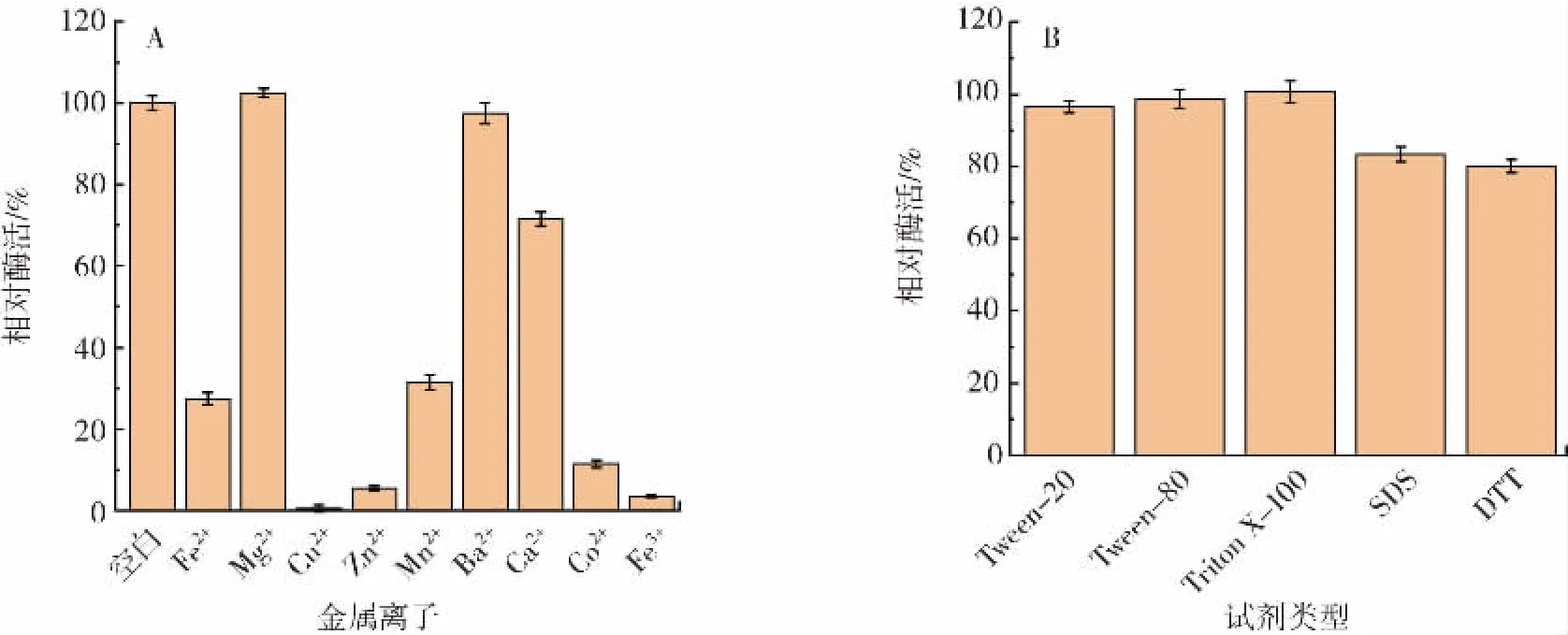
图5 金属离子和化学试剂对重组氨基甲酸乙酯水解酶酶活的影响Fig.5 Effects of metal ions and chemicals on the activity of recombinant urethanase
由图5A可知,除了Mg2+外其它金属离子对UH的酶活都有不同程度的抑制作用,其中Cu2+、Zn2+、Fe3+使酶活力降至原来的10%以下,其中Cu2+几乎能完全抑制酶活。此结果与Patel等[27]研究得到的Cu2+可加快氧化自身半胱氨酸分子,从而使得二硫键或亚磺酸在分子内或分子间形成,最终导致酶活力受到严重抑制结果一致。由图5B可知,在不同种表面活性剂和抑制剂存在的情况下,酶活力依然在80%以上,且在表面活性剂吐温-20、吐温-80以及曲拉通X-100存在时,酶活力均在95%以上,表明其对酶活力影响较小。
2.6 重组氨基甲酸乙酯水解酶的底物特异性及动力学参数
氨基甲酸乙酯水解酶的底物特异性分析结果如表1所示。

表1 氨基甲酸乙酯水解酶的底物特异性Table 1 Substrate specificity of urethanase%
由表1可知,将UH对氨基甲酸乙酯的降解活性设为100%,可以看出酶对氨基甲酸酯类化合物以及酰胺类化合物均具有降解活性,对一些L-氨基酸类物质以及尿素无降解活性,与Kazuo等[24]研究氨基甲酸乙酯水解酶对于氨基酸和尿素无降解活性的结果相符,UH对于2A级的致癌物丙烯酰胺同样具有较高的水解活性,说明在降解丙烯酰胺方面具有良好的应用前景[28]。水解酶对于氨基甲酸甲酯、氨基甲酸丁酯的降解相对酶活分别为110.05%、7.02%,表明随着底物碳原子数的增加,水解酶的水解能力逐渐降低[23]。
以氨基甲酸乙酯为底物,通过测定重组酶在不同底物浓度下的酶活,计算出初始反应速率,根据Lineweaver-Burk双倒数法作图后计算得到UH的酶促反应参数Km值为6.64mmol/L,Vmax值为8.24μmol/min。与来源于肺炎克雷伯氏菌[23]和变幻青霉[29]的氨基甲酸乙酯水解酶的Km分别为74 mmol/L和27.2 mmol/L相比,本研究中UH的Km值相对更低,表明该酶与底物的亲和力更大。
3 结论
根据大肠杆菌系统对密码子的偏好性,将来源于Lodderomyces elongisporus菌属的氨基甲酸乙酯水解酶的氨基酸序列进行密码子优化后合成其目的基因,并转化至E.coli BL21感受态细胞中进行异源表达后得到分子量大小约为70 kDa左右的重组蛋白,将蛋白粗酶液进行超声破碎后经镍柱进行纯化后,水解酶的比活力达到了9.86 U/mg,是纯化前的2.18倍。最适反应温度为30℃,在最适反应温度及以下,酶的稳定性较好;最适pH值为7.0,在pH6.0~8.0时酶的活性以及稳定性较好。UH对低质量分数的NaCl溶液以及低体积分数的乙醇溶液具有一定耐受性,并且在乙醇体积分数低于12%时,酶活力可以保持在50%以上。不同种类的金属离子对酶活均有不同程度的抑制作用,尤其是Cu2+、Fe3+存在的情况下,酶活力几乎丧失。酶对氨基甲酸酯类化合物、酰胺类化合物有较强的降解能力,但是对于一些L-氨基酸类物质以及尿素没有活性,表明其属于一种酰胺类的酶。以氨基甲酸乙酯作为反应底物时,氨基甲酸乙酯水解酶的酶促反应参数Km值为 6.64 mmol/L,Vmax值为 8.24 μmol/min。本研究通过对蛋白的目的基因进行合成后表达,验证其具有氨基甲酸乙酯水解酶的活性,使UH的来源得到了丰富,同时为后续实际应用提供了很好的参考价值。
