磷脂酶D水解活性测定方法的研究
2022-06-14王鋆坦郭碧珊张梦雪朱海华许君刘红伟王法云王慧
王鋆坦,郭碧珊,张梦雪,朱海华*,许君,刘红伟,王法云,王慧
(1.河南省商业科学研究所有限责任公司,河南 郑州 450002;2.河南省食品质量安全控制工程技术研究中心,河南 郑州 450002;3.河南农业大学生命科学学院,河南 郑州 450002;4.上海交通大学公共卫生学院,上海 200025)
磷脂酰丝氨酸(phosphatidylserine,PS)是大脑中调控细胞膜关键蛋白功能状态的磷脂[1],具有提高脑细胞活力、改善记忆力、修复大脑损伤、缓解疲劳以及平衡情绪等多种生理功能[2-3],被称为“脑专一性营养物质”,已通过美国食品药品监督管理局的安全认证,被国家卫生健康委员会批准为新资源食品[4]。磷脂酶D(phospholipase D,PLD)是生物法制备PS的关键合成酶,具备水解磷酸二酯键和碱基互换的能力,可催化高纯度磷脂酰胆碱(phosphatidylcholine,PC)和L-丝氨酸合成PS[5]。PLD在自然界中来源广泛,如植物中的大豆和卷心菜、动物的脑和肝脏、微生物中的链霉菌和酵母等[6-7]。与动植物来源相比,微生物来源的PLD具有较强的底物耐受性,较宽广的底物专一性和较高的碱基交换催化活性[8],从而备受人们关注。此外,PLD在生物膜形成、脂质代谢、细胞调节和信号转导等方面也发挥着重要作用[9-10]。
目前,对PLD的报道多集中在结构及作用机理方面,动力学方面的研究进展缓慢,其中一个限制性因素就是PLD的活力测定困难[11],由于该酶水解反应需在水-有机相系统中进行,且反应产物为磷脂酸(弱酸)[12],为酶活力的快速、准确测定带来不便。传统测定方法如分光光度法和固体显色法是以卵磷脂的相似物为底物间接反映其活力[13],存在灵敏度和准确度不高等问题。此外,还有放射性同位素标记、荧光标记法和高效液相法等,此类方法虽然准确,但操作复杂,不适合酶活力快速检测[14-15]。酶联比色法通过直接测定水解产物来检测酶活,是目前最常用的PLD活力测定方法[16]。该方法灵敏性强、准确性高,但操作复杂,费时且成本大。同时,由于相关研究中的PLD来源不同,酶活定义和计算方法模糊,反应体系和反应条件不同,现仍存在误差偏大、缺乏系统性等诸多问题[17]。而市面上PLD活性检测试剂盒价格普遍较高,对样品的适应性不强,难以满足试验需求[18]。因此,研究开发一种便捷、高效的磷脂酶D水解活性测定方法势在必行。
本研究从反应机理出发,基于酶联比色法对反应底物、反应条件、反应体系、反应终止等方面进行逐步探究和优化,旨在确定一套科学严谨、灵活实用、适用性强的磷脂酶D水解活性测定方法。
1 材料与方法
1.1 材料与试剂
PLD:从链霉菌中分离纯化所得[19];不同来源(蛋黄、大豆、链霉菌)以及不同纯度(PC含量分别为70%、80%、90%)的卵磷脂:生工生物工程(上海)股份有限公司;胆碱氧化酶(10 U/mg):上海碧云天生物技术有限公司;过氧化氢酶(300 U/mg):上海源叶生物科技有限公司;FeCl3、FeSO4、CuCl2、ZnCl2、NaCl、KCl、MnCl2、MgCl2、CaCl2、TritonX-100、甲醇、乙醇、乙酸乙酯、氯仿、石油醚、二甲基亚砜、乙醚、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、4-氨基氨替吡啉、苯酚(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
超净工作台(SW-CJ-2FD):苏州安泰空气技术有限公司;立式压力蒸汽灭菌锅(LDZX-50KBS):上海申安医疗器械厂;振荡培养箱(ZQZY-78CN):上海知楚仪器有限责任公司;台式离心机(CT15RE):日本日立公司;多功能微孔板检测仪(Infine200pro):瑞士迪肯公司。
1.3 方法
1.3.1 反应溶液制备
底物溶液:用80%乙醇溶液溶解蛋黄卵磷脂至终浓度为10 mg/mL,涡旋振荡5 min后置于冰上待用;胆碱氧化酶母液:用蒸馏水溶解胆碱氧化酶至终浓度为250 U/mL,存放于-20℃待用;过氧化氢酶母液:用0.05 mol/L磷酸钾缓冲液溶解过氧化氢酶至终浓度为200 U/mL存放于4℃待用。
1.3.2 酶联比色法测定磷脂酶D水解活性
1.3.2.1 反应原理
反应分为3个阶段:底物磷脂酰胆碱经PLD水解生成磷脂酸和胆碱;胆碱在胆碱氧化酶的作用下生成甜菜碱和H2O2;H2O2酶将H2O2分解为氧化物,氧化4-氨基氨替吡啉和苯酚生成粉红色醌类混合物,于500 nm波长处下测定吸光值[20-21]。
1.3.2.2 反应体系
磷脂酶D酶活检测包括解离和显色两个反应体系。解离反应体系:200 μL反应液A中加入200 μL底物溶液,37℃、200 r/min摇床预混合5min。加入100 μL稀释后的酶液继续反应10 min。反应结束后向解离体系中加200 μL反应终止液,37℃、200 r/min的振荡培养箱中反应5 min,12 000 r/min离心取上清液。显色反应体系:取2.5mL反应液B加入离心后上清并混匀,加入2 U胆碱氧化酶,2 U过氧化氢酶,放入摇床37℃、200 r/min反应30 min,制备为待测样品溶液。
酶活测定反应体系的组成如表1所示。

表1 酶活测定反应体系的组成Table 1 Composition of reaction system for determination of enzyme activity
1.3.2.3 吸光度的检测
使用全波长酶标仪进行吸光度检测。取100 μL待测样品溶液加入96孔板在500 nm波长处检测吸光度值,分别以空板和去离子水为对照,对照组和试验组的每个样品做3组平行,计算均值和方差。
1.3.2.4 磷脂酶D水解活性的计算
磷脂酶D水解活性定义:在温度为37℃和pH值为5.5的条件下,磷脂酶D每分钟解离磷脂酰胆碱生成1 μmol胆碱所需的酶量为一个酶活力单位。
酶活力计算如下式所示。

式中:D为发酵液稀释倍数;n为胆碱物质的量,mol;t为PLD水解时间,10 min;V为所取发酵液体积,0.1 mL。
1.3.3 底物来源的选择及底物溶液制备
1.3.3.1 底物来源及纯度的选择
选择不同来源(大豆、蛋黄、链霉菌)以及不同纯度(PC含量分别为70%、80%、90%)的卵磷脂配制底物溶液进行酶活力测定。定义最高酶活力为100%,以相对酶活作图。
1.3.3.2 底物溶剂及浓度的选择
选择甲醇、乙醇、乙酸乙酯、氯仿、石油醚、二甲基亚砜、乙醚等有机溶剂配制10 mg/mL的底物溶液,涡旋振荡15 min,观察底物溶解难易情况及反应颜色变化。对其中效果较好的乙醇溶液进一步优化,分别以30%、40%、50%、60%、70%、80%、90%、100%的乙醇溶液作溶剂进行酶活力测定。定义最高酶活力为100%,以相对酶活作图。
1.3.4 磷脂酶D酶学性质测定
最佳反应温度:分别设置温度为30、37、44、51、58、65、72℃进行酶活力测定。定义最高酶活力为100%,以相对酶活作图。
最佳反应pH值:分别设置pH值为4.0、4.5、5.0、5.5、6.0、6.5、7.0进行酶活力测定。定义最高酶活力为100%,以相对酶活作图。
最佳金属离子助剂:对不添加金属离子的对照组和分别添加终浓度为10 mmol/L的金属离子(Fe3+、Fe2+、Cu2+、Zn2+、Na+、K+、Mn2+、Mg2+、Ca2+) 试验组进行酶活力测定[22]。定义对照组酶活力为100%,以相对酶活作图。
1.4 统计分析
试验重复3次,取平均值,采用SAS软件进行显著性分析。
2 结果与分析
2.1 磷脂酶D水解活性标准曲线
底物磷脂酰胆碱经PLD水解生成了磷脂酸和胆碱,胆碱作为反应物进行下一阶段的酶联反应,它极易吸收二氧化碳和水且遇热分解,在酸性的反应体系中会生成更稳定的氯化胆碱[23]。为了对酶水解反应中生成的胆碱进行定量,测定了以氯化胆碱物质的量为横坐标,500 nm下的吸光度为纵坐标的标准曲线,结果见图1。
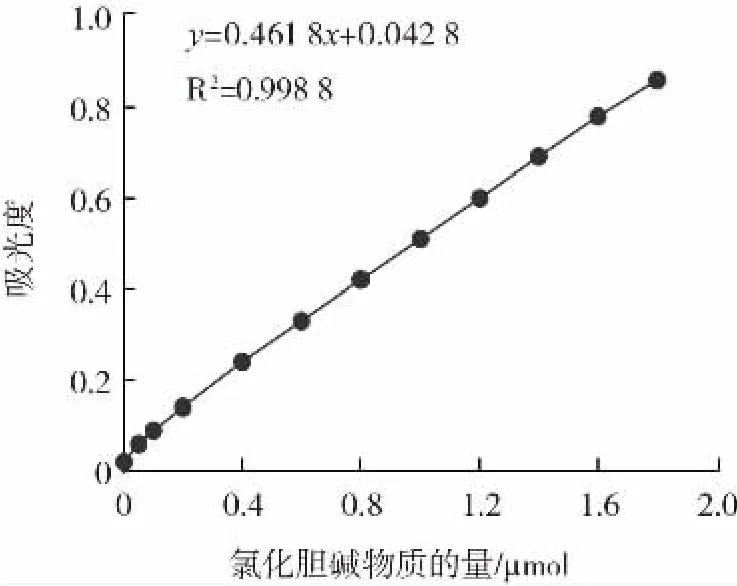
图1 磷脂酶D水解活性标准曲线Fig.1 Standard curve of activity of phospholipolysis D
由图1可知,氯化胆碱物质的量在0~2.0 μmol范围内,与吸光度有良好的线性关系,回归方程为y=0.461 8x+0.042 8,R2=0.998 8。根据回归方程计算n[23]。
2.2 底物来源及纯度的选择
底物卵磷脂对相对酶活的影响结果见图2。
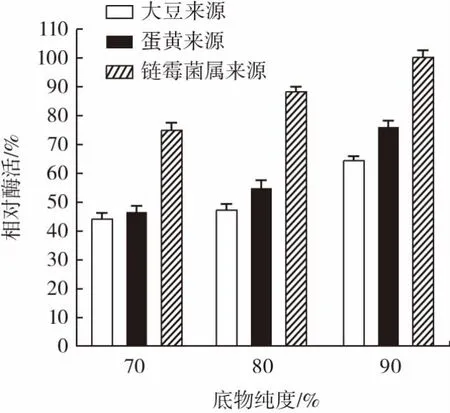
图2 不同来源及纯度的卵磷脂与相对酶活的关系Fig.2 Relationship between lecithin from different sources and purity and relative enzyme activity
由图2可知,链霉菌来源的卵磷脂的相对酶活检测水平最高,70%纯度的底物相对酶活可保持在78%。大豆来源的卵磷脂的相对酶活最低,90%纯度的底物的相对酶活仅有62%。蛋黄卵磷脂的相对酶活随纯度的升高逐渐增强,90%纯度的蛋黄卵磷脂作为底物的相对酶活能保持在75%。鉴于链霉菌来源的卵磷脂价格昂贵,大豆来源的卵磷脂相对酶活检测稳定性差,90%纯度的蛋黄卵磷脂成本低廉,相对酶活检测稳定性高。综合考虑选择90%纯度的蛋黄卵磷脂作为底物。
2.3 底物溶剂及浓度的选择
2.3.1 底物溶剂的选择
卵磷脂是一种混合物,除含有参与反应的磷脂酰胆碱外,还包含磷脂酰乙醇胺、磷脂酰肌醇和胆碱等物质[24]。有机磷脂有其特定的溶解条件,根据相似相溶原理,需用极性有机试剂溶解。不同溶剂对底物卵磷脂的溶解情况见表2。
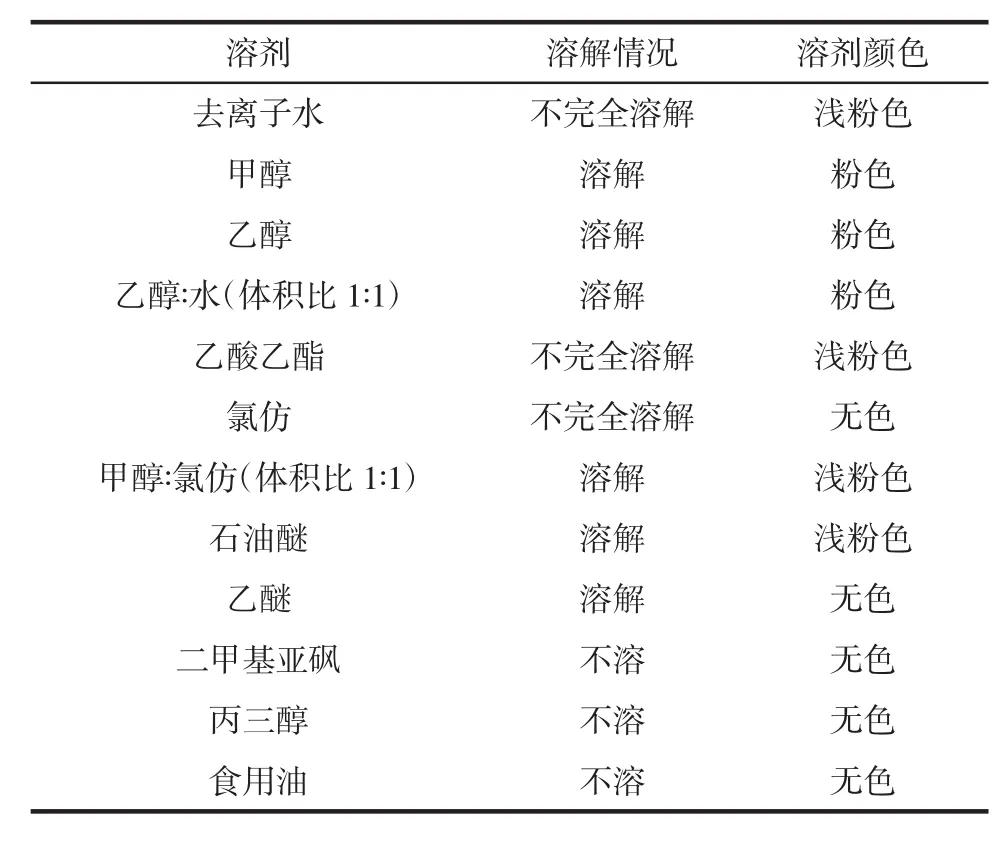
表2 不同溶剂溶解卵磷脂的情况及反应颜色变化Table 2 The situation of dissolving lecithin in different solvents and the change of reaction color
由表2可知,选择不同试剂溶解底物,发现简单醇类对卵磷脂溶解度较好,甲醇、乙醇、乙醇水溶液这3种溶剂对底物溶解情况最佳,颜色变化也相对更明显。考虑到酶联反应的特殊性,溶剂在保证能完全溶解底物的同时须兼顾后续反应,对体系中其它反应物也要有较好的溶解度。由于反应在水相中进行,而卵磷脂、胆碱、苯醌都能溶于乙醇,因此选择乙醇水溶液作为底物溶剂。
2.3.2 乙醇含量的选择
乙醇含量对相对酶活的影响结果见图3。
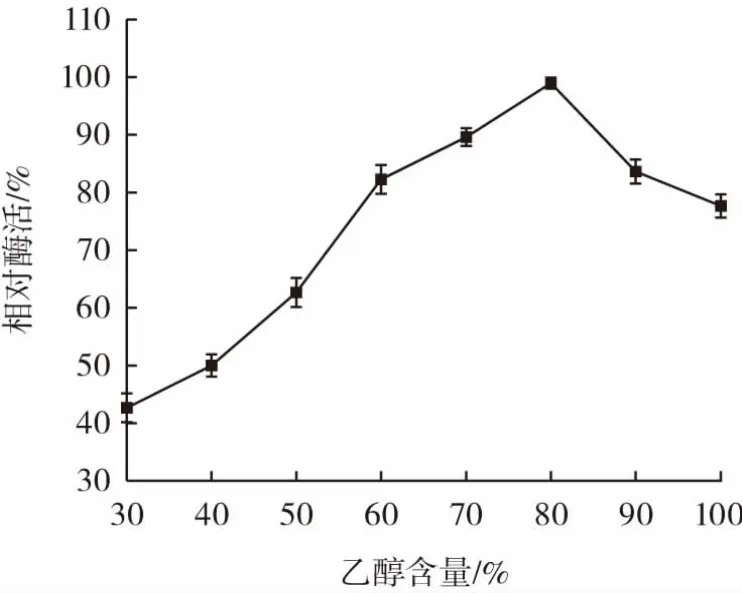
图3 乙醇含量与相对酶活的关系Fig.3 Relationship between ethanol content and relative enzyme activity
由图3可知,当乙醇含量为30%时,相对酶活仅有42%。随着乙醇占比增高,PLD的相对酶活也逐渐增高,在乙醇含量为80%时,PLD相对酶活达到最高;乙醇含量达到90%时,相对酶活明显下降,保持在85%。乙醇含量在90%~100%之间相对酶活差异不明显,无水乙醇作底物溶剂时相对酶活为78%。
2.4 磷脂酶D的酶学性质
2.4.1 最佳反应温度
温度对相对酶活的影响结果见图4。
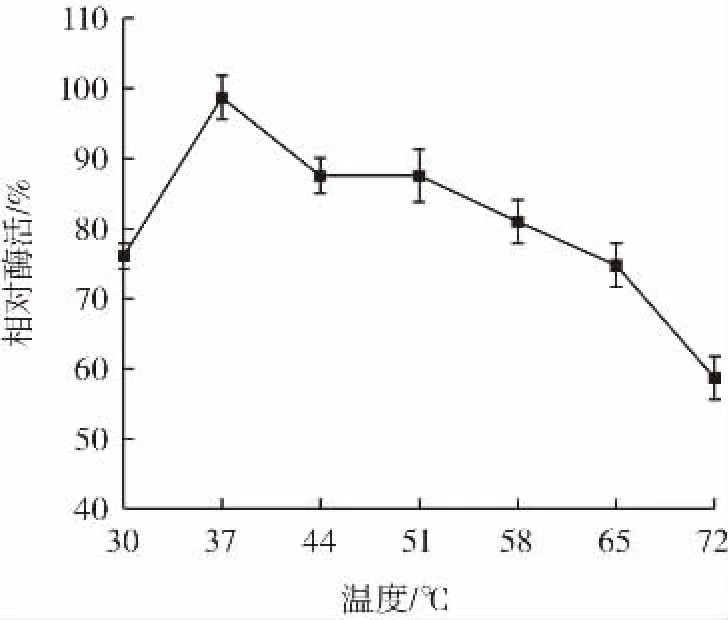
图4 温度与相对酶活的关系Fig.4 Relationship between temperature and relative enzyme activity
由图4可知,在37℃时,测得的PLD酶活力水平最高,以其为对照,计算其它温度下的相对酶活。随着温度的升高,相对酶活逐渐升高,当温度升高到44℃时,PLD相对酶活明显下降,在44℃~51℃之间相对酶活差异不明显,72℃时相对酶活达到最小值。
2.4.2 最佳反应pH值
pH值对相对酶活的影响结果见图5。由于PLD酶解离磷脂酰胆碱生成胆碱的反应在酸性环境下进行,因此设置pH值均小于7。
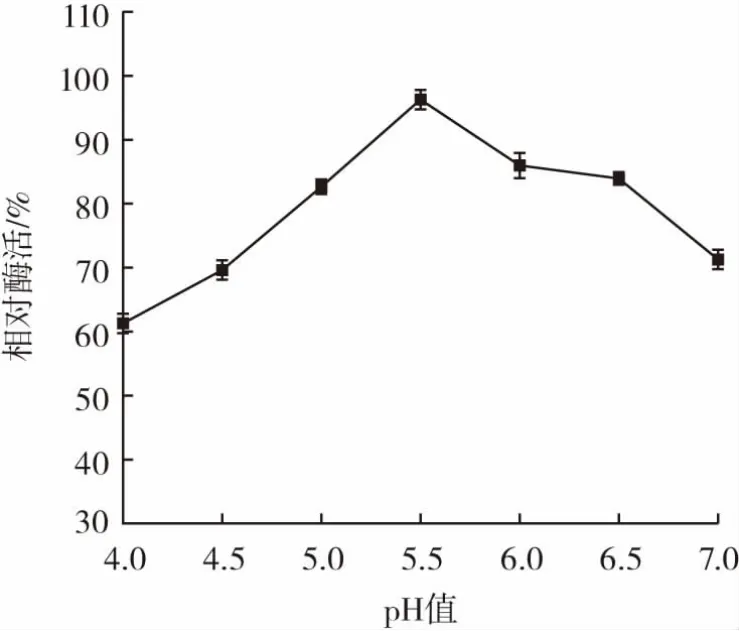
图5 pH值与相对酶活的关系Fig.5 Relationship between pH and relative enzyme activity
由图5可知,pH值为4.0时相对酶活仅为60%,随着pH值的升高,PLD的相对酶活逐渐增高,在pH值为5.5时达到最高值,pH值为6.0时PLD相对酶活保持在85%,pH值在6.0~6.5之间相对酶活差异不明显,在pH值为7.0时仍能保持72%的相对酶活。
2.4.3 不同金属离子对相对酶活的影响
不同金属离子对相对酶活的影响结果见图6。
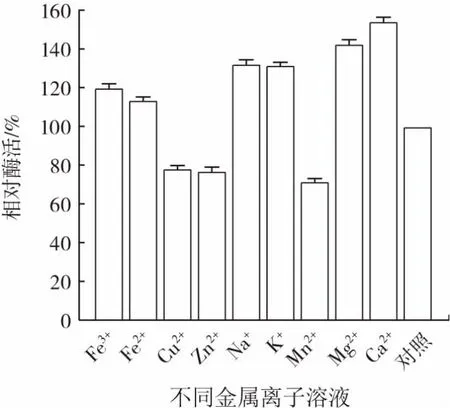
图6 不同金属离子与相对酶活的关系Fig.6 Relationship between different metal ions and relative enzyme activity
由图6可知,加入 Cu2+、Zn2+、Mn2+时,PLD 的相对酶活明显下降,其中Mn2+最低,相对酶活为71%。加入Fe3+、Fe2+、Na+、K+、Mg2+、Ca2+时,PLD 的相对酶活升高,分别为120%、118%、130%、132%、140%和150%,加入Ca2+后相对酶活的提升最为明显,较对照组提高了50%。
3 结论
本文通过对酶联比色法测定磷脂酶D水解活性的方法进行研究,分别对反应底物、反应体系、反应条件和反应过程进行了一定的改良和优化。选择蛋黄卵磷脂和80%的乙醇溶液配制底物溶剂,同时配制反应液A、B,简化试验步骤,试验测得水解反应的最佳条件为37℃,pH值为5.5,同时加入10 mmol/L CaCl2作为金属离子助剂。反应终止液成分:0.1 mol/L pH值为8.0的 Tris-HCl、10 mmol/L EDTA 和 10 g/L 16-烷基-3-甲基氯化铵。该方法测定磷脂酶D的酶活力在保证灵敏度的情况下兼具可操作性,减少了对仪器设备和样品种类的限制,降低了成本,有较强的应用价值。
