DNTF 原位红外热分解动力学及机理
2022-06-14王煊军金朋刚
南 海,潘 清,姜 帆,王煊军,金朋刚,张 坤
(1. 火箭军工程大学,陕西 西安 710025;2. 西安近代化学研究所,陕西 西安 710065)
1 引言
呋咱类(含氧化呋咱类)炸药是高能量密度化合物(HEDC)研发的重要方向[1-2],研究发现一个氧化呋咱基代替一个硝基,可以使密度提高0.06~0.08 g·cm-3,爆速提高约300 m·s-1[3]。3,4⁃二硝基呋咱基氧化呋咱(DNTF)是一种典型的呋咱类化合物,密度为1.937 g·cm-3,爆速为9250 m·s-1,爆热为5799 kJ·kg-1,熔点为106~111 ℃,其能量高于HMX(环四亚甲基四硝铵),与CL⁃20(六硝基六氮杂异伍兹烷)炸药相接近,因其具有熔点低、能量高、稳定性好等特点的性能而受到了广泛的关注,并在炸药、传爆药、推进剂、发射药等领域进行了相关应用研究[4-19]。
在DNTF 热分解研究方面已开展了相关研究工作,DNTF 属于液相分解,能与催化剂充分作用;与非等温条件下比较,DNTF 的绝热热分解具有较高的活化能和指前因子[20],一旦超过一定温度后DNTF 将迅速分解。西安近代化学研究所等利用差示扫描量热(DSC)[21-23]和等温加热测试[24],通过对不同条件(压强、加热速率、温度等)下DNTF 的活化能、指前因子以及爆炸临界温度进行分析,认为DNTF 在低温下具有良好的热稳定性,其热稳定性接近HMX。刘芮[25]通过动态测压热分析技术(DPTA)与气体质谱仪联合测试发现,DNTF 的气体产物有CO、N2、NO、N2O、CO2、NO2等,低熔点炸药的DPTA 热分解是通过C—NO2断裂生成NO2,通过—NO2→—ONO 重排后断键生成NO 和CO,且存在CO+NO2→CO2+NO 平衡反应;任晓宁[26]根据快速扫描傅里叶变换红外光谱对DNTF裂解气相产物的实时跟踪分析,认为DNTF 分解首先从C—NO2开始,存在均裂生成NO2和异构化生成NO 两条竞争分解的可能途径。蒋秋黎等[27]探究了铅、铜盐催化剂对DNTF 炸药热分解及烤燃响应特性,发现选择合适的有机铜盐催化剂可有效降低DNTF 基炸药的热响应等级,这与DNTF 分解机制是密切相关的。虽然前期研究已获得了DNTF 材料自身的热分解特性,但是针对DNTF 分子中各个基团热分解性能的相关研究不足,对DNTF 的详细热分解机理尚不完全明晰。
因此,为了进一步探究DNTF 分子中各个基团热分解性能,本研究通过测试DNTF 不同温度的红外特性,分析其分解过程中官能团的变化情况,获得在不同升温速率下DNTF 的特征基团随温度的变化规律,获取分解动力学参数及机理函数。同时,结合分子动力学方法对DNTF 特征基团的热分解特性及分子结构进行建模和计算,推测获得DNTF 的热分解机理。
2 实验部分
2.1 材料与仪器
3,4⁃二硝基呋咱基氧化呋咱(DNTF),白色粉末,样品纯度大于99%,西安近代化学研究所,其分子式为C6O8N8,化学结构式见图1。
DSC Q200 型差示扫描量热仪,美国TA 公司;傅里叶变换红外光谱仪,NEXUS 870 型,美国Thermo⁃Fisher 公司;变温红外池原位池,检测器为电热型氘代硫酸三苷肽(DTGS),敞口无窗片型,厦门大学。
2.2 实验条件
DSC 实验:气氛为动态高纯氮,流量50 mL·min-1,压强为0.1 MPa,升温速率为5.0 ℃·min-1,试样质量为(1.0±0.01)mg,试样皿为铝池。
变温红外光谱原位池实验:变温反应池升温速率为2.5,5.0,10 ℃·min-1,检测温度范围:25~465 ℃,红外光谱分辨率为4 cm-1;扫描速率为1.8988 cm·s-1。将0.7 mg 待测样品粉碎成粉末状,加入干燥研细的溴化钾粉末150 mg,充分研磨后压片,即可获得直径13 mm,厚约1 mm 的透明或均匀半透明的盐片,放入变温池中,待测。
3 结果与讨论
3.1 官能团红外光谱特性
为了对常温下DNTF 的特征官能团进行分析,对其在常温下红外吸收峰进行研究,结果如图2 所示。
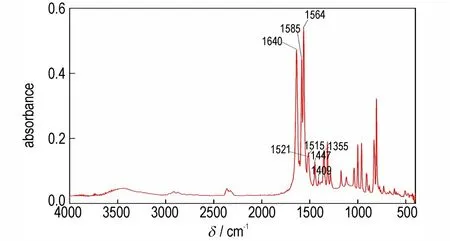
图2 DNTF 红外谱图(25 ℃)Fig.2 FTIR of DNTF(25 ℃)
DNTF 分子结构主要由氧化呋咱环、呋咱环以及硝基等基团组成,其中氧化呋咱环的骨架振动特征频率为1640、1515、1447 cm-1,呋咱环的骨架振动特征频率为1585、1564、1447、1409 cm-1,硝基的对称伸缩振动为1355 cm-1,非对称伸缩振动为1521 cm-1。
采用DSC 方法对DNTF 热分解过程进行研究,得到DSC 曲线如图3 所示。
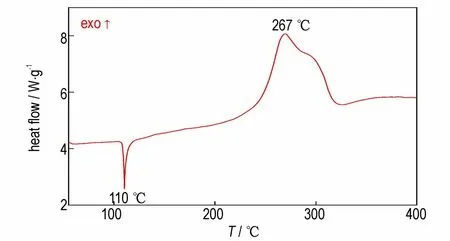
图3 升温速率5.0 ℃·min-1时DNTF 的DSC 曲线Fig.3 DSC curve of DNTF at heating rate of 5.0 ℃·min-1
由图3 可知,在110 ℃时,DNTF 出现一个吸收峰,这主要是由于DNTF 发生了熔化现象,即发生了由固相向液相的转变;随着温度的升高,出现了放热峰,峰值温度为267 ℃,表明DNTF 的加热分解过程可分为二个阶段:第一阶段为DNTF 炸药熔化阶段,第二阶段为DNTF 炸药分解阶段。在此基础之上,获得了不同温度熔化阶段DNTF 的红外光谱如图4 所示。
由图4 可知,在DNTF 熔化发生前,随着温度不断升高,DNTF 炸药的特征峰及其吸收光谱度并没发生显著变化,当温度达到熔点(100~110 ℃)附近时,硝基、氧化呋咱环以及呋咱环等特征峰的吸收强度有所降低,1640 cm-1与1585 cm-1之间特征区一些裂分的谱带发生了合并现象,呋咱环区域(1585 cm-1与1564 cm-1)进而形成了一个较宽的谱带,这一现象主要是在热作用条件下,炸药分子结构的基团振动获得释放,红外活性增强所导致[28]。

图4 熔化阶段不同温度下DNTF 的红外光谱曲线Fig.4 IR spectrum curves of DNTF at different temperatures in melting stage
3.2 特征基团动力学参数
根据DSC 热分解特性,DNTF 的变温红外光谱可分为熔化阶段和反应分解阶段,DNTF 特征基团的动力学参数是基于反应分解阶段进行计算,选择具有代表性且峰值明显的基团特征峰,其中取DNTF 的氧化呋咱环(1640 cm-1),呋咱环(1585 cm-1、1564 cm-1),硝基(1355 cm-1)的峰面积相对值为相对红外吸收强度,测试获得了2.5、5.0、10 ℃·min-1等三种升温速率下的变化曲线,将峰值面积随温度(时间)变化关系转换为转化率(α)与温度(时间)的关系为:

式中,α为转化率,Sx为某一温度下的峰面积值,℃-1,Smin、Smax为分解范围内峰值面积的最小值、最大值。
DNTF 的三种不同特征基团在不同升温速率下的转化率曲线如图5 所示。
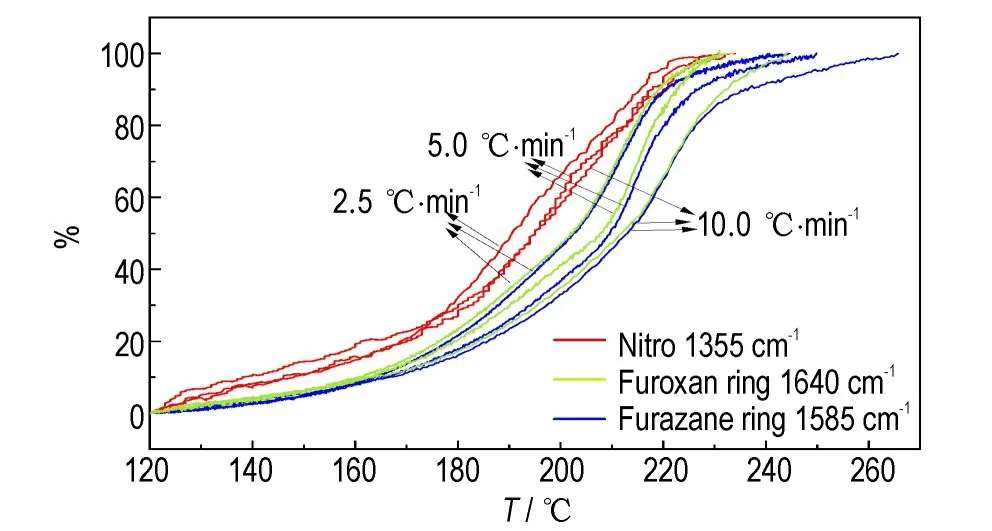
图5 硝基、呋咱环和氧化呋咱环的红外热解曲线Fig.5 Decomposition curves of nitro,furazan ring and furox⁃an ring
由于采用Coats⁃Redfern 法[29](式(2))可对材料分解机理函数进行推测,故针对转化率与温度的变化关系,使用该方法分别计算获得不同加热速率条件下的硝基、氧化呋咱环、呋咱环的活化能与指前因子等动力学参数。

式中,G(α)为机理函数方程;T为温度,K;α为转化率;β为升温速率,K·min-1;A为指前因子,s-1;R为气体常数,8.314 J·mol-1·K-1;Ea为表观活化能,J·mol-1。
通过特征基团转化率(10%~80%)的数据计算获得了基团的活化能(Ea)和指前因子(lnA),结果显示DNTF 炸药三种特征基团的热分解受到三维扩散机理控制,反应机理服从Jander 方程[30],机理函数方程为(1-(1-α)1/3)2,具有较高的相关系数(r>0.99),三种特征基团的动力学参数见表1。
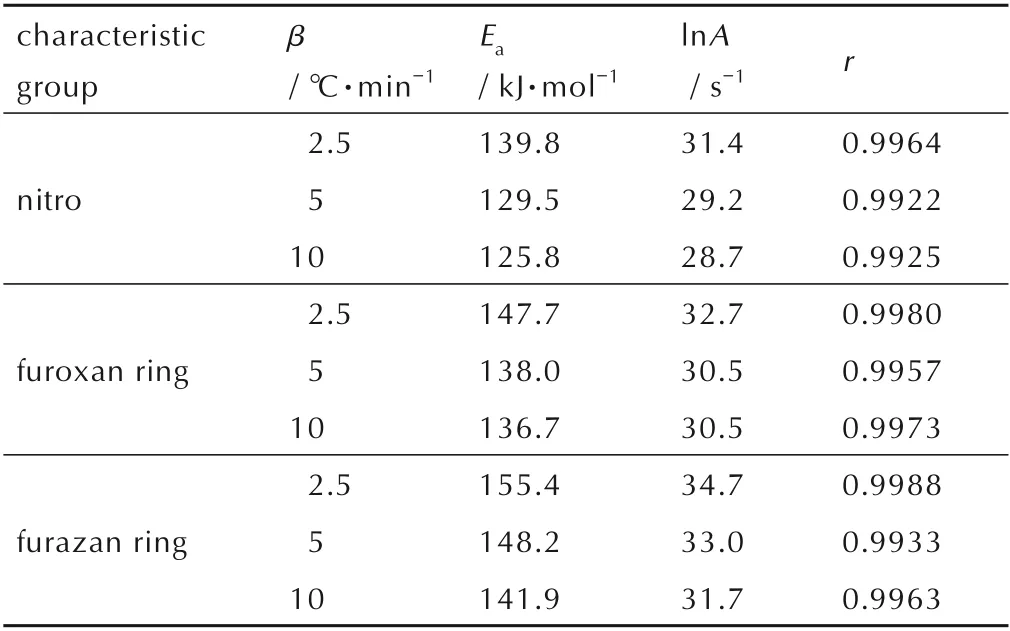
表1 三种特征基团的动力学参数Table 1 Kinetic parameters of the three characteristic groups
通过表1 三种不同加热速率条件的材料特征基团的动力学参数对比,可以发现随着加热速率提高,三种官能团呈现出了活化能降低、反应速率加快的趋势,其中氧化呋咱环与呋咱环的Arrhenius 方程曲线出现了“等反应速率”的交叉点,表明随着温度升高,氧化呋咱环与呋咱环的反应速率趋于一致。
DNTF 试样在变温红外原位池中受热分解,凝聚相热分解产物主要官能团的红外吸收强度与温度(时间)变化关系见图6。
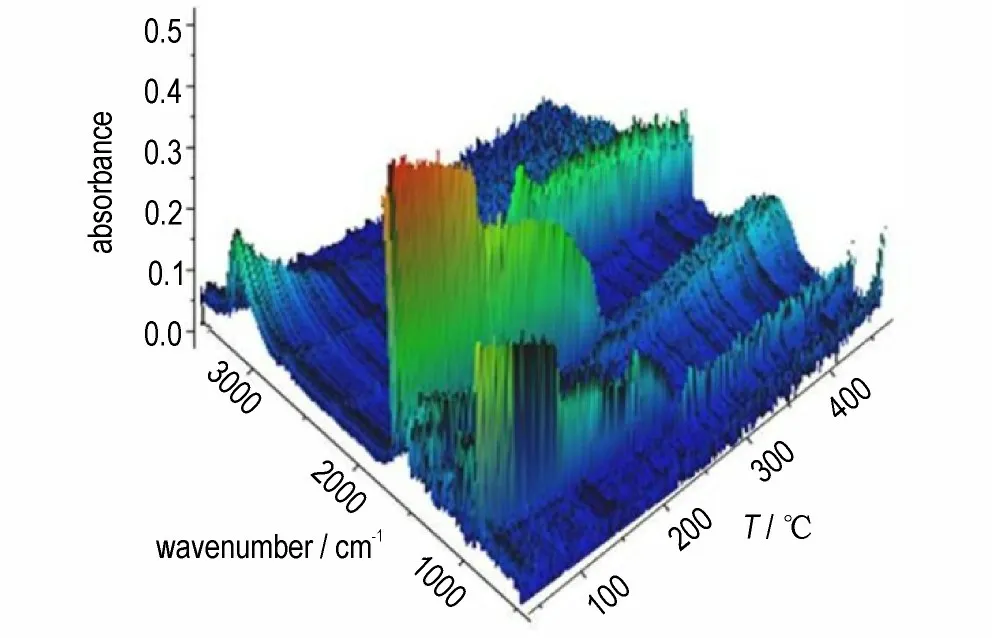
图6 DNTF 三维红外光谱Fig.6 Three dimensional IR spectra of DNTF
根据阿伦尼乌斯公式(Arrhenius 方程[31]),结合表1 的动力学参数,计算获得了2.5、5.0、10 ℃·min-1加热速率条件下各官能团的lnk与1/T的关系曲线见图7。
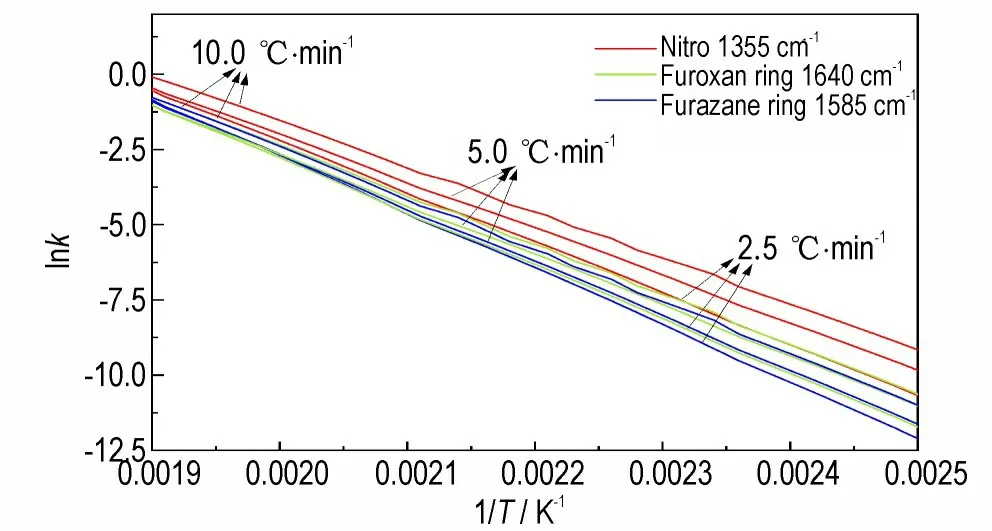
图7 DNTF 温度倒数与反应速率对数拟合曲线Fig.7 The reciprocal of temperature and the logarithmic fit⁃ting curve of reaction rate of DNTF
由图7 曲线可知,在不同升温速率环境中,各个基团的反应速率随温度升高而增大,反应速率快慢顺序为:硝基>氧化呋咱基团>呋咱基团,即在相同温度条件下,硝基反应速率更快;在相同反应速率条件下,硝基的反应温度更低,因此硝基表现出了活化能低、反应速率快的特点,可推测在整个热分解温度范围内,DNTF 的分解反应首先发生在C—NO2硝基的断裂。
由X⁃射线单晶分析[32]可知,DNTF 分子结构中的最长化学键为呋咱环连接的C—N 键(1.459、1.442 Å)、氧化呋咱环与呋咱环连接的C—C 键(1.445、1.472 Å)。针对DNTF 分子结构可能存在C—N 键或C—C 键的断裂形式,通过Materials studio 程序和Dmol3 软件包,采用GGA/PBE 泛函的方法[33]进行DNTF 分子三种不同构型(见图8)优化和能量计算,其中所有的计算都在相同的理论水平下进行,以计算所有结构的频率来验证结构的稳定性(过渡态有且只有一个虚频),不同构型能量计算结果见表2。

图8 不同DNTF 分子构型图Fig.8 Configuration diagrams of different DNTF molecules
由表2 数据计算可以看出,C—N 键断裂所需的能量小于C—C 键断裂的能量,即DNTF 分子加热分解时,脱去NO2官能团更易发生。事实上,快速热裂解试验显示[26],DNTF 炸药在初期生成的NO 量较大,没有检测到大分子量的分子碎片,说明DNTF 热分解时分解速度大且完全生成小分子,因此进一步验证了DNTF 炸药热分解的“引发点”应为呋咱环上的C—N硝基。

表2 不同DNTF 分子构型能量计算结果Table 2 Energy calculation results for different DNTF molec⁃ular configurations
呋咱环中的C、N、O 元素几乎处于一个面,氧化呋咱环内C、N、O 元素以及环外的氧元素处于共面,但是二个呋咱环与氧化呋咱环并不处于同一个平面;在平面的呋咱环上电子将形成一个共轭大π 键,而氮氧键(N—O)的键长接近或超过了其单键键长,难以有效参与环的共轭,从而导致整个分子共轭性较弱,因此,N—O 键成为影响呋咱环热稳定性的薄弱环节。由于氧化呋咱环外的氧原子具有亲电作用,造成氧化呋咱环内N—O 的键长(1.440 Å)大于呋咱环内的N—O 键键长(1.366~1.379Å),进一步弱化氧化呋咱环内的N—O 的共轭效应,导致虽然氧化呋咱环和呋咱环的热分解反应均发生在环内N—O 键,但是氧化呋咱环更容易发生化学反应,文中前述基团活化能的数据也进一步证明了这一点。
3.3 热分解机理分析
根据DNTF 特征基团的红外吸收强度与温度变化规律、特征基团的动力学参数以及分子结构特性等,推测DNTF 的热分解机理主要为3 步,如图9 所示。
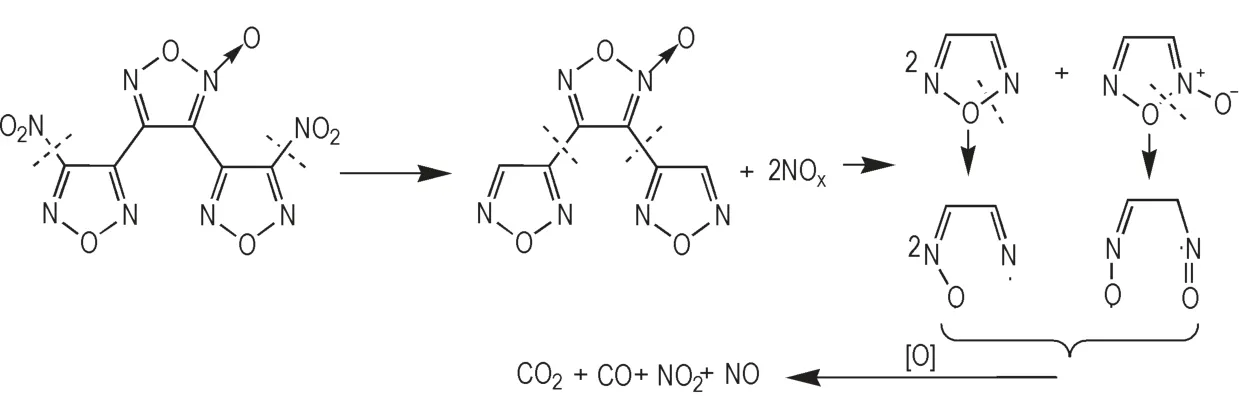
图9 DNTF 热分解机制Fig.9 Thermal decomposition mechanism of DNTF
由图9 可知,DNTF 的分解过程为:
第一步为呋咱环外连接的硝基发生分解反应,形成氮氧化物;
第二步为呋咱环与氧化呋咱环连接的C—C 键发生断裂;
第三步为随着温度不断提升,氧化呋咱环和呋咱环中N—O 键的共轭效应相对较弱,N—O 键断裂,导致反应的进一步发生[34],其中由于氧化呋咱环活化能相对较低,氧化呋咱环比呋咱环更快发生分解,最终形成CO、CO2、NO、NO2等产物。
4 结论
本研究通过分析DNTF 原位红外热分解动力学及机理,得出结论如下:
(1)DNTF 的硝基、氧化呋咱环、呋咱环等特征基团热分解受到三维扩散机理控制,机理函数方程为(1-(1-α)1/3)2;由不同加热速率下的特征基团动力学参数显示,DNTF 特征基团的反应活性为硝基>氧化呋咱环>呋咱环,随着加热速率提高,反应活性呈增大的趋势。
(2)DNTF 热分解机理可分为3 个步骤:首先分子中的硝基发生断裂;其次为呋咱环与氧化呋咱环连接的C—C 键发生断裂;最后为氧化呋咱环和呋咱环中N—O 键断裂,且氧化呋咱环比呋咱环更快地发生分解反应。
