帕金森病伴快速眼动睡眠行为障碍的弥散张量成像研究
2022-06-14张君君蒋丽娟
陈 婧 钟 侦 张君君 蒋丽娟 黄 卫
南昌大学第二附属医院,江西 南昌 330006
作为临床常见的慢性、异质性神经退行性病变,帕金森病(Parkinson’s disease,PD)以运动症状为典型特征,其非运动症状也尤为突出。睡眠障碍是其中之一,发病率65%~95%[1]。快速眼动睡眠行为障碍(rapid eye movement sleep behavior disorder,RBD)是睡眠障碍中一种较为突出的表现类型,其特征是在快速眼动期(rapid eye movement,REM)睡眠中正常肌张力抑制消失,而代以和梦境一致的异常行为活动,其发病率可高达50%[2]。RBD 不仅使PD 患者的睡眠质量差、存在外伤性风险,还可能是早期痴呆的风险因素[3-4],因而早期识别和诊断RBD 非常重要。目前,多导睡眠监测(polysomnography,PSG)是明确诊断RBD 的主要手段[5],但进行此项检查时往往受到多方面主客观因素干扰,在实际临床工作中存在一定的不足。因此,试图通过发现较为稳妥真实的影像检查检测患者脑组织是否存在病理变化,以提高RBD 诊断十分必要。弥散张量成像(diffusion tensor imaging,DTI)是用以描述大脑结构的非侵入性的一种功能磁共振成像,可测定各向异性分数(fractional anisotropy,FA)值(水分子布朗运动),再利用FA 值描述神经组织是否完整、连续[6]。到目前为止,DTI 已被大量运用于PD 以及多系统萎缩(multiple system atnphy,MSA)、进行性核上性麻痹(progressive superanuelear palsy,PSP)、路易体痴呆(dementia with lewy bodies,DLB)等帕金森叠加综合征疾病的鉴别[7-8]。目前,国内外DTI 与RBD 的相关研究较少,且研究结果缺乏一致性[9-11],DTI 对RBD的研究价值仍需进一步探讨。因此,本研究拟分别选取PD 患者、健康受试者进行DTI 检查和磁共振薄层扫描,探究其在诊断PD合并RBD中的临床价值。
1 对象与方法
1.1 对象选取2020-04—2021-06 南昌大学第二附属医院住院部及门诊符合PD 诊断标准的患者(H-Y分级2~3.5级),所有受试者及家属均详细了解实验过程、目的,自愿参与试验。
1.2 方法
1.2.1 受试者一般资料:记录入选PD患者和健康受试者的一般特征,既往情况,如有无手术外伤、慢性病等。
1.2.2 运动功能评估:由具有一定临床经验的运动障碍专科医师对每例PD患者进行MDS-UPRDS量表第3部分评估,并记录相对应的分数。
1.2.3 PSG 检查:所有入选的PD 者及健康受试者均自愿接受检查。要求受试者14 d前不得服用安定类药物,检查当日应当避免饮用咖啡、可乐、茶或含酒精的兴奋性饮料,并且提前至睡眠监测室熟悉环境。采用Stellate Harmonic 多导睡眠监测仪对受试者行>6 h连续睡眠情况记录,操作流程参考2019年发布的多导睡眠监测技术操作指南。2 名具备一定操作和阅读能力的睡眠电生理医师对所有检查结果作出分析,据分析结果将所有受试者分为PD伴RBD(PD+RBD)组、PD 不伴RBD(PD-RBD)组,另选取25例健康受试者作为正常对照(NC)组。入组70 例患者,男女性别比例为1.8∶1,年龄(63.38±7.86)岁,其中NC 组25 例,年龄(61.30±7.78)岁;PD-RBD 组20例,年龄(62.27±7.45)岁;PD+RBD 组25 例,年龄(66.07±8.15)岁。见表1。
1.2.4 颅脑磁共振检查:(1)扫描部位:根据BRAAK等[12]最早提出的理论,在PD 疾病的病理发展过程中,1~2 期病变仅限于延髓,包括网状结构、中缝尾核、蓝斑复合体和延髓的核团(舌咽神经及迷走神经运动核),3 期病变主要累及脑干,如中脑黑质致密部,4 期病变累及颞叶皮层、嗅前核、基底前脑。因此,将DTI扫描点分别定位在蓝斑、脑干、黑质及内囊前肢区域。(2)采用GE 3.0T 超导磁共振扫描,采用薄层扫描(层厚度2 mm,层间距1 mm)方便定位,单次激发SE EPI 序列,TE minimum,TR 10 000 ms,视野24 cm×24 cm,矩阵130×128,激励次数4 次,扩散敏感因子b=0 和1 000 s/mm2,层厚3 mm,层间距1 mm,扩散敏感梯度方向15 个。蓝斑定位[15](蓝斑中心的3-D 参考资料:距脑桥延髓交界处17.5 mm,距第四脑室1.0 mm,距中线3.0 mm),使用functool软件对DTI 影像图分析处理,手动描绘兴趣区(ROI),ROI 均为双侧对称,面积约为10 mm2,测量每个ROI的FA值(图1),并取其平均值。
1.3 统计学方法所有数据分析使用SPSS 21.0 统计软件,计量资料用均数±标准差(±s)表示,计量资料2 组间采用成组t 检验及方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 2组运动功能障碍对比2组UPDRS-Ⅲ评分比较差异无统计学意义(P>0.05)。见表2、图2。
表2 PD-RBD组和PD+RBD组UPDRS-Ⅲ评分对比 (±s)Table 2 Comparison of UPDRS-Ⅲscores between PD-RBD group and PD+RBD group (±s)

表2 PD-RBD组和PD+RBD组UPDRS-Ⅲ评分对比 (±s)Table 2 Comparison of UPDRS-Ⅲscores between PD-RBD group and PD+RBD group (±s)
组别PD-RBD组PD+RBD组UPDRS-Ⅲ评分/分14.60±3.53 16.86±5.96 t值—1.067 P值0.297
2.2 各组FA均值比较对NC组、PD-RBD组及PD+RBD组FA均值方差进行分析,各组蓝斑左(F=12.001,P<0.001)、蓝斑右(F=29.658,P<0.001)、黑质左(F=9.738,P<0.001)、黑质右(F=10.639,P<0.001)、脑桥左(F=4.003,P=0.027)、脑桥右(F=5.023,P=0.012)总体均值不完全相等,差异均有统计学意义。见表3。
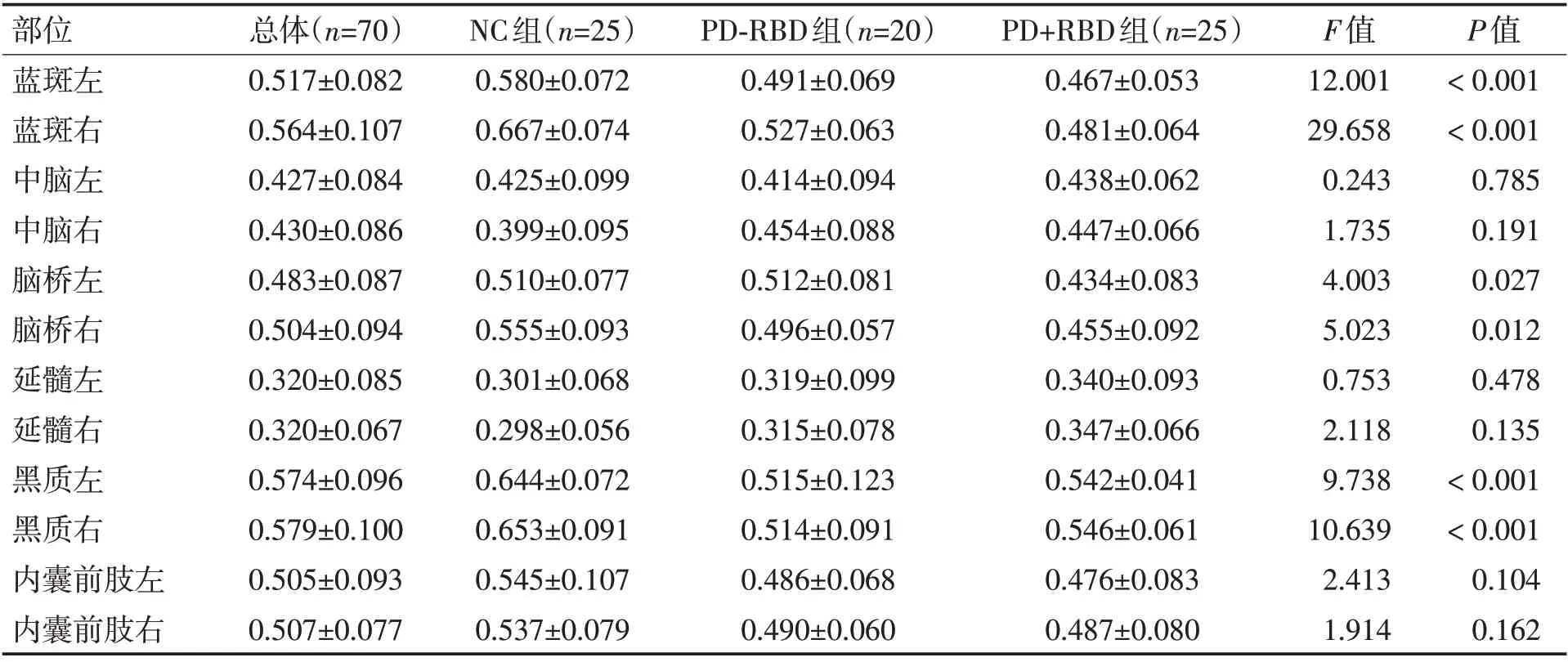
表3 NC组、PD-RBD组、PD+RBD组的FA均值方差分析Table 3 Variance analysis of FA mean of NC group,PD-RBD group and PD+RBD group
2.3 3 组FA 均值两两比较通过两两组间对比可得出,NC 组、PD-RBD 组蓝斑左(P=0.002)、蓝斑右(P<0.001)、黑质左(P<0.001)、黑质右(P<0.001)FA均值差异均有统计学意义。NC 组、PD+RBD 组蓝斑左(P<0.001)、蓝斑右(P<0.001)、黑质左(P=0.001)、黑质右(P=0.001)、脑桥左(P=0.016)、脑桥右(P=0.003)FA 均值差异均有统计学意义。PD-RBD 组、PD+RBD 组脑桥左(P=0.026)、右侧(P=0.046)FA 均值差异均有统计学意义。见表4。
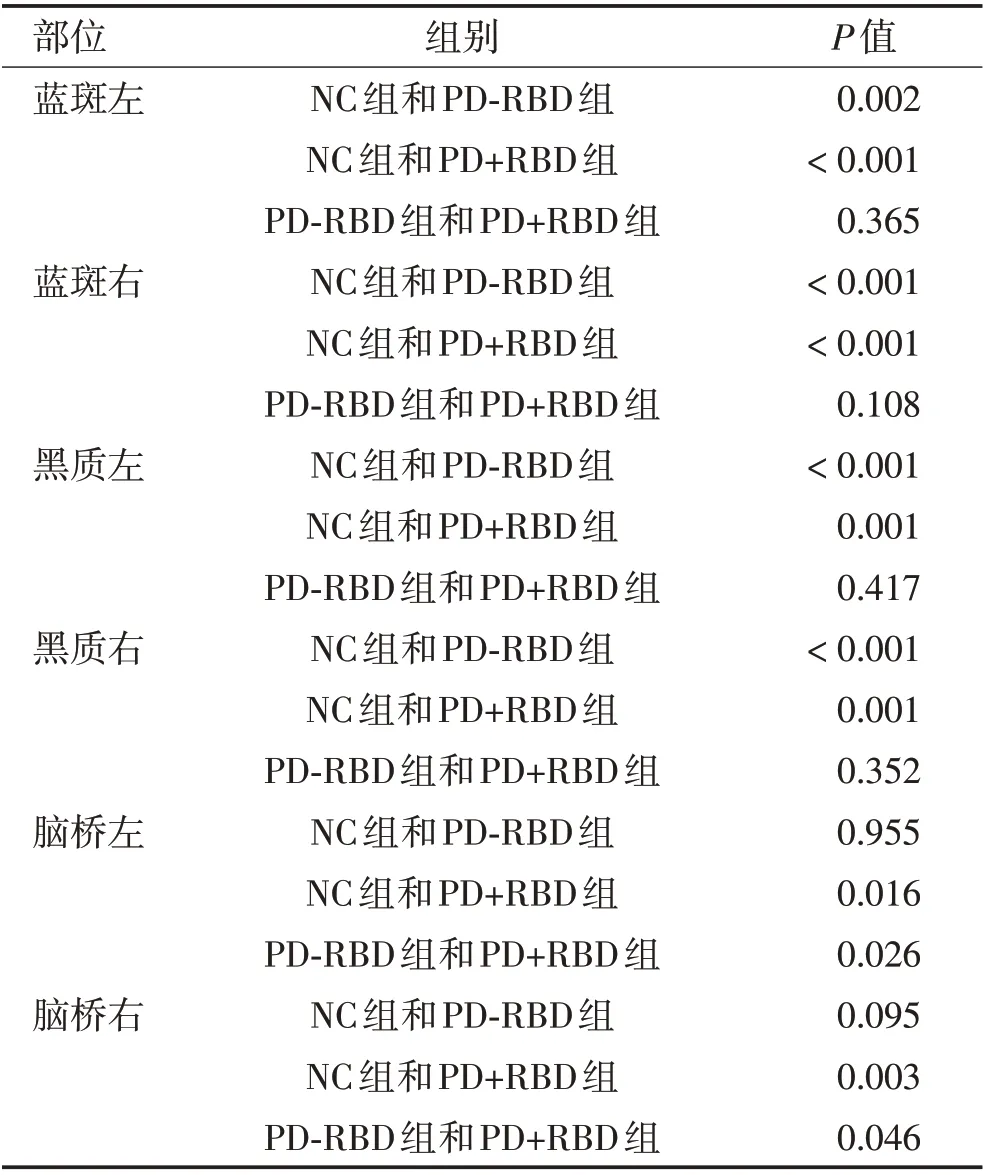
表4 NC组、PD-RBD组、PD+RBD组FA均值两两比较Table 4 Pairwise comparison of FA mean values of NC group,PD-RBD group and PD+RBD group
3 讨论
目前临床工作中PSG 仍 是 诊 断RBD 的最重要检查手段,通过对夜间持续呼吸频率、血氧饱和度、心率、睡眠时间等参数记录与分析,可以客观评价患者睡眠结构与特征。但实际临床工作中,运用PSG 检查需要患者的积极配合,花费时间长,难预约,其局限性显而易见。
DTI 作为一种新型的MRI 技术,可使脑白质微观结构在体内无创可视化,从而提供疾病的病理生理学的见解。分子随机、无规则的运动过程被定义为弥散,也称布朗运动。这种运动受到不同介质组织生理结构的影响,故水分子朝各方向的弥散速度不一致,弥散距离也不等,这种情况定义为各向异性[7]。DTI通过运用这种特性显示组织生理结构是否发生病理改变。多数研究采用FA 值、平均扩散率(mean diffusivity,MD)判断神经组织是否完整和连续[13-15],当其受到破坏时,FA值便下降。基于此,本文通过DTI分析各部位FA值判断RBD 患者特异性部位的微观结构是否改变,为其早期影像学诊断提供解剖学依据。
本研究未观察到PD-RBD 组与PD+RBD 组间UPDRS-Ⅲ评分存在显著差异,提示RBD 与PD 运动功能无相关性,但BUGALHO 等[16]的研究却表明RBD 对其运动症状存在影响,特别是运动迟缓。这可能是由本研究样本量小、抽样误差所致。本研究显示,与NC组比较,PD患者FA值在蓝斑、黑质区域出现降低,类似的结果出现在RBD 患者的脑桥区域,而3 组间FA 值在中脑、延髓、内囊前肢处显示无显著差异,可能原因如下:(1)多巴胺能神经元主要位于中脑的黑质致密区和腹侧被盖区,两区域存在不同的功能。前者大多依靠黑质纹状体通路调控人体动作,而后者与认知和记忆功能有关,主要涉及边缘系统、皮层通路,两区域之间密切联系,并在投射环路中有重叠的区域[17]。在中脑定位时,未将定位点精确在中脑腹侧被盖区,因而使得中脑区域的FA值与NC 组相比差异无统计学意义;(2)有研究者观察到,在DTI 中径向扩散率(radial diffusivity,RD)与轴向扩散率(axial diffusivity,AD)同时递增时,FA值可能不发生变化[20],其他研究[18-19]也观察到类似结果,原因仍未探明;(3)与选取的PD患者病情程度相关,本研究纳入的PD患者H-Y分期2~3.5期;当病情处于2 期时,PD 患者的病理改变主要发生在低位脑干的舌咽神经、迷走神经运动核处,而并非影响延髓所有部位[12],因而FA值在脑桥和延髓区域处可能差异无统计学意义;(4)尽管在病变早期中脑、延髓及内囊前肢等结构可能已经受累,但这些区域的微观结构改变程度甚小,不足以被DTI检测。
SCHERFLER 等[9]研究发现,FA 值在RBD 患者的脑桥区域有所减少。本研究也在PD+RBD患者中观察到类似结果。然而,PD-RBD 患者却无此改变,因此可以推测,在RBD 病变进展中脑桥微观结构受损可能扮演重要角色。既往相关研究也表明,由炎症、脑血管病变、脱髓鞘等病理导致的脑干病变均可引起RBD,表明脑干与RBD 的密切相关性[20-21]。因此,运用脑桥区域FA 值的改变判断PD 患者是否发生或可能发生RBD 可能是一种新的有效手段。但目前存在的问题是,对调节REM 睡眠相关的神经核团以及这些核团之间存在哪些神经纤维连接仍不清楚,需要后续进一步的研究。
黑质多巴胺能神经元的选择性凋亡、α-syn错误折叠是帕金森病的主要病理组成成分[22]。DENG等[14]观察到黑质区域的FA值下降,并认为这是多巴胺能神经元丢失所导致的,本研究也得出一致的结论,但其在PD 伴或不伴RBD 组中却未显示出统计学差异。可能的原因是,在RBD患者中也可能存在和PD类似的病理改变。事实上,RBD 可能并非单单是睡眠疾病,也有可能是α-syn 疾病,如PD、MSA、DBL 的最初表现[23-24]。
蓝斑核神经元停止发放是快速眼动睡眠出现的前提条件,其变性可导致睡眠紊乱[25]。本研究显示,与NC 组比较,PD 患者的蓝斑区FA 值下降,而这种差异未在PD+RBD 组、PD-RBD 组中显示,提示在疾病初期可能就存在蓝斑病变,尽管部分患者未表现出相应临床症状,但这可能与蓝斑病变的严重程度相关。BRAAK等[12]发现,随着PD的进展,病理改变并不限于黑质,还可累及舌咽神经、迷走神经核团,蓝斑、网状结构、中缝核等大脑结构。近些年来,相继有研究[26-29]表明,不仅蓝斑核神经元变性程度可高于黑质,其病变时间也可较早。早期的病理及影像研究[29]观察到,蓝斑和黑质区域一样也存在神经元丢失、嗜酸性包涵体形成等极其类似的病理学改变,且其丢失的程度可达60.0%~83.2%,远大于黑质[30-31]。此外,有研究[29]认为,PD 患者出现的震颤、运动减少也与蓝斑神经元的活动功能受损相关。目前PD 进展过程中蓝斑和黑质区域发生微观结构变化的先后顺序仍不完全清楚,因此,还需要进行更深层次的研究。GARCIA-LORENZO 等[33]的研究还发现,在黑色素敏感MRI 中,相较于PD-RBD 患者,蓝斑区域信号强度在PD+RBD患者中下降程度更为明显,然而本研究并未发现此差异,可能是因检查方式不一致,也可能是DTI 对于蓝斑神经元微观结构的损伤识别不足。
本研究揭示了RBD、PD 之间的关系,蓝斑和黑质的病理改变可能在两种疾病的发展过程中都存在。脑桥区域FA值的测定可为早期识别PD是否合并RBD提供一定信息,再结合相关量表、PSG等辅助检查能提高诊断的准确性,从而尽早有效干预,可有效促进患者早日康复、延缓病情进展和并发症的发生,对改善患者的生活质量有重要帮助。
