联合手术对原发性闭角型青光眼合并老年性白内障的临床疗效分析
2022-06-13曲圣家宫学武
曲圣家,宫学武
1.杜尔伯特蒙古族自治县中医医院眼科,黑龙江大庆 166200;2.齐齐哈尔医学院附属第二医院眼科,黑龙江齐齐哈尔 161006
正常老年人随年龄增长眼组织逐渐发生一系列改变。 白内障和青光眼是全球发生率最高的两种致盲性眼病,二者同时发生[1]。 原发性闭角型青光眼(primary angle-closure glaucoma,PACG) 是由于周边虹膜堵塞小梁网,导致房水外流受阻,从而引起眼压升高。小梁切除术是治疗PACG 的经典手术方式。据报道,小梁切除术后会加快白内障进展,许多患者在术后不久还需进行白内障手术[2]。
老年性白内障(senile cataract)指老年人晶状体发生变性混浊,致视力下降,甚至失明[3]。晶状体超声乳化术是现代白内障的主要手术方法。 目前对于该病发病机制尚未明确, 通常认为与营养障碍、 糖尿病、辐射等因素有关[4-5]。近几年,医学技术快速发展,白内障超声乳化联合青光眼房角分离术已应用在闭角型青光眼合并白内障的治疗中, 通过房角分离术开放狭窄的房角,再联合超声乳化技术,能够从根本上改善患者眼前段拥挤状况[6]。 因此,该研究对该院2018 年 1 月—2020 年 12 月收治的 41 例老年性白内障合并PACG 患者为研究对象, 分析联合手术的作用效果,现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的小梁切除术后复发的PACG 合并白内障患者 41 例(44 眼),男 17 例(18 眼)、女 24例(26 眼),平均年龄(66.61±6.03)岁。 小梁切除术至该次就诊的时间为6 个月~17 年。 所有入院患者的治疗方法均采用超声乳化吸除术+人工晶状体置入+房角分离术。术前患者及家属均签署知情同意书,该研究所选患者已经过医学伦理委员会审批通过。
1.2 纳入与排除标准
纳入标准:①结合患者临床症状,并应用裂隙灯和B 超等各项检查结果,确诊为青光眼合并白内障的患者;②患者处于病情稳定期,行小梁切除术≥3个月,至少非同一天3 次测量眼压≥21 mmHg;③未患有影响眼压的其他疾病;④各项指征符合手术要求。
排除标准:①具有眼底出血、视网膜脱离、角膜病等手术治疗病史,心、肝、肺、肾等重要器官功能障碍者;②房角镜检测显示房角粘连关闭在270°以内者。
1.3 方法
1.3.1 围术期用药 入院后进行裂隙灯显微镜、 眼部A 型超声、眼底、眼压及角膜内皮细胞检查。术前3 d术眼滴抗生素滴眼液。 所有患者的麻醉和手术均由同一位技术成熟的眼科副主任医师完成, 麻醉方式为球周麻醉, 术后均使用妥布霉素地塞米松滴眼液(商品名:舒视明;国药准字 H20073641),4 次/d,术后每周减少1 次/d,连续用药2 周。
1.3.2 手术方法 充分做好术前准备, 如剪眼毛、冲泪道等,在手术前30 min 散瞳,用复方托吡卡胺滴眼液或托吡卡胺滴眼液滴眼,3~5 min/次,两次点手术眼,充分散瞳后,让患者平躺于手术台上,稀碘伏常规消毒手术眼,消毒范围要足够大,消毒液不要进入结膜囊内,以免损伤角膜,消毒完成后,铺眼科专用无菌孔巾,开睑器撑开手术眼睑,作主、侧切口。将黏弹剂推注入前房,黏弹剂适量,太多会导致眼压太高, 太少使前房空间不够, 眼内压应保持在正常眼压,撕囊镊由主切口进入,撕连续环形撕囊,大小适中,不能过大,也不要过小,弯针头注射器注冲洗液,利用冲洗液进行水分离和水分层,且要彻底。超声乳化针头从主切口进入前房, 超声乳化晶状体吸除晶状体,利用助吸手柄I/A 彻底吸出残余皮质,如果后囊有絮状物残留或有混浊, 利用助吸手柄进行后囊抛光后,前房及囊袋内注入黏弹剂,弯针头尖置入房角处,将黏弹剂缓慢注入,通过黏弹剂分离房角,分离360°虹膜根部和小梁网,直至虹膜根部和小梁网彻底分开(用房角镜观察)。 助吸手柄吸除前后房黏弹剂,包括人工晶状体后方的黏弹剂,视主侧切口密闭情况决定是否需要水密闭切口, 此手术均为同一医生完成。
1.4 观察指标
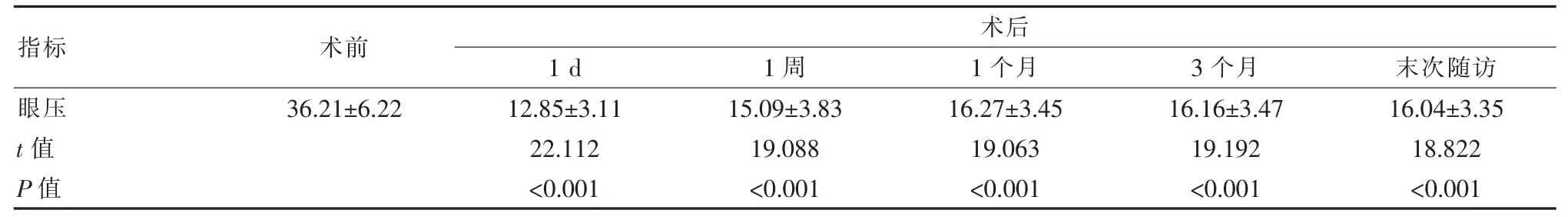
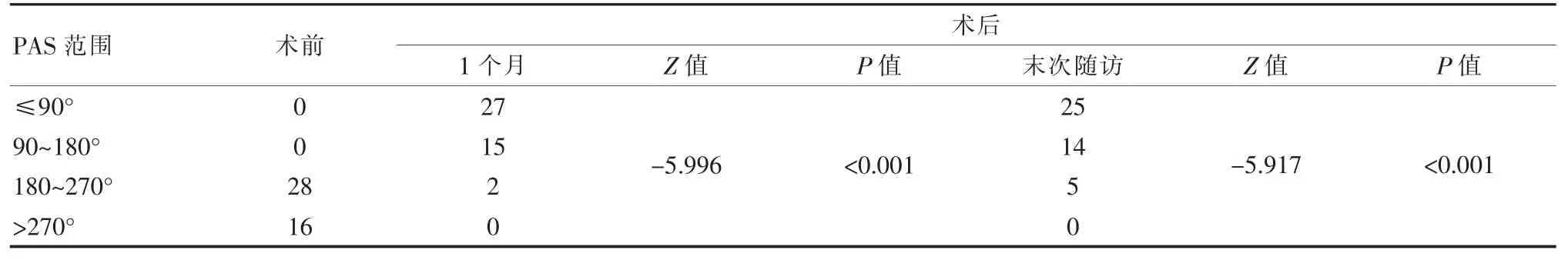
术后通过国际标准视力表检查患者视力, 将患者的最佳矫正视力(BCVA)分为4 个等级,分别为≥0.6、0.3~<0.6、0.1~<0.3 和<0.1,统计不同时间患者的视力分布情况; 利用非接触眼压计监测患者眼压数值;利用超声生物显微镜测量前房中央深度数值;利用动态房角镜观察粘连性关闭(PAS)范围。 PAS 范围的等级分类:PAS 范围>270°、180° 采用SPSS 21.0 统计学软件进行数据分析。 符合正态分布的计量资料采用()表示,使用配对t检验或秩和检验;计数资料采用频数表示,采用秩和检验。 P<0.05 为差异有统计学意义。 术后BCVA≥0.6 及0.3~<0.6 的明显多于术前,而 BCVA 0.1~<0.3 及<0.1 的患者明显少于术前,差异有统计学意义(P<0.001)。 见表 1。 表1 患者术前术后BCVA 的变化比较 术后 1 d、1 周、1 个月、3 个月及末次随访时患者眼压与术前比较, 眼压均降低, 差异有统计学意义(P<0.001)。 见表 2。 表2 患者术前及术后1 d、1 周、1 个月、3 个月和末次随访眼压变化比较[(),mmHg] 表2 患者术前及术后1 d、1 周、1 个月、3 个月和末次随访眼压变化比较[(),mmHg] 注:t、P 值为与术前比较得到的检验值 指标 术前术后1 d 1 周 1 个月 3 个月 末次随访眼压t 值P 值36.21±6.2212.85±3.11 22.112<0.001 15.09±3.83 19.088<0.001 16.27±3.45 19.063<0.001 16.16±3.47 19.192<0.001 16.04±3.35 18.822<0.001 2.3.1 术前、 术后1 个月和末次随访时患者中央前房深度和角膜内皮细胞数比较 患者术后1个月和末次随访时中央前房深度与术前比较,差异有统计学意义(P<0.001);角膜内皮细胞数术后 1 个月、术后末次随访与术前比较,差异无统计学意义(P>0.05)。 见表3。 表3 患者术前及术后1 个月和末次随访中央前房深度和角膜内皮细胞数比较() 表3 患者术前及术后1 个月和末次随访中央前房深度和角膜内皮细胞数比较() 注:t、P 值为与术前比较得到的检验值 指标术前中央前房深度(mm)t 值P 值角膜内皮细胞数(个/mm2)t 值P 值术后1 个月 末次随访1.84±0.39 2 661.66±408.45 4.09±0.45-36.849<0.001 2 568.82±398.94 1.636 0.109 4.03±0.43-38.785<0.001 2 560.02±400.03 1.767 0.084 2.3.2 术前、 术后1 个月和末次随访时患者的PAS范围比较 患者术前与术后1 个月及末次随访的PAS范围比较,差异有统计学意义(P<0.001)。 见表 4。 表4 患者术前及术后1 个月和末次随访的PAS 范围比较 目前, 致盲性居全世界前两位的是青光眼和白内障,两种疾病均为老年人常见的眼病。青光眼中原发性青光眼的主要发病因素为病理性眼压增高及视神经供血不足, 其中PACG 是发病率较高的一种。PACG 是由于眼内房角突然变狭窄或关闭, 使不断循环的房水不能及时排出,而引起眼房胀满房水,导致眼压急剧升高造成的[7]。患者表现为恶心、呕吐、眼部及同侧头疼的症状。当青光眼与白内障同时发生,视力会进一步减弱、视野缺损,病情严重的将导致患者失明,影响其生活质量[8]。 老年人青光眼术后可导致白内障进展的速度加快, 严重影响老年人的视力及正常生活。而白内障是一种多因素导致的晶状体光学质量下降的退行性疾病。 其中老年性白内障最常见,并随年龄增长其发病率升高[9]。 青光眼通常采用手术治疗, 小梁切除术是一种常用术式。超声乳化是改善白内障症状的有效术式。小梁切除术可帮助闭角型青光眼患者重新开放房角,降低眼压。 目前,虽然小梁切除术是治疗闭角型青光眼的主流手术方法,但其并发症较多,术后青光眼的复发率也较高,达到13%~21%,而且术后患者的视力不能提高,而对于伴发白内障的青光眼患者,小梁切除术可能导致眼压出现异常, 并且会加重白内障的发展及症状,发生并发症的风险较高[10]。 晶状体超声乳化术是近十年来眼科发展最快的一项技术,在手术治疗白内障疗效方面得到肯定。晶状体超声乳化术正由动力型向抽吸型超声乳化过渡, 目的是降低超声乳化的时间和能量, 来减少并发症的发生,在临床上这种方法已经广泛应用。 研究发现,晶状体超声乳化术治疗白内障后可提高合并青光眼患者术后视力[11-12]。 研究显示,房角分离术联合超声乳化术代替小梁切除术治疗闭角型青光眼合并白内障时,对患者的临床症状及视野有明显改善[11],房角分离术可以分离已经粘连的房角, 使前房的结构进一步改善, 当前大多数临床医生都会应用房角分离手术来增加房水外流的速度, 使患者的眼压进一步改善,直至正常。此种手术在临床上应用时发现与以往青光眼手术比较能明显降低手术并发症, 眼压一过性增高的概率极低,恶性青光眼的发生率几乎为零,手术风险明显降低, 并且此种手术可以明显减少患者的经济支出,减轻患者的术后护理及压力[13-14]。 随着多种新型抗青光眼药物的问世及超声乳化术治疗白内障的普及, 理论上晶状体超声乳化术联合房角分离术更有效[15],可达到降低眼压和提高视力的疗效。 据报道,超声乳化白内障吸除、人工晶体植入联合房角分离术,创伤小,治疗时间也较短,可以保留角膜缘的手术区域, 且无小梁切除术引起的创伤及并发症, 同时也可避免多次手术后眼球壁形成瘢痕组织[16-18]。晶状体摘除术通过直接摘除晶状体和间接借助超声乳化灌注液冲击力和黏弹剂机械分离力增加前房深度和房角开放角度, 减少PACG 发病危险因素。 该研究发现,与术前比较,患者术后BCVA 均有所提高(P<0.001),说明视力有一定改善并较稳定;术后 1 d、1 周、1 个月、3 个月及末次随访时患者眼压同术前比较,术后眼压明显降低(P<0.001),并在不同时间窗内也能够维持相对稳定。 患者术后1个月和末次随访时中央前房深度分别为 (4.09±0.45)、(4.03±0.43)mm,均高于术前(1.84±0.39)mm(P<0.05);角膜内皮细胞数较术前也有所改善。 患者术后1 个月和末次随访时中央前房深度明显变深(P<0.001); 比较角膜内皮细胞数无明显改变 (P>0.05),说明联合手术不会导致术后角膜内皮细胞破坏,安全可行;其中房角镜下有5 眼PAS 范围大于两个象限,这可能是青光眼复发的原因之一。这与李维娜等[18]的研究一致,其研究中对晶状体超声乳化联合房角分离术治疗小梁切除术后复发的原发性闭角型青光眼合并白内障的临床效果发现, 于术后1 d、1 周、1 个月、3 个月及末次随访患者的 BCVA 分布等级与术前相比显著改善, 患者眼压均较术前降低, 术后1 个月和末次随访时患者中央前房深度分别为 (4.05±0.35)、(4.00±0.38)mm 较术前 (1.78±0.47)mm 均明显增加, 术后1 个月和末次随访时患者的PAS 范围均小于术前,以及术后1 个月和末次随访时角膜内皮细胞数较术前改善。由此可见,晶状体超声乳化联合房角分离术治疗小梁切除术治疗老年性白内障合并PACG 患者具有显著效果, 可提高患者视力,降低眼压,是安全有效的治疗方法。其中,对于前房较浅的患者,手术操作空间狭窄,可能触及角膜内皮及虹膜,小梁切除术后,由于存在上方角巩膜缘瘢痕、虹膜萎缩和周边切口,增加手术难度。 因此在手术过程中应保证操作动作轻柔缓慢, 利用黏弹剂维持前房,分离房角。操作完成后利用房角镜观察是否暴露可见小梁网。 综上所述, 应用晶状体超声乳化联合房角分离术治疗小梁切除术后复发PACG 合并白内障, 能够明显提高视力,降低眼压,且对角膜内皮细胞损伤非常小,是值得推广且安全有效的治疗方法。1.5 统计方法
2 结果
2.1 患者术前、术后BCVA 的变化比较

2.2 患者术前、术后眼压变化比较
2.3 患者术前、术后中央前房深度、角膜内皮细胞数和PAS 范围的变化

3 讨论
