一例猪链球菌与猪传染性胸膜肺炎放线杆菌混合感染的诊治报告
2022-06-13程家园张垚垚王嘉珍
陆 阔,程家园,张垚垚,王嘉珍,李 郁
(安徽农业大学动物科技学院,安徽 合肥 230036)
猪链球菌病是由猪链球菌(Streptococcus suis,SS)引起的一种重要的人畜共患传染病。临床上主要表现为淋巴结脓肿、脑膜炎、关节炎及败血症等症状。目前,SS根据荚膜多糖抗原特性的不同可分为35种血清型,其中1、2、7、9型通常被认为是优势血清型,分布广泛并且致病性较强。SS属于猪体内的常在菌之一,可原发或继发致病,是威胁养猪业的主要细菌性病原。
猪传染性胸膜肺炎(Porcine infectious pleuropneumonia)是由猪传染性胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae, APP)引起的以急性出血和慢性纤维素性坏死性胸膜炎病变为主要特征的猪呼吸道传染病,病猪和亚临床感染带毒猪是本病的主要传染源。APP是一种条件性致病菌,常存在于健康猪的扁桃体和上呼吸道,可通过猪之间的直接接触或短距离飞沫传播,既能单独引起感染,也能与其他病原混合感染。
SS和APP是导致猪呼吸道病综合征(Porcine respiratory disease complex, PRDC)的主要病原菌,常造成生猪的急性死亡,给养猪场造成严重的经济损失。近年来猪病的混合感染呈现升高趋势,仅通过临床症状和病理变化难以确诊,还需要依靠微生物学检测方法和分子生物学技术进行鉴定。文章系对由SS、APP混合感染所致某集团公司猪场保育猪发病进行诊治,现将结果报道如下。
1 材料与方法
1.1 发病情况及病理变化
2021年10月中旬,某集团公司猪场陆续有保育猪群出现不明原因死亡病例,病猪表现出皮肤发绀、突然瘫痪和急性死亡等症状,猪群曾免疫猪繁殖与呼吸综合征疫苗,发病猪只曾使用庆大霉素、磺胺类和头孢类药物治疗。
对10月17日送检至安徽农业大学动物传染病研究室的2头35日龄发病猪(分别编为1号、2号)心脏、肺脏、脾脏、肝脏、下颌淋巴结、腹股沟浅淋巴结进行病理变化观察。1号猪心冠脂肪部分胶冻样变;肺脏充血、水肿;脾脏淤血;肝脏质脆、淤血,边缘有出血性梗死灶;下颌淋巴结出血;腹股沟浅淋巴结肿大、出血,切面湿润多汁。2号猪心脏无明显病理变化;肺脏淤血,表面有白色坏死灶;脾脏充血;肝脏质脆、黄染,表面有出血点;下颌淋巴结肿大;腹股沟浅淋巴结肿大,切面隆起呈灰白色。
1.2 主要材料
0.6%酵母浸膏胰酪胨大豆琼脂(TSA-YE)、0.6%酵母浸膏胰酪胨大豆肉汤(TSB-YE)、麦康凯琼脂培养基(MAC)均购自绍兴天恒生物科技有限公司;新生小牛血清均购自北京索莱宝科技有限公司;琼脂糖、烟酰胺腺嘌呤二核苷酸(NAD)均购自生工生物工程(上海)股份有限公司;2×TaqPCR MasterMix、DL 2 000 DNA Marker均购自天根生化科技有限公司;抗生素药敏纸片购于杭州微生物试剂有限公司;微量DNA提取试剂盒购自Omega Bio-Tek公司;病毒DNA/RNA提取试剂盒购自杭州博日科技股份有限公司;猪瘟病毒(Classical swine fever virus, CSFV)通用型实时荧光RT-PCR检测试剂盒、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)通用型实时荧光RT-PCR检测试剂盒和非洲猪瘟病毒(African swine fever virus, ASFV)荧光PCR检测试剂盒均购自哈尔滨元亨生物药业有限公司;所用引物均由通用生物系统(安徽)有限公司合成。
1.3 实验室检测
1.3.1 细菌和病毒组织核酸检测 将病猪下颌淋巴结、心脏、肺脏、肝脏、脾脏、腹股沟浅淋巴结组织混合后研磨取上清液,分别用微量DNA提取试剂盒和病毒DNA/RNA提取试剂盒提取上清液中核酸作为模板。通过PCR方法检测6种细菌核酸和2种病毒核酸(引物见表1),包括SS、APP、猪丹毒丝菌(Erysipelothrix rhusiopathiae,ER)、副猪嗜血杆菌(Haemophilus parasuis,HPS)、多杀性巴氏杆菌(Pasteurella multocida,Pm)、沙门氏菌(Salmonella)、猪圆环病毒2型(Porcine circovirus type 2, PCV2)和猪伪狂犬病病毒(Pseudorabies virus, PRV)。通过实时荧光定量RT-PCR方法检测CSFV、PRRSV核酸,实时荧光定量PCR方法检测ASFV核酸,按照检测试剂盒说明书操作。

表1 SS、ER、HPS、APP、Pm、Salmonella、PCV2、PRV引物序列
1.3.2 细菌分离培养及形态学观察 无菌采集2头病猪下颌淋巴结、心脏、肺脏、肝脏、脾脏、腹股沟浅淋巴结,划线接种于5%兔血琼脂培养基、MAC、TSA培养基(含5%小牛血清和1.5%NAD),采用需氧、厌氧和微需氧3种培养方式,置于37 ℃培养24 h。挑取单一菌落进行革兰氏染色,镜检,观察分离菌的菌体形态特征。
1.3.3 分离菌PCR鉴定 煮沸法提取细菌核酸,通过PCR方法检测6种细菌核酸,包括SS、ER、HPS、APP、Pm和Salmonella。所用引物序列同1.3.1。
1.3.4 分离菌血清型鉴定 参考文献[1],设计SS特异的cps基因引物,通过PCR方法确定菌株的血清型。分型引物见表2。

表2 SS血清型分型PCR引物
1.3.5 药物敏感性试验 参照美国临床和实验室标准化协会(Clinical Laboratory Standards Institute,CLSI, 2016)推荐的方法,采用Kirby-Bauer纸片琼脂扩散法测定分离株对18种药物的敏感性。
2 结果与分析
2.1 细菌和病毒组织核酸检测结果
通过PCR及实时荧光RT-PCR方法检测病原核酸,结果显示,1号猪病料组织核酸检测为SS、APP阳性,2号猪病料组织核酸检测为SS阳性,见图1。HPS、Pm、ER、Salmonella、PCV2、PRV、CSFV、PRRSV、ASFV核酸检测均为阴性。
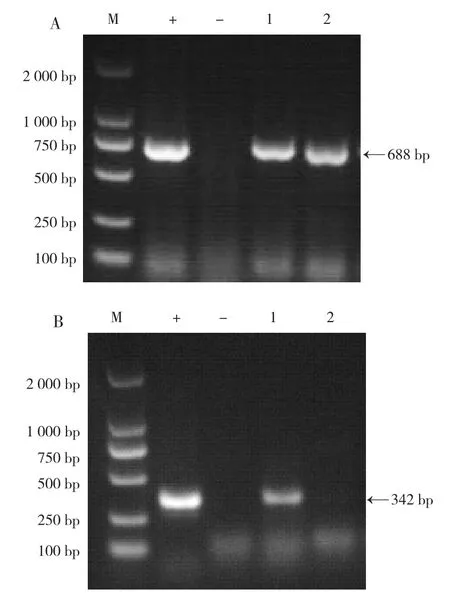
图1 病原核酸检测结果
2.2 细菌分离培养及形态学观察结果
自1号猪的心脏、肝脏、腹股沟浅淋巴结和2号猪的心脏各分离出1株可疑菌。分离菌在TSA培养基(含5%小牛血清和1.5%NAD)上呈灰白色半透明、表面光滑、边缘整齐针尖状菌落,在5%兔血琼脂培养基上呈灰白色、表面光滑、边缘整齐小菌落,呈β溶血。革兰氏染色结果均阳性,呈球形或卵圆形,链状排列。初步推断,分离菌为SS。见图2。

图2 分离菌的菌落形态及革兰氏染色镜检形态
2.3 分离菌PCR鉴定结果
PCR产物经1.0%琼脂糖凝胶电泳后,扩增出688 bp大小的预期目的条带,表明4株分离菌均为SS。见图3。
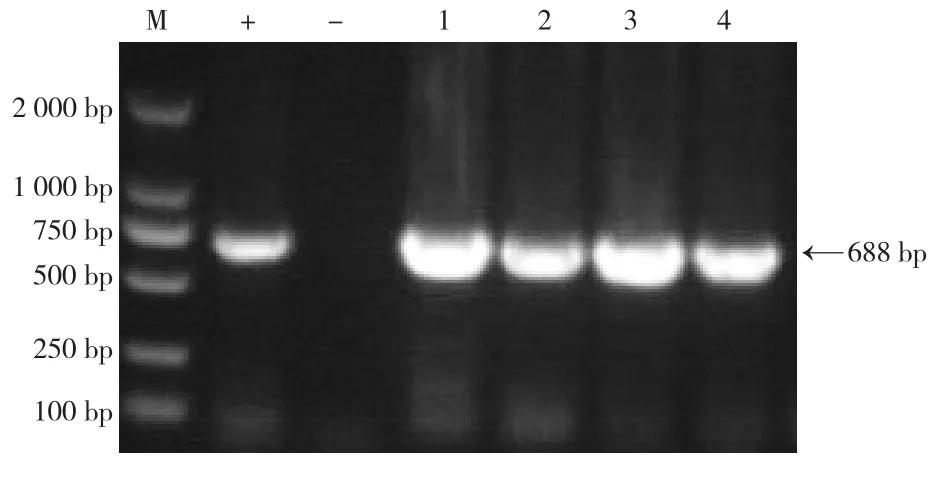
图3 分离菌PCR鉴定结果
2.4 分离菌血清型鉴定结果
PCR产物经1.0%琼脂糖凝胶电泳后,自1号病料的心脏、肝脏、腹股沟浅淋巴结分离的3株SS扩增出368 bp大小的预期目的条带,为SS9;自2号病料的心脏分离的1株SS扩增出633 bp大小的预期目的条带,为SS10。见图4。
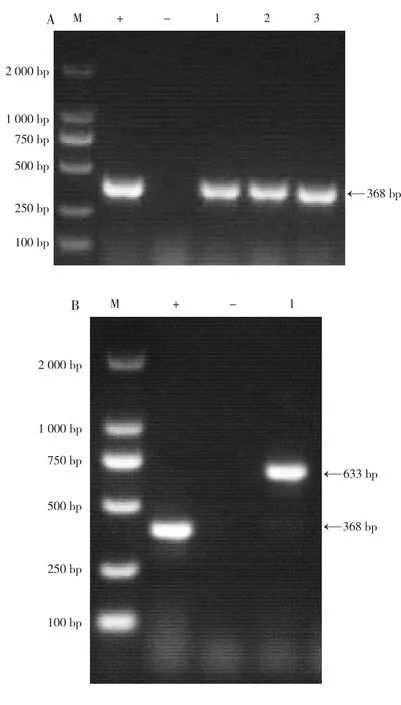
图4 分离菌血清型鉴定结果
2.5 药敏试验结果
结果显示,4株SS对复方新诺明、青霉素、红霉素、甲氧苄胺嘧啶、头孢曲松、庆大霉素、四环素、链霉素、多黏菌素B、头孢噻肟耐药率为100%;对氧氟沙星、氟苯尼考、林可霉素、环丙沙星、卡那霉素、多西环素耐药率为75%,对阿莫西林和新霉素耐药率为50%。见表3。
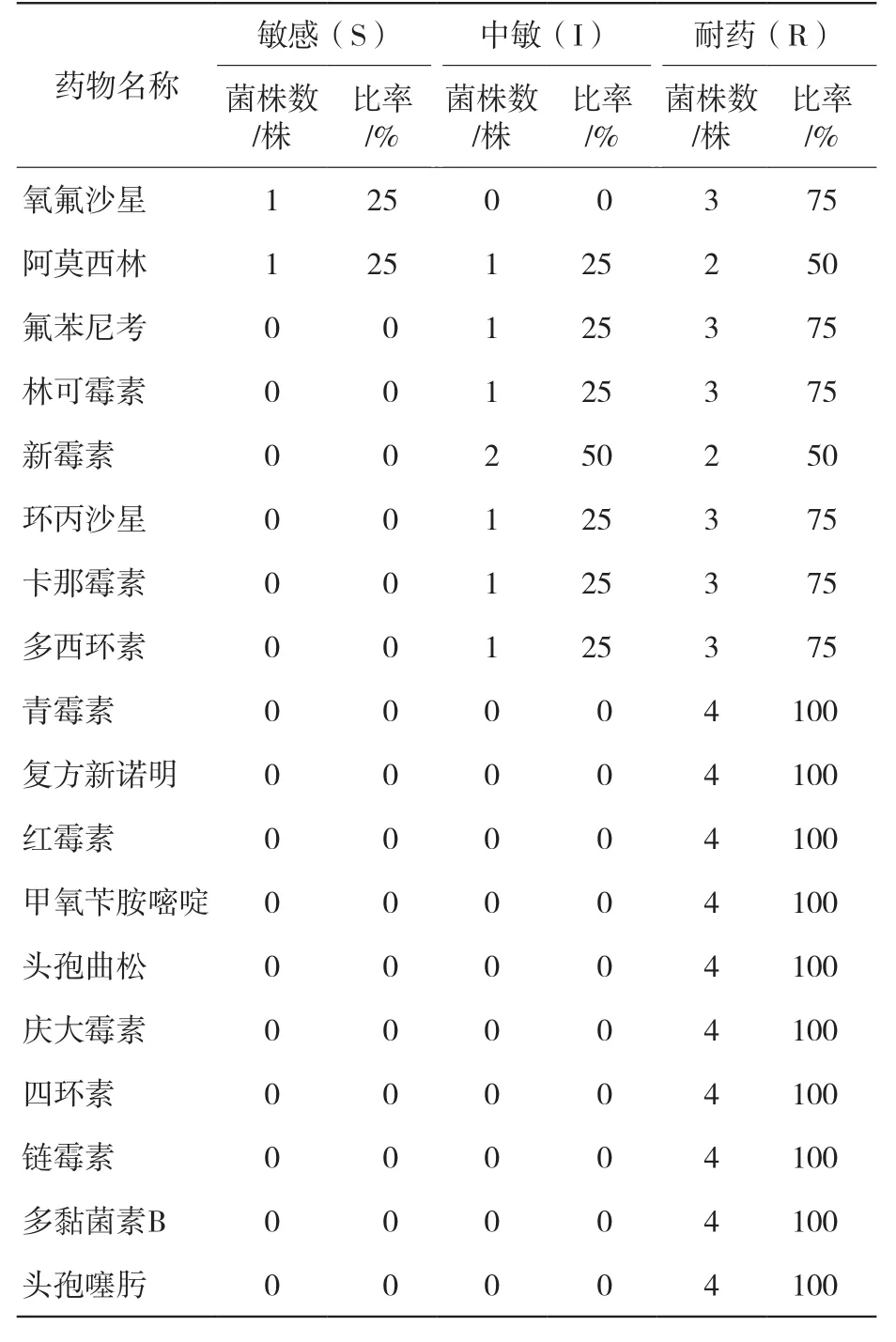
表3 4株SS分离株药敏试验结果
3 讨论
在现代集约化养殖中,随着养殖规模和地域范围的不断扩大,疾病的复杂程度也在发生着变化,混合感染或继发感染越来越严重,防治更为困难。在本病例中,PCV2、PRV、CSFV、PRRSV、ASFV 5种病毒核酸检测结果均为阴性,1号猪病料组织细菌核酸检测为SS、APP阳性,2号猪为SS阳性,提示细菌感染是引起该场猪群发病的主要原因。但在2头病猪组织中只分离到SS,未分离到APP,究其原因,一方面可能是因为病猪曾使用过庆大霉素、磺胺类和头孢类药物,将APP有效抑制或杀灭;另一方面可能与病料采集时间、病料组织运输或保存不当等因素密切相关。
长期以来,由于抗生素的不合理使用,使SS耐药菌株逐年增加,不仅出现了较高的耐药性,且多重耐药现象严重。焦安心[2]对196株SS安徽分离株进行药物敏感性分析,结果显示,分离株对复方新诺明、四环素、阿奇霉素、链霉素、强力霉素、庆大霉素、磺胺甲基异唑耐药率均达85.0%以上。彭凌等[3]对3株SS广东分离株进行药敏试验,结果表明,分离株对多西环素、阿莫西林、林可霉素、克林霉素、四环素等21种药物耐药率为100%,对头孢氨苄、头孢拉定、先锋Ⅴ、左氟沙星敏感。王治方等[4]对68株SS河南分离株进行耐药性研究,结果表明,分离株对四环素类药物耐药性最强,其中土霉素、强力霉素、四环素耐药率高达100%,对头孢噻呋、头孢他啶、阿莫西林和氨苄西林敏感性较好。而本病例中4株SS分离株对18种抗菌药物表现出不同程度的耐受,其中对复方新诺明、青霉素、红霉素、甲氧苄胺嘧啶、头孢曲松、庆大霉素、四环素、链霉素、多黏菌素B、头孢噻肟的耐药率为100%,对氧氟沙星、氟苯尼考、林可霉素、环丙沙星、卡那霉素、多西环素的耐药率为75%,对阿莫西林和新霉素的耐药率也达50%。这充分表明不同地区SS分离株对抗菌药物的敏感性存在差异,即使是同一地区甚至同一猪场不同时间段,SS分离株的耐药性也不尽相同。随着抗生素的使用,SS分离株的不同耐药趋势将会日益明显。因此,猪场应及时做好病原学诊断及敏感药物筛选,根据筛选出的敏感药物,针对性地治疗病原菌感染,从而减少盲目用药、降低细菌耐药性,达到有效防治猪病的目的。细菌性疾病控制和预防的一般思路就是依靠抗生素的使用,但在饲料端“禁抗”,养殖端“减抗、限抗”的新形势新要求下,通过疫苗来防治细菌性疾病所带来的优势逐渐显现。
SS血清型众多,目前从病猪体内分离出的SS血清型主要为SS1、SS2、SS7和SS9。近年来,SS9的分离率和流行率持续增加[5]。本病例中,共分离出3株SS9和1株SS10,说明该猪场同时存在多种血清型SS感染,针对流行菌株血清型研制菌苗是控制SS感染的有效措施。目前,国内市场猪链球菌病商品化灭活疫苗主要以SS2为主,即:猪链球菌病灭活疫苗(2型,HA9801株)、猪链球菌病+副猪嗜血杆菌病二联灭活疫苗(LT株+MD0322株+SH0165株)、猪链球菌病蜂胶灭活疫苗(SEZ+SS2)、猪链球菌病灭活疫苗(SEZ+SS2)、猪链球菌病灭活疫苗(SEZ+SS2+SS7)[6]。但已有不少研究表明SS流行血清型呈现出多样性,在临床实践中如SS4、SS12、SS14、SS31等血清型已被检测分离到,且有些菌株已被证明有较强致病性[7-8]。因此,对于除SS2外其它流行血清型疫苗的研制显得尤为重要。灭活疫苗因其具有良好的免疫原性,易于制备多价苗或联苗而适用于生产实际。这也提示猪场可通过筛选临床流行的优势菌株作为疫苗候选株,研制多价灭活疫苗,使不同血清型之间产生交叉保护,可达到一针多防的效果。
混合感染和疾病的发生不是一蹴而就的,猪病混合感染主要有发病前不同带毒猪间的相互感染和发病后的继发感染,这两种形式均会导致2种病原以上的混合感染。在非洲猪瘟流行的背景下,猪场应通过敏感药物、疫苗预防以及重视生物安全等多方面相结合的手段进行严格把控[9]。对于该猪场SS、APP混合感染的情况,建议定期开展细菌病流行病学调查及耐药情况调查,以指导临床合理用药;结合生产情况制定科学的免疫计划及免疫程序,定期开展抗体水平的监测,选择恰当的时间注射合适的疫苗;对病死猪及废弃物做好无害化处理,将发病猪进行紧急隔离,发病猪舍场区进行严格消毒;同时做好健康猪群的饲养管理,以增强健康猪的免疫力。
